Γενικά, επιδημιολογία
Ο καρκίνος παχέος εντέρου (ορθοκολικός καρκίνος) είναι ο συχνότερος καρκίνος του γαστρεντερικού σωλήνα και στο 90% των περιπτώσεών του προσβάλλει ασθενείς άνω των 50 ετών.
Αποτελεί το 10,5% όλων των καρκίνων παγκοσμίως και το 65% των περιπτώσεων εμφανίζεται στις ανεπτυγμένες χώρες, όπως οι Η.Π.Α., ο Καναδάς, οι Βορειοευρωπαϊκές χώρες, η Αυστραλία και η Νέα Ζηλανδία.
Στο Δυτικό κόσμο 1/20 ανθρώπους θα αναπτύξουν ορθοκολικό καρκίνο.
Περισσότερες από 1.000.000 νέες περιπτώσεις παρουσιάζονται και πάνω από 500.000 θάνατοι οφείλονται σε αυτή την κακοήθεια ετησίως.
Οι άνδρες και οι γυναίκες προσβάλλονται σε παρόμοια συχνότητα από καρκίνο του κόλου, ενώ ο καρκίνος του ορθού είναι κατά 30-50% συχνότερος στους άνδρες από ότι στις γυναίκες.
Στις χώρες του Δυτικού κόσμου η επίπτωσή του κατέχει την 3η θέση στους άνδρες (μετά από τους καρκίνους του προστάτη και του πνεύμονα) και στις γυναίκες (μετά τους καρκίνους του μαστού και του πνεύμονα), ενώ όσον αφορά τη θνητότητα από καρκίνο ο ορθοκολικός καρκίνος βρίσκεται στην 3η θέση με την 1η θέση να καταλαμβάνεται από τον καρκίνο του πνεύμονα και τη 2η θέση από τον καρκίνο του προστάτη στους άνδρες και τον καρκίνο του μαστού στις γυναίκες.
Αιτιοπαθογένεια, προδιαθεσικοί παράγοντες
Περιβαλλοντικοί, διαιτητικοί, εξωγενείς παράγοντες κινδύνου
Μία σειρά παραγόντων έχουν ενοχοποιηθεί για την αύξηση πιθανότητας ανάπτυξης καρκίνου παχέος εντέρου, αλλά έχει υποστηριχθεί και η προστατευτική δράση κάποιων ουσιών (Πίνακας 1). Οι ενοχοποιητικοί παράγοντες σε ένα βαθμό μπορεί να τροποποιηθούν από τον τρόπο ζωής και τις συνήθειες και αυτό αποτελεί το στόχο της πρωτοβάθμιας πρόληψης.
Πίνακας 1.
Παράγοντες κινδύνου και προστατευτικοί παράγοντες στον καρκίνο του παχέος εντέρου
|
Παράγοντες κινδύνου |
Προστατευτικοί παράγοντες |
|
Δίαιτα πλούσια σε κόκκινο κρέας και ζωϊκό λίπος |
Ορμονική υποκατάσταση (μετεμμηνοπαυσιακές γυναίκες) |
|
Ελαττωμένη πρόσληψη φυτικών ινών |
Μη στεροειδή αντιφλεγμονώδη |
|
Παχυσαρκία |
Ασβέστιο |
|
Ελαττωμένη φυσική δραστηριότητα |
Φυλικό οξύ |
|
Αλκοόλ |
Βιταμίνη D, A |
|
Διαβήτης |
Σελήνιο |
|
Κάπνισμα |
ω-3-λιπαρά οξέα |
|
Επαγγελματική έκθεση σε χημικά |
Μεθυλοξανθίνη, καφές |
|
Ιοί (HPV, Epstein-Bar, CMV, JC polyoma) |
Ελαιόλαδο, μεσογειακή δίαιτα |
Αναπόφευκτοι παράγοντες κινδύνου: Αποτελούν το στόχο της δευτεροβάθμιας πρόληψης με την πληθυσμιακή σάρωση (προσυμπτωματικό έλεγχο, screening) για τις μετρίου κινδύνου ομάδες και με την επιτήρηση (surveillance) του παχέος εντέρου για τις υψηλού κινδύνου ομάδες. Είναι οι παρακάτω:
Ηλικία:
- Ο πιο ισχυρός παράγοντας κινδύνου.
- Μόνο 3% σε <40 ετών.
- Η ηλικιακή ομάδα >50 ετών ενέχει μετρίου βαθμού κίνδυνο και πρέπει να υποβάλλεται σε κολονοσκόπηση ανά 10ετία.
Οικογενειακό ιστορικό:
- Ο σχετικός κίνδυνος προσβολής διπλασιάζεται αν ένας πρώτου βαθμού συγγενής έχει διαγνωσθεί με καρκίνο σε ηλικία >50 ετών.
- Είναι 6 φορές μεγαλύτερος αν η ηλικία του πρώτου βαθμού συγγενούς είναι <50 ετών ή αν 2 πρώτου βαθμού συγγενείς έχουν προσβληθεί από καρκίνο.
Αδενωματώδεις πολύποδες (αδενώματα):
- Η πλειοψηφία των καρκίνων παχέος εντέρου αναπτύσσονται σε έδαφος αδενώματος.
- Ο κίνδυνος ανάπτυξης καρκίνου σε αδένωμα είναι 3%, 8% και 24% στα 5, 10 και 20 έτη.
- Μετά την κολονοσκοπική αφαίρεση αδενώματος: κολονοσκοπική επιτήρηση σε 3 έτη και σε πιο συχνά μεσοδιαστήματα αν ο πολύποδας ήταν κακοήθης.
Ιδιοπαθείς φλεγμονώδεις νόσοι εντέρου (ΙΦΝΕ):
- Η ελκώδης κολίτιδα και, σε μικρότερο βαθμό, η νόσος Crohn προδιαθέτουν σε καρκίνο.
- Η κολονοσκοπική επιτήρηση ξεκινά 8 έτη μετά την εμφάνιση ενεργού νόσου.
Κληρονομικά γενετικά σύνδρομα:
- Οικογενής αδενωματώδης πολυποδίαση (Familial adenomatous polyposis, FAP) (1% των περιπτώσεων καρκίνου).
- Κληρονομικό μη πολυποδιασικό ορθοκολικό καρκίνωμα (Hereditary nonpolyposis colorectal cancer, HNPCC, Σύνδρομο Lynch) (5% των περιπτώσεων καρκίνου)
- Άλλα σύνδρομα πολυποδιάσεως (σύνδρομο Peutz-Jeghers) με μικρότερο βαθμό προδιάθεσης.
Πολύποδες
Ως πολύποδας ορίζεται κάθε προβολή του βλεννογόνου εντός του εντερικού αυλού (Πίνακας 2).
Κακόηθες δυναμικό έχουν οι αδενωματώδεις πολύποδες (αδενώματα) και, σε μικρότερο βαθμό οι αμαρτωματώδεις πολύποδες.
Μακροσκοπικά, διακρίνονται σε έμμισχους και άμισχους (Εικόνα 1).
Ιστολογικά τα αδενώματα διακρίνονται σε: (1) Σωληνώδη (65-80%), (2) Λαχνωτά (5-10%) και (3) Σωληνολαχνωτά (10-25%).
Ο κίνδυνος ανάπτυξης αδενοκαρκινώματος αυξάνεται με το μέγεθος και τη λαχνωτή ιστολογία του αδενώματος (Πίνακας 3, Εικόνα 3). Συγκεκριμένα για μέγεθος 0,6-1,5 εκ. είναι 2%, 1,6-2,5 εκ. 19%, 2,6-3,5 εκ. 43% και >3,5 εκ. 76%.
Το 25% των ενηλίκων >50 ετών έχουν πολύποδες και το 5-10% των πολυπόδων γίνονται κακοήθεις σε 20 έτη (~2.5/1000/έτος).
Πίνακας 2.
Τύποι πολυπόδων
|
Πολύποδες |
Μονήρεις |
Πολλαπλοί |
|
Νεοπλασματικοί
|
Αδένωμα - Σωληνώδες - Λανωτό - Σωληνολαχνωτό
|
Οικογενής αδενωματώδης πολυποδίαση |
|
Αμαρτώματα
|
Νεανικοί Σύνδρομο Peutz - Jeghers
|
Σύνδρομο Peutz - Jeghers
|
|
Φλεγμονώδεις
|
Καλοήθης λεμφοειδής πολύποδας
|
Ελκώδης κολίτιδα Νόσος Crohn
|
|
Αταξινόμητοι |
Υπερπλαστικοί |
|
|
Διάφοροι
|
Λειομύωμα Νευροίνωμα Λίπωμα Αιμαγγείωμα |
|
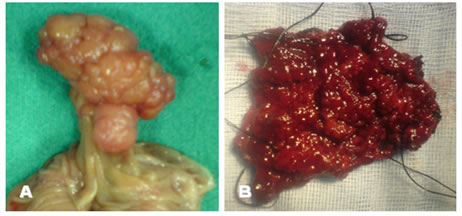
Εικόνα 1.
Α. Έμμισχος σωληνολαχνωτός αδενωματώδης πολύποδας που αφαιρέθηκε χειρουργικά.
Β. Ευμεγέθης άμισχος λαχνωτός αδενωματώδης πολύποδας ορθού που αφαιρέθηκε χειρουργικά διά του ορθού.
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
Πίνακας 3.
Πιθανότητα κακοήθους εξαλλαγής αδενωματώδους πολύποδα
|
Διάμετρος αδενώματος
|
1εκ 1% 1-2 εκ 10% > 2 εκ 40% |
|
Ιστολογικός τύπος
|
αδενωματώδεις 5% μεικτοί 20% λαχνωτά 40% |
|
Βαθμός επιθηλιακής ατυπίας |
Υψηλού βαθμού δυσπλασία > χαμηλού βαθμού δυσπλασία |
|
Μακροσκοπική εικόνα |
Άμισχοι > έμμισχοι |
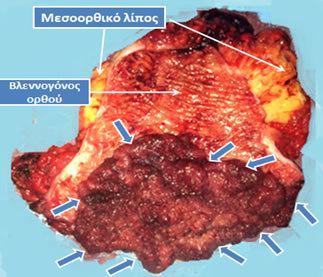
Εικόνα 2.
Επιμήκως διανοιγμένο παρασκεύασμα πολύ χαμηλής πρόσθιας εκτομής (ολικής αφαίρεσης ορθού) για την αντιμετώπιση ευμεγέθους λαχνωτού αδενώματος (μπλε βέλη), που παρουσίαζε υψηλόβαθμη δυσπλασία χωρίς κακοήθεια. Ο ασθενής εμφανίστηκε με εκκριτικού τύπου διάρροιες, αφυδάτωση και υποκαλιαιμία, που συχνά προκαλούνται από μεγάλα αδενώματα του ορθού. Λόγω του μεγέθους του η τοπική εκτομή του δεν ήταν εφικτή και απαιτήθηκε αφαίρεση του ορθού. Ακολούθησε κολο-πρωκτική αναστόμωση για την αποκατάσταση της συνέχειας του τελικού τμήματος του πεπτικού σωλήνα.
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
Ο καρκίνος του παχέος εντέρου είναι προϊόν ενός εξαλλαγμένου πολύποδα, γεγονός που συμβαίνει με μία σειρά γενετικών, ιστολογικών και μακροσκοπικών αλλαγών και φαινομένων (φυσιολογικός βλεννογόνος- αδενωματώδης πολύποδας- καρκίνος in situ- διηθητικός καρκίνος), οι οποίες έχουν περιγραφεί αναλυτικά από τον Vogelstein και είναι γνωστές ως αλληλουχία αδενώματος-καρκινώματος (Εικόνα 3).
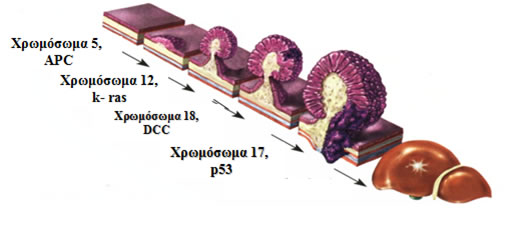
Εικόνα 3.
Αλληλουχία αδενώματος-καρκινώματος. Συσσώρευση γονιδιακών μεταλλάξεων οδηγούν στην πρόδο της ορθοκολικής καρκινογένεσης
(Τροποποιημένο από: P. H. Gordon, S. Nivatvongs “Principles and Practice of Surgery for the Colon, Rectum, and Anus”)
Οι αδενωματώδεις πολύποδες έχουν εξ’ ορισμού ατυπία των κυττάρων του πολύστιβου βεννογονικού επιθηλίου, δηλαδή δυσπλασία.
- Όταν η ατυπία περιορίζεται στις ανώτερες στιβάδες, το αδένωμα χαρακτηρίζεται ως χαμηλής δυσπλασίας και όταν η ατυπία περιλαμβάνει έως και τη βασική στιβάδα του επιθηλίου, χωρίς όμως να παρατηρείται διάσπαση της βασικής μεμβράνης, η δυσπλασία του αδενώματος είναι υψηλού βαθμού.
- Το υψηλόβαθμης δυσπλασίας αδένωμα είναι ταυτόσημα με το ενδοβεννογόνιο καρκίνωμα ή τον καρκίνο in situ.
- Η διάσπαση της βασικής μεμβράνης είναι απαραίτητη προϋπόθεση για το χαρακτηρισμό της βλάβης ως καρκίνο, αφού τα άτυπα κύτταρα αποκτούν έτσι τις κλασσικές διηθητικές ιδιότητές τους.
- Οι περισσότεροι πολύποδες ανευρίσκονται κατά την κολονοσκοπική εξέταση του παχέος εντέρου, η οποία διενεργείται σε ασθενείς με συμπτώματα από το κατώτερο πεπτικό ή σε ασυμπτωματικούς ασθενείς που υποβάλλονται σε κολονοσκόπηση για προληπτικούς λόγους (screening).
- Κατά την κολονοσκόπηση, η αφαίρεση του πολύποδα με τη βοήθεια ειδικού βρόγχου πολυποδεκτομής είναι εφικτή και, τις περισσότερες φορές, είναι και η τελική θεραπεία.
Κακοήθης ορίζεται ο αδενωματώδης πολύποδας ο οποίος περιέχει καρκινικά κύτταρα που διηθούν την υποβλεννογόνια μυϊκή στιβάδα, με την καρκινική διήθηση να περιορίζεται στον υποβλεννογόνιο χιτώνα (Τ1 σύμφωνα με το σύστημα ΤΝΜ) και συχνά ανευρίσκεται στην ιστολογική εξέταση του μετά την ενδοσκοπική αφαίρεσή του.
Η κλινική απόφαση για την αναγκαιότητα διενέργειας κολεκτομής μετά την ενδοσκοπική πολυποδεκτομή ενός κακοήθους πολύποδα καθορίζεται από τα χαρακτηριστικά του πολύποδα.
Ο κύριος παράγοντας παρουσίας λεμφαγγειακής διασποράς αποτελεί το βάθος διήθησης των καρκινικών κυττάρων εντός του πολύποδα.
Η ταξινόμηση κατά Haggitt (Εικόνα 4) βασίζεται στο επίπεδο διήθησης:
- Επίπεδο 0: Χωρίς διήθηση, βαρειά δυσπλασία
- Επίπεδο 1: Το καρκίνωμα διηθεί διά της υποβλεννογονίου μυϊκής στιβάδας, αλλά περιορίζεται στην κεφαλή του έμμισχου πολύποδα
- Επίπεδο 2: Το καρκίνωμα διηθεί έως τον αυχένα, το όριο μεταξύ της κεφαλής και του μίσχου του έμμισχου πολύποδα
- Επίπεδο 3: Το καρκίνωμα διηθεί το μίσχο του έμμισχου πολύποδα
- Επίπεδο 4: Το καρκίνωμα διηθεί τον υποβλεννογόνιο χιτώνα του εντέρου κάτω από το μίσχο του έμμισχου πολύποδα. Όλοι οι κακοήθεις άμισχοι αδενωματώδεις πολύποδες είναι επιπέδου 4 κατά Haggitt.
Ο κίνδυνος λεμφαδενικών μεταστάσεων είναι <1% για έμμισχους κακοήθεις πολύποδες με επίπεδο διήθησης κατά Haggitt 1, 2 και 3, ενώ για τα αδενώματα με επίπεδο 4 κατά Haggitt, έμμισχα ή άμισχα, ο κίνδυνος αυτός κυμαίνεται σε 12 έως 25%.
Η ενδοσκοπική πολυπεκτομή αρκεί για τα καοήθη αδενώματα με επίπεδο διήθησης κατά Haggitt 1, 2 και 3, εφόσον το κακόηθες νεόπλασμα δεν είναι κακής διαφοροποίησης και δεν ανευρίσκεται διήθηση των λεμφαγγείων ή των αγγείων του υποβλεννογόνιου χιτώνα.
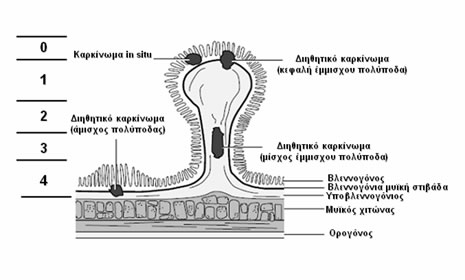
Εικόνα 4.
Ταξινόμηση κατά Haggitt
Μοριακή βιολογία- Γενετικοί μηχανισμοί- Κληρονομικά σύνδρομα
Οι περισσότερες περιπτώσεις καρκίνου του παχέος εντέρου είναι σποραδικές (65%–85%) (Εικόνα 5).
Στον οικογενή μη κληρονομικό καρκίνο (10-30%) υπάρχει άνω του μετρίου προδιάθεση για ανάπτυξη καρκίνου αλλά η γενετική βλάβη δεν είναι πλήρως καθορισμένη, όπως συμβαίνει στα καθαυτό κληρονομικά γενετικά σύνδρομα του ορθοκολικού καρκίνου (5-6%), στα οποία η εμφάνιση του καρκίνου γίνεται σε μικρότερη σχετικά ηλικία (Εικόνα 5).
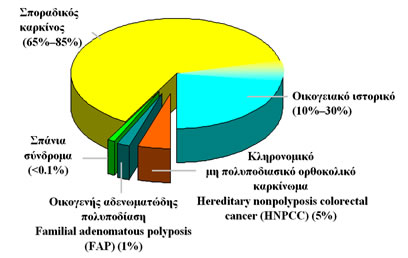
Εικόνα 5.
Σποραδικός, οικογενής και κληρονομικός καρκίνος του παχέος εντέρου
Η κακοήθης νόσος είναι γενετική και η πρόοδος από το φυσιολογικό βλεννογόνο στο αδένωμα και στη συνέχεια στο αδενοκαρκίνωμα οφείλεται στην άθροιση γενετικών ελλειμμάτων.
Σύμφωνα με τη θεωρία των «δύο χτυπημάτων» (Κnudson), δύο μεταλλάξεις («χτυπήματα») στα δύο αντίστοιχα αλλήλια είναι απαραίτητα για την καρκινογένεση.
- Η πρώτη οδηγεί στην αύξηση της συχνότητας των γενετικών μεταλλάξεων με αποτέλεσμα τη δεύτερη (απενεργοποιό) μετάλλαξη, η οποία και είναι καθοριστική για την έναρξη της καρκινογενετικής διαδικασίας.
- Στις σποραδικές περιπτώσεις οι αντίστοιχες μεταλλάξεις (δύο «χτυπήματα») συμβαίνουν σε επίπεδο σωματικών κυττάρων σε κάποια φάση της ζωής του ανθρώπου και, τυπικά, ο καρκίνος εκδηλώνεται σε προχωρημένη ηλικία.
- Στις κληρονομικές περιπτώσεις (FAP, σύνδρομο Lynch) το πρώτο «χτύπημα» υπάρχει ήδη από το επίπεδο του βλαστικού κυττάρου (germ-line), διότι κληρονομείται. Αυτό οδηγεί σε αυξημένη γενετική αστάθεια και την έλευση του δεύτερου «χτυπήματος» σε νεαρότερη ηλικία, με αποτέλεσμα την πολύ πρωϊμότερη εκδήλωση του καρκίνου στις κληρονομικές περιπτώσεις.
Δύο βασικά γενετικά μονοπάτια διέπουν την καρκινογένεση στο παχύ έντερο:
Στο 70% των σποραδικών καρκίνων και στην οικογενή αδενωματώδη πολυποδίαση (FAP):
- Το μονοπάτι της χρωμοσωμικής αστάθειας ή της απώλειας ετεροζυγωτίας, στο οποίο υπεύθυνο είναι το ογκοκατασταλτικό γονίδιο APC (Αdenomatous Polyposis Coli), το οποίο εντοπίζεται στο χρωμόσωμα 5 (5q21).
- Η αρχική μετάλλαξη κληρονομείται και η απώλεια του φυσιολογικού αλληλίου (απώλεια ετεροζυγωτίας) συμβαίνει επίκτητα στην FAP, ενώ και τα δύο φαινόμενα είναι επίκτητα σε επίπεδο σωματικού κυττάρου στο σποραδικό καρκίνο.
- Στο μονοπάτι αυτό, στην αλληλουχία αδενώματος-καρκινώματος βασικό ρόλο παίζουν τα γονίδια k-ras και p
Στο 30% των σποραδικών καρκίνων και στο κληρονομικό μη πολυποδιασικό ορθοκολικό καρκίνωμα (Hereditary nonpolyposis colorectal cancer, HNPCC, Σύνδρομο Lynch):
- Το μονοπάτι της μικροδορυφορικής αστάθειας, στο οποίο τα εμπλεκόμενα γονίδια είναι τα γονίδια επιδιόρθωσης λαθών στο συνταίριασμα ζευγών βάσεων του DNA (DNA Mismatch Repair genes, MMR).
- Tα πιο κοινά γονίδια είναι το MLH1 στο χρωμόσωμα 3 και το MSH2 στο χρωμόσωμα 2.
Στην οικογενή αδενωματώδη πολυποδίαση (FAP) το παχύ έντερο κατακλύζεται από πολλαπλούς (εκατοντάδες έως και χιλιάδες) πολύποδες και η πρόοδος σε καρκίνο είναι αναπόφευκτη.
- Οποιοσδήποτε πολύποδας μπορεί να υποστεί εξαλλαγή σε καρκίνο.
- Το 50% των παιδιών των προσβεβλημένων ασθενών θα αναπτύξουν FAP.
- Γενετικός έλεγχος για την ύπαρξη μετάλλαξης στο γονίδιο APC πρέπει να γίνεται σε πρώϊμη ηλικία και, εφόσον αυτή είναι υπαρκτή, η προφυλακτική κολεκτομή πρέπει να διενεργείται στην εφηβική ηλικία για τη μείωση του κινδύνου για καρκίνο.
- Η θεραπεία εκλογής της FAP είναι η ολική ορθο-κολεκτομή και η αναστόμωση του ειλεού με τον πρωκτό μέσω της δημιουργίας μιας ειλεϊκής ληκύθου, η οποία υποκαθιστά λειτουργικά σε κάποιο βαθμό το αφαιρεθέν ορθό (Εικόνα 6).
- H διατήρηση του ορθού με τη διενέργεια υφολικής κολεκτομής και ειλεο-ορθικής αναστόμωσης για καλύτερα λειτουργικά αποτελέσματα είναι εφικτή όταν το ορθό έχει <10 πολύποδες, στην περίπτωση της εξασθενημένης FAP (<100 πολύποδες σε όλο το παχύ έντερο) και όταν η ενδοσκοπική επιτήρηση του ορθού μετά την υφολική κολεκτομή είναι δυνατή και αποδεκτή από τον ασθενή.
- Λόγω της συχνής ανάπτυξης εξωκολονικών νεοπλασιών (Πίνακας 4), συχνός περιοδικός έλεγχος πρέπει να διενεργείται σε άλλα συστήματα του οργανισμού.
Πίνακας 4.
Χαρακτηριστικά κληρομικών συνδρόμων πολυποδιάσεως
|
Σύνδρομο |
Χαρακτηριστικά |
|
Οικογενής αδενωματώδης πολυποδίαση (Familial adenomatous polyposis, FAP) |
1/10.000 γεννήσεις Αυτοσωματικός επικρατούντας τύπος κληρονομικότητας 20% χωρίς οικογενειακό ιστορικό Ποικίλη ηλικία έναρξης (10- 40 ετών) 100% κίνδυνος ανάπτυξης καρκίνου Ηλικία διάγνωσης καρκίνου: 39 Ηλικία θανάτου από καρκίνο: 42 Μέσος χρόνος εμφάνισης πολυπόδων: 16 ετών >100- >1000 πολύποδες |
|
Εξασθενημένη (Attenuated) FAP |
FAP με <100 πολύποδες |
|
Σύνδρομο Gardner |
FAP με εξωκολονικές εκδηλώσεις Δεσμοειδείς όγκοι, εξοστώσεις, οστεώματα, επιδερμοειδείς κύστεις Καλοήθεις και κακοήθεις όγκοι άλλων οργάνων: γαστρικοί, 12/λικοί, περιλυκηθικοί πολύποδες, καρκίνος παγκρέατος, θυρεοειδούς, στομάχου, ΚΝΣ, ήπατος 100% κίνδυνος ανάπτυξης καρκίνου |
|
Σύνδρομο Turcot |
Πολύποδες παχέος εντέρου με ενδοκράνιους όγκους Αυτοσωματικός υπολειπόμενος τύπος κληρονομικότητας |
|
Σύνδρομο Cronkhite-Canada |
Πολύποδες παχέος εντέρου με αλωπεκία, ονυχοδυστροφία, υπερμελάνωση Μικρή πιθανότητα εξαλλαγής σε καρκίνο Χωρίς πρότυπο γενετικής μεταβίβασης |
|
Σύνδρομο Peutz-Jeghers |
Αμαρτωματώδεις πολύποδες σε λεπτό και παχύ έντερο Εναπόθεση μελανίνης στο βλεννογονοδερματικό όριο χειλέων, στη στοματική κοιλότητα και στα δάκτυλα Αυτοσωματικός επικρατούντας τύπος κληρονομικότητας 40 % κίνδυνος ανάπτυξης καρκίνου Υπεύθυνο γονίδιο: STK11 |
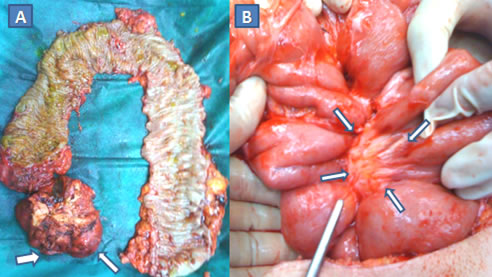
Εικόνα 6.
A. Χειρουργικό παρασκεύασμα ολικής ορθο-κολεκτομής σε ασθενή με σύνδρομο Gardner και κληρονομικό ιστορικό οικογενούς πολυποδιάσεως. Ανάπτυξη πολλαπλών πολυπόδων στο βλεννογόνο του παχέος εντέρου και δεσμοειδής όγκος στο μεσεντέριο του τελικού ειλεού (βέλη).
Β. Στην ίδια ασθενή δεσμοειδής όγκος στο μεσεντέριο του λεπτού εντέρου (βέλη). Οι δεσμοειδείς όγκοι αναπτύσσονται στο κοιλιακό τοίχωμα και στο μεσεντέριο, και, αν και χωρίς μεταστατικό δυναμικό, έχουν «κακοήθη συμπεριφορά», λόγω της τάσης τους να αυξάνονται σε μέγεθος προκαλώντας απόφραξη, ισχαιμία ή διάτρηση στο λεπτό έντερο. Είναι δύσκολα αντιμετωπίσημοι και η πολλές φορές αδύνατη χειρουργική αφαίρεσή τους πυροδοτεί τη γένεση επιθετικότερων δεσμοειδών όγκων. (Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
Στο κληρονομικό μη πολυποδιασικό ορθοκολικό καρκίνωμα (ΗNPCC, Σύνδρομο Lynch) τα αδενώματα είναι λίγα ή ανύπαρκτα.
- Η ακολουθία αδενώματος-καρκινώματος είναι ταχεία.
- Ο κίνδυνος ανάπτυξης καρκίνου είναι 80% και η μέση ηλικία εμφάνισης είναι 44 ετών.
- Τα κακοήθη νεοπλάσματα του δεξιού κόλου είναι πιο συχνά, ενώ συχνή είναι και η εμφάνιση σύγχρονων και μετάχρονων καρκίνων του παχέος εντέρου.
- Η κλινική εκδήλωση του HNPCC μπορεί να είναι δυσδιάκριτη από τις σποραδικές περιπτώσεις του ορθοκολικού καρκίνου.
- Η διάγνωση απαιτεί υψηλό βαθμό κλινικής υποψίας και διερεύνηση του οικογενειακού ιστορικού.
- Για τη διάγνωση του HNPCC εφαρμόζονται τα κριτήρια του Άμστερνταμ (Πίνακας 5).
- Στην περίπτωση καρκίνου που πληρεί τα κριτήρια αυτά, γενετικός έλεγχος για μικροδορυφορική αστάθεια διενεργείται στα μέλη της οικογένειας του προσβεβλημένου ατόμου και αυτά πρέπει να υποβάλλονται σε κολονοσκόπηση επιτήρησης από νεότερη ηλικία.
- Η συμπαρουσία εξωκολονικών καρκίνων συνιστά το σύνδρομο Lynch II (Πίνακας 6).
Πίνακας 5.
Κριτήρια του Άμστερνταμ για τη διάγνωση του κληρονομικού μη πολυποδισιακού καρκίνου του παχέος εντέρου (HNPCC, Σύνδρομο Lynch)

Πίνακας 6.
Εξωκολονικοί καρκίνοι και συχνότητά τους στο σύνδρομο Lynch II
|
Καρκίνος |
Συχνότητα |
|
Ενδομητρίου |
40% |
|
Στομάχου |
18% |
|
Ωοθήκης |
12% |
|
Χοληφόρων |
17% |
|
Ουροδόχου κύστεως |
12% |
|
ΚΝΣ |
4% |
|
Λεπτού Εντέρου |
2% |
Παθολογική ανατομία- Σταδιοποίηση καρκίνου παχέος εντέρου
Οι περισσότερες περιπτώσεις του ορθοκολικού καρκίνου εντοπίζονται στο σιγμοειδές και στο ορθό.
Η πλειονότητα είναι αδενοκαρκινώματα, τα οποία αναπτύσσονται σε έδαφος προϋπάρχοντος αδενώματος.
Μακροσκοπικά διακρίνονται σε: ελκωτικά (πιο συχνά), πολυποειδή (10%), διάχυτα διηθητικά (linitis plastica, συχνά σε έδαφος ελκώδους κολίτιδας) και δακτυλιοειδή (στενωτικά).
Ιστολογικά είναι καλά διαφοροποιημένα (διατήρηση αρχιτεκτονικής αδενίων), μέτρια διαφοροποιημένα (διαταραχή αρχιτεκτονικής αδενίων) και πτωχά διαφοροποιημένα (απουσία αδενίων και άναρχη αρχιτεκτονική). Ο βαθμός διαφοροποίησης (Grade) σύμφωνα με την ταξινόμηση του Broders βασίζεται στο ποσοστό των καλά διαφοροποιημένων κυττάρων, ως ακολούθως: Grade I: 75-100%, Grade II: 50-75%, Grade III: 25-50%, Grade IV: 0-25%.
Ο καρκίνος του παχέος εντέρου διασπείρεται διά της λεμφογενούς ή της αιματογενούς οδού ή κατά μήκος της περιτοναϊκής κοιλότητας ή και κατά συνέχεια ιστού, διηθώντας παρακείμενα όργανα.
Τα όργανα που προσβάλλονται συχνότερα από αιματογενείς μεταστάσεις είναι (κατά σειρά συχνότητας): ήπαρ (35-50%), πνεύμονες, οστά και εγκέφαλος.
Ο παθολογοανατόμος είναι κατεξοχήν υπεύθυνος για την απόφαση του σταδίου της νόσου επί τη βάση των χειρουργικών παρασκευασμάτων.
Τα σταδιοποιητικά συστήματα που έχουν χρησιμοποιηθεί για τον ορθοκολικό καρκίνο βασίζονται σε παρόμοιους προγνωστικούς παράγοντες: το βάθος διήθησης του πρωτοπαθούς όγκου, το βαθμό λεμφαδενικής προσβολής και την παρουσία απομακρυσμένων μεταστάσεων. Αυτό αρχικά περιγράφηκε από το σταδιοποιητικό σύστημα κατά Dukes και ακολούθως τροποποιήθηκε από τους Astler-Coller.
To τρέχον σταδιοποιητικό σύστημα βασίζεται στο στάδιο ΤΝΜ (Τumor- Βάθος διήθησης όγκου, Νodes- Λεμφαδενικές μεταστάσεις, Metastasis- Απομακρυσμένες μεταστάσεις), σύμφωνα με την Αμερικανική Ένωση Καρκίνου (American Joint Committee on Cancer Staging).
To σύστημα σταδιοποίησης ΤΝΜ και η αντιστοιχία με τα παλαιότερα συστήματα, συμπεριλαμβανομένης της πρόγνωσης των ασθενών (5ετής επιβίωση) αναφαίνονται στους Πίνακες 7 και 8 και στην Εικόνα 7.
Πίνακας 7.
Σύστημα σταδιοποίησης ΤΝΜ
Πρωτοπαθής όγκος (Τ)
|
ΤΧ |
Ο πρωτοπαθής όγκος δεν μπορεί να καθορισθεί |
|
Τ0 |
Καμία ένδειξη πρωτοπαθούς όγκου |
|
Τis |
Kαρκίνωμα in situ: ενδοεπιθηλιακό ή με διήθηση της βασικής μεμβράνης |
|
T1 |
O όγκος διηθεί την υποβλεννογόνιο στιβάδα |
|
Τ2 |
O όγκος διηθεί τον μυϊκό χιτώνα |
|
Τ3 |
O όγκος διηθεί δια μέσου του μυϊκού χιτώνα τον υποορογόνιο ή μη περιτοναϊκούς περικολικούς ή περιορθικούς ιστούς |
|
Τ4 |
O όγκος διαπερνά το σπλαχνικό περιτόναιο ή διηθεί άμεσα άλλα όργανα ή δομές |
Περιοχικοί λεμφαδένες ( Ν)
|
ΝΧ |
Οι περιοχικοί λεμφαδένες δεν μπορεί να εκτιμηθούν |
|
Ν0 |
Χωρίς μεταστάσεις σε περιοχικούς λεμφαδένες |
|
Ν1 |
Μεταστάσεις σε 1 ή 3 περιοχικούς λεμφαδένες |
|
Ν2 |
Μεταστάσεις σε 4 ή περισσότερους λεμφαδένες |
Απομακρυσμένες μεταστάσεις (Μ)
|
ΜΧ |
Δεν μπορούν να καθορισθούν απομακρυσμένες μεταστάσεις |
|
Μ0 |
Χωρίς απομακρυσμένες μεταστάσεις |
|
Μ1 |
Απομακρυσμένες μεταστάσεις |
Πίνακας 8.
Συστήματα σταδιοποίησης
|
Στάδιο |
Τ |
Ν |
Μ |
Dukes |
Τροπο-ποίηση κατά Astler-Coller |
5ετής επιβίωση (%) Κόλον Ορθό |
|
|
0 |
Τis |
Ν0 |
Μ0 |
- |
- |
|
|
|
Ι |
T1 |
Ν0 |
Μ0 |
Α |
A |
99 |
90 |
|
|
T2 |
Ν0 |
Μ0 |
Α |
B1 |
||
|
ΙΙΑ |
T3 |
Ν0 |
Μ0 |
Β |
B2 |
80 |
60 |
|
ΙΙΒ |
T4 |
Ν0 |
Μ0 |
Β |
B3 |
||
|
ΙΙΙΑ |
T1-T2 |
Ν1 |
Μ0 |
C |
C1 |
50 |
40 |
|
ΙΙΙΒ |
T3-T4 |
Ν1 |
Μ0 |
C |
C2/C3 |
||
|
ΙΙΙC |
Όποιο Τ |
Ν2 |
Μ0 |
C |
C1/C2/C3 |
||
|
IV |
Όποιο Τ |
Όποιο Τ |
Μ1 |
- |
D |
10 |
10 |
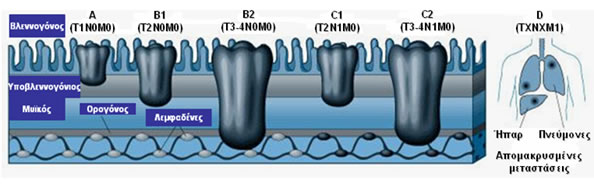
Εικόνα 7.
Σταδιοποίηση καρκίνου παχέος εντέρου
Κλινική εικόνα καρκίνου παχέος εντέρου
Η βραδεία ανάπτυξη του καρκίνου οδηγεί σε καθυστερημένη εμφάνιση των συμπτωμάτων.
Η κλινική εικόνα εξαρτάται από το στάδιο της νόσου, την εντόπιση του όγκου και την εμφάνιση επιπλοκών.
Συνήθεις και ασυνήθεις κλινικές εκδηλώσεις του καρκίνου παχέος εντέρου αναφέρονται στον Πίνακα 9.
Πίνακας 9.
Κλινική εικόνα καρκίνου παχέος εντέρου
|
Συνήθη ευρήματα |
Ασυνήθη ευρήματα |
|
Κοιλιακό άλγος (40%) |
Συμπτωματολογία οξείας σκωληκοειδίτιδας |
|
Αλλαγή συνηθειών εντέρου (33%) |
Συμπτωματολογία κολο-κυστικού συριγγίου |
|
Απώλεια ορατού αίματος από το ορθό (30%) - ανεύρεση νεοπλάσματος: 20% (50% αυτών: καρκίνος) |
Οίδημα κάτω άκρων |
|
Μικροσκοπική απώλεια αίματος (35%) |
Θρομβοφλεβίτιδα |
|
Δερματομυοσίτιδα, πεμφιγοειδές, acanthosis nigricans |
|
|
Υποκαλιαιμία από λαχνωτό όγκο |
Λόγω των διαφορετικών χαρακτηριστικών του δεξιού κόλου (μεγάλη διάμετρος αυλού, λεπτό τοίχωμα, υδαρές εντερικό περιεχόμενο) και του αριστερού κόλου (μικρότερη διάμετρος αυλού, σχηματισμένα κόπρανα), καθώς και των ιδιαιτεροτήτων του ορθού (ενδοπυελική θέση του, σχέση του με το σφιγκτηριακό μηχανισμό), τα συμπτώματα και τα σημεία διαφέρουν αναλόγως της εντόπισης του όγκου σε καθεμία από τις παραπάνω θέσεις (Πίνακας 10).
Πίνακας 10.
Κλινική εικόνα ανάλογα με τη θέση του καρκίνου παχέος εντέρου
|
Καρκίνος δεξιού κόλου |
Καρκίνος αριστερού κόλου |
Καρκίνος ορθού |
|
Βραδεία εγκατάσταση σιδηροπενικής αναιμίας: Μικροσκοπική αιμορραγία, το πιο συχνό εύρημα |
Αλλαγές στις συνήθειες εντέρου και διαταραχές κενώσεων, κυρίως δυσκοιλιότητα ή εναλλαγές δυσκοιλιότητας με (ψευδο)διάρροιες ή αλλαγή σχήματος κοπράνων |
Αιμορραγία από το ορθό: το αίμα είναι σκούρου ερυθρού χρώματος και αναμεμειγμένο με τα κόπρανα ή ζωηρού ερυθρού χρώματος και χωριστά από τα κόπρανα |
|
Συστηματικά συμπτώματα: αδυναμία, καταβολή, πυρετός αγνώστου αιτιολογίας, από το φορτίο του όγκου ή εντοπισμένη μικροδιάτρηση ή την αναιμία |
Αποφρακτικά φαινόμενα: ελάττωση συχνότητας κενώσεων, κοιλιακή διάταση, μετεωρισμός, κωλικοειδή κοιλιακά άλγη, ελάττωση διαμέτρου κοπράνων, επιθυμία για κένωση και μη ικανοποιητική αφόδευση |
Αλλαγές στις συνήθειες εντέρου, όπως συχνές κενώσεις ή βλεννώδης διάρροια. Πλούσια σε κάλιο υπερπαραγωγή βλέννης από μεγάλο λαχνωτό αδένωμα ορθού (συχνά με κακοήθεις εστίες) οδηγεί σε υποκαλιαιμία |
|
Αμβλύ επίμονο άλγος δεξιάς κοιλίας |
Απώλεια αίματος ή/και βλέννης από το ορθό: η αιμορραγία είναι διαλείπουσα και περιέχει μικρές ποσότητες σκούρου ερυθρού αίματος αναμεμειγμένου με τα κόπρανα |
Τεινεσμός, δηλαδή επώδυνο αίσθημα για αφόδευση, συχνά με αίσθημα ατελούς κένωσης μετά την αφόδευση, συνεχής και επιτακτική επιθυμία για αφόδευση και αίσθημα πληρότητας: ενδεικτικά μεγάλου όγκου |
|
Ψηλαφητή μάζα δεξιού λαγονίου |
Ψηλαφητή μάζα αριστερού λαγονίου |
Άλγος: πρωκτικό και περινεϊκό, αρχικά κατά την κένωση και έπειτα συνεχές σε όγκους του κατώτερου ορθού με διήθηση των σφιγκτήρων |
|
Απόφραξη τελικού ειλεού (αργοπορημένη εκδήλωση) |
Αδυναμία, απώλεια βάρους |
Άλγος: ιερό, πυελικό με ακτινοβολία στα κάτω άκρα από διήθηση του ιερού και των πυελικών πλεγμάτων |
|
Οξεία σκωληκοειδίτιδα: απόφραξη του στομίου σκωληκοειδούς από όγκο τυφλού |
Κολο-κυστικό συρίγγιο: διήθηση ουροδόχου κύστης από καρκίνο ορθοσιγμοειδούς, πνευματουρία, κοπρανουρία |
Ψηλαφητή μάζα ορθού στη δακτυλική εξέταση με ή χωρίς αίμα στο γάντι του εξετάζοντος δακτύλου |
|
Τριάδα: αναιμία,, αδυναμία, μάζα δεξιού λαγονίου |
||
|
Ηπατομεγαλία και ίκτερος σε ηπατικές μεταστάσεις |
||
|
Εκδηλώσεις από όργανα με μεταστάσεις |
||
Οι επιπλοκές του καρκίνου του παχέος εντέρου συνοψίζονται στον Πίνακα 11.
Πίνακας 11.
Επιπλοκές του καρκίνου του παχέος εντέρου
|
Απόφραξη (15%) |
Συχνότερη αιτία απόφραξης παχέος εντέρου Πιο συχνά στο αριστερό κόλον Το μέγεθος του ειλεού του λεπτού εντέρου εξαρτάται από την επάρκεια της ειλεοτυφλικής βαλβίδας Συνοδός ισχαιμική κολίτιδα εγγύς της απόφραξης |
|
Διάτρηση (6-12%) |
Πιο συχνά στη θέση του καρκίνου Συνυπάρχουσα διάτρηση εγγύς αποφρακτικού καρκίνου: 12-19% των αποφρακτικών καρκίνων |
|
Αιμορραγία |
Μαζική αιμορραγία σπάνια |
|
Ασυνήθιστες λοιμώξεις σχετιζόμενες με καρκίνο παχέος εντέρου |
Ενδοκαρδίτιδα (Streptococcus bovis), Mηνιγγίτιδα (S. bovis), Αεριογόνος γάγγραινα (E. Coli), Ηπατικό απόστημα (Clostridium septicum), Οπισθοπεριτοναϊκό απόστημα |
Διαγνωστική προσπέλαση του καρκίνου του παχέος εντέρου
Κλινική αξιολόγηση
Το προσεκτικό και πλήρες ιστορικό και η αντικειμενική εξέταση του ασθενούς παραμένουν τα πιο σημαντικά στοιχεία για τη διάγνωση, την εκτίμηση της έκτασης της νόσου και την αξιολόγηση της καταλληλότητας του ασθενούς για την υποβολή του στα διάφορα μέσα και είδη της θεραπευτικής προσέγγισης (π.χ. εκτίμηση της θρεπτικής κατάστασης του ασθενούς).
Η δακτυλική εξέταση του ορθού (Εικόνα 8), αναπόσπαστο τμήμα της κλινικής εξέτασης της κοιλιάς, είναι σημαντική για την εκτίμηση της θέσης ενός όγκου του ορθού, τη σχέση του με το σφιγκτηριακό μηχανισμό και του βαθμού κινητικότητας ή καθήλωσής του στους περιορθικούς ιστούς (π.χ. το ιερό).
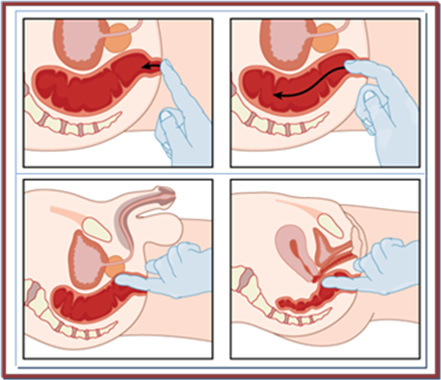
Εικόνα 8.
Δακτυλική εξέταση του ορθού
Με την ανεύρεση νεοπλάσματος ορθού, ακολουθεί η ορθοσιγμοειδοσκόπηση με άκαμπτο ή εύκαμπτο σιγμοειδοσκόπιο για την περαιτέρω εκτίμησή της, ιδιαίτερα για τον καθορισμό της ακριβούς απόστασής της από τον πρωκτό, γεγονός που επηρεάζει σημαντικά το είδος της επακόλουθης χειρουργικής επέμβασης.
Διαγνωστικές εξετάσεις, παρακλινικός έλεγχος
Η κολονοσκόπηση επιτρέπει την εκτίμηση της έκτασης του όγκου και τη διενέργεια βιοψίας για την επιβεβαίωση της διάγνωσης (Εικόνες 9, 10).
Ο πλήρης κολονοσκοπικός έλεγχος είναι απαραίτητος, διότι επισυμβαίνουν σύγχρονοι όγκοι.
Εικόνα 9.
Κολονοσκόπηση
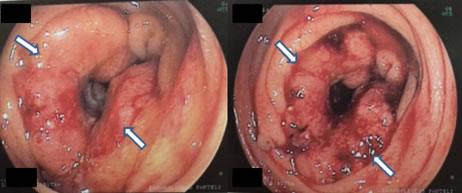
Εικόνα 10.
Αδενοκαρκίνωμα σιγμοειδούς σε κολονοσκόπηση
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
Σύγχρονοι καρκίνοι στο παχύ έντερο υπάρχουν σε ποσοστό 2-8%, ενώ πολύποδες συνυπάρχουν σε άλλα σημεία του παχέος εντέρου εκτός του κακοήθους νεοπλάσματος σε 20-30%.
Εργαστηριακές εξετάσεις:
- Αιματολογικές και βιοχημικές εξετάσεις περιλαμβάνουν τη γενική αίματος, νεφρολογικές και ηπατικές λειτουργικές δοκιμασίες.
- Το καρκινοεμβρυϊκό αντιγόνο (CEA) και το υδατανθρακικό αντιγόνο CA 19-9 είναι συνήθως, αλλά όχι πάντα, αυξημένα στον καρκίνο του παχέος εντέρου. Δεν είναι όμως ειδικοί καρκινικοί δείκτες.
- Το CEA είναι ο μόνος χρήσιμος καρκινικός δείκτης που πρέπει να μετράται πριν από τη χειρουργική θεραπεία, διότι εάν βρεθεί αυξημένος, χρησιμοποιείται μετεγχειρητικά και μετράται ανά 3-4 μήνες για την πρώϊμη ανακάλυψη υποτροπής της νόσου και για την αξιολόγηση της ανταπόκρισης στη θεραπεία.
Απεικονιστικές εξετάσεις:
- Η έκταση του όγκου εντός της κοιλίας/πυέλου και η παρουσία απομακρυσμένων μεταστάσεων (ήπαρ) εκτιμάται με την αξονική τομογραφία.
- Η αξονική τομογραφία θώρακος πρέπει να περιλαμβάνεται στη σταδιοποίηση του καρκίνου του ορθού, λόγω της συχνότερης, σε σχέση με το κόλον, μεταστατικής προσβολής του πνεύμονα. Για τον καρκίνο του κόλου αρκεί η απλή ακτινογραφία θώρακος.
- Η μαγνητική τομογραφία άνω κοιλιας χησιμοποιείται για την επιβεβαίωση των ηπατικών μεταστάσεων, όταν υπάρχουν αμφιβολίες από την αξονική τομογραφία στην ανίχνευση «ύποπτων» εστιών στο ήπαρ.
- Η μαγνητική τομογραφία πυέλου αποτελεί βασικό μέσο προεγχειρητικής σταδιοποίησης του καρκίνου του ορθού (εκτίμηση του βάθους διήθησης του όγκου εντός του μεσοορθού, απόσταση του όγκου από την ιδίως μεσοορθική περιτονία, παρουσία λεμφαδενικών μεταστάσεων ή καρκινικών εναποθέσεων εντός του μεσοορθού) (Εικόνα 11).
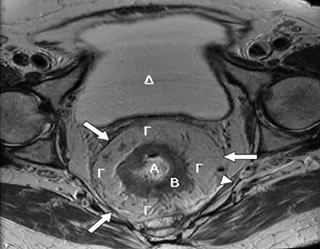
Εικόνα 11.
Μαγνητική τομογραφία πυέλου:
Α. Αυλός ορθού. Β. Μυϊκός χιτώνας ορθού. Γ. Μεσοορθικό λίπος (το μεσοορθό περιβάλλει το ορθό κυκλοτερώς, οπισθίως, πλαγίως και προσθίως). Δ. Ουροδόχος κύστη. (Μεγάλο βέλος: Μεσοορθική περιτονία. Μικρό βέλος: Μεσοορθικός λεμφαδένας)
- Το διορθικό υπερηχογράφημα έχει ένδειξη στη σταδιοποίηση του επιπέδου Τ του καρκίνου του ορθού (εκτίμηση βάθους διήθησης του όγκου διά των εντερικών στιβάδων) και του Ν (ανίχνευση αυξημένου μεγέθους μεσοορθικών λεμφαδένων με υπερηχολογικά χαρακτηριστικά ενδεικτικά μετάστασης).
- Ο διπλής σκιαγραφικής αντίθεσης βαριούχος υποκλυσμός χρησιμοποιείτο παλαιότερα ως διαγνωστικό μέσο στις περιπτώσεις που ο πλήρης κολονοσκοπικός έλεγχος δεν ήταν εφικτός. Σε αυτές τις περιπτώσεις, σήμερα, και, υπό προϋποθέσεις, αντί της κολονοσκόπησης προσυμπτωματικού ελέγχου, χρησιμοποιείται συχνά η αξονική κολονογραφία (εικονική κολονοσκόπηση).
- Το σπινθηρογράφημα εκπομπής ποζιτρονίων (PET scan) είναι χρήσιμο σε ειδικές καταστάσεις, όπως σε περιπτώσεις τοπικής υποτροπής καρκίνου του ορθού, οπότε η εξέταση αυτή διαφοροδιαγνώσκει την υποτροπή από την ίνωση και τις μετεγχειρητικές αλλοιώσεις.
Θεραπεία του καρκίνου του παχέος εντέρου
Η χειρουργική αποτελεί τη βασική θεραπευτική αντιμετώπιση στον ορθοκολικό καρκίνο.
Η θεραπευτική χειρουργική αντιμετώπιση των διηθητικών καρκινωμάτων απαιτεί τη ριζική εξαίρεση του όγκου με επαρκές χειρουργικό όριο και λεμφαδενεκτομή των παροχετευόμενων λεμφαδένων.
Η επέμβαση που διενεργείται εξαρτάται από τη εντόπιση του πρωτοπαθούς όγκου εντός του παχέος εντέρου.
Σύμφωνα με τις συστάσεις της Αμερικανικής Εταιρείας Χειρουργών Παχέος Εντέρου (Αmerican Society of Colon & Rectal Surgeons (ΑSCRS) Standards Practice Task Force, Practice Parameters for Colon Cancer, 2004) και αυτές του National Comprehensive Cancer Network (NCCN) του 2009, οι κατευθηντήριες οδηγίες για τη χειρουργική αντιμετώπιση του ορθοκολικού καρκίνου έχουν ως εξής:
- Το μήκος εκτομής του παχέος εντέρου πρέπει να αντιστοιχεί στη λεμφαγγειακή αποχέτευση του φέροντος τον όγκο τμήματος του παχέος εντέρου.
- Το καθοριστικό κριτήριο της ογκολογικά επαρκούς εκτομής του ιδανικού μήκους τμήματος του εντέρου είναι η αφαίρεση του τροφοδοτούντος αγγειακού μίσχου στην έκφυσή του και του αντίστοιχου λεμφαδενικού ιστού.
- Τουλάχιστον 5 εκατοστά φυσιολογικού εντέρου και από τις δύο πλευρές της πρωτοπαθούς κακοήθους εστίας είναι το ελάχιστο μήκος που απαιτείται προκειμένου την αφαίρεση των επικολικών και παρακολικών (κατά μήκος της επιχειλίου αρτηρίας) λεμφαδένων καθώς και την ελαχιστοποίηση της αναστομωτικής διαφυγής.
- Όταν ο πρωτοπαθής όγκος είναι σε ίση απόσταση ανάμεσα σε δύο τροφοδοτούντα αγγεία, τότε και τα δύο αγγεία πρέπει να απολινώνονταοι κοντά στην έκφυσή τους.
- Οι όγκοι που εντοπίζονται σε ζώνες μετάβασης πρέπει να εκτέμνονται μαζί με τις γειτονικές λεμφαδενικές περιοχές προκειμένου να συμπεριληφθούν και οι δύο πιθανές κατευθύνσεις λεμφαδενικής διασποράς.
- Η αφαίρεση των σύστοιχων λεμφαδενικών ομάδων έχει ιδιαίτερη προγνωστική και θεραπευτική αξία.
- Η σωστή λεμφαδενεκτομή πρέπει να εκτείνεται στην έκφυση του πρωτογενώς τροφοδοτούντος αγγειακού κλάδου.
- Σε όλες τις δυνητικά θεραπευτικές κολεκτομές η αφαίρεση των λεμφαδένων πρέπει να γίνεται en block με το εκταμέν τμήμα του εντέρου.
- Τουλάχιστον 12 λεμφαδένες πρέπει να έχουν αφαιρεθεί για να αποκλειστεί λεμφαδενική μετάσταση με ικανή ακρίβεια.
- Καρκίνοι παχέος εντέρου που διηθούν κατά συνέχεια ιστού παρακείμενα όργανα πρέπει να αφαιρούνται en block με τις παρακείμενες ανατομικές δομές, με στόχο τα ιστολογικά αρνητικά για κακοήθεια όρια.
Επιλογή χειρουργικής επέμβασης
Καρκίνωμα τυφλού ή ανιόντος κόλου:
- Διενεργείται δεξιά κολεκτομή.
- Απολινώνονται η ειλεοκολική, η δεξιά κολική αρτηρία και ο δεξιός κλάδος της μέσης κολικής αρτηρίας και, μετά την αφαίρεση του δεξιού κόλου, αποκαθίσταται η εντερική συνέχεια με ειλεο-εγκαρσία αναστόμωση (Εικόνα 12).
Καρκίνωμα εγκαρσίου κόλου:
- Για όγκους της ηπατικής καμπής διενεργείται δεξιά κολεκτομή.
- Για όγκους του εγκαρσίου διενεργείται δεξιά εκτεταμένη κολεκτομή, κατά την οποία, εκτός των αγγείων του δεξιού κόλου, απολινώνεται η μέση κολική αρτηρία και, μετά την αφαίρεση του δεξιού και του εγκαρσίου κόλου, εκτελείται ειλεο-κολική αναστόμωση με το κατιόν κόλον (Εικόνα 13).
- Ο καρκίνος της σπληνικής καμπής μπορεί να εμφανίσει λεμφαδενική διασπορά στους λεμφαδένες κατά μήκος της μέσης κολικής ή της αριστερής κολικής αρτηρίας. Έτσι, μία πιο ριζική κολεκτομή με συναφαίρεση του κατιόντος κόλου διενεργείται (υφολική κολεκτομή), ενώ η συνέχεια αποκαθίσταται με την εκτέλεση ειλεο-σιγμοειδικής αναστόμωσης.
Καρκίνωμα κατιόντος κόλου:
- Διενεργείται αριστερή κολεκτομή, με την απολίνωση της κάτω μεσεντερίου ή των κλάδων της (αριστερή κολική και σιγμοειδικές αρτηρίες) και αναστομώνεται η μεσότητα του εγκαρσίου με το ανώτερο ορθό (Εικόνα 12).
Καρκίνωμα σιγμοειδούς:
- Διενεργείται σιγμοειδεκτομή με την απολίνωση της κάτω μεσεντερίου μετά την έκφυση της αριστερής κολικής (προκειμένου η τελευταία να διατηρηθεί) και αναστομώνεται το κατιόν κόλον με το ανώτερο ορθό.
- Σε καρκίνωμα του αριστερού κόλου με απόφραξη ή διάτρηση διενεργείται ογκολογική εκτομή του πάσχοντος τμήματος και τελική κολοστομία χωρίς αναστόμωση (επέμβαση κατά Hartmann) ή, ειδικά εάν η απόφραξη έχει οδηγήσει σε εκσεσημασμένη διάταση με ισχαιμία ή και διάτρηση του τυφλού, διενεργείται υφολική κολεκτομή (Εικόνα 14).
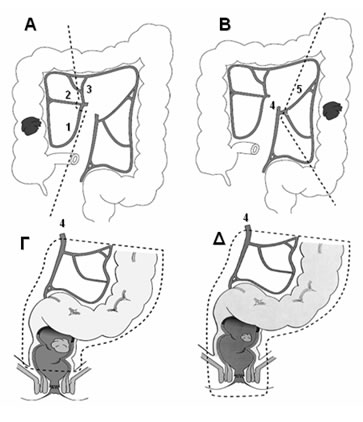
Εικόνα 12.
Τύποι χειρουργικών επεμβάσεων για την αντιμετώπιση του ορθοκολικού καρκίνου.
Α. Δεξιά κολεκτομή. Β. Αριστερή κολεκτομή. Γ. Χαμηλή πρόσθια εκτομή. Δ. Κοιλιοπερινεϊκή εκτομή
(1: ειλεοκολική αρτηρία, 2: δεξιά κολική αρτηρία, 3: μέση κολική αρτηρία, 4: κάτω μεσεντέριος αρτηρία, 5: αριστερή κολική αρτηρία)
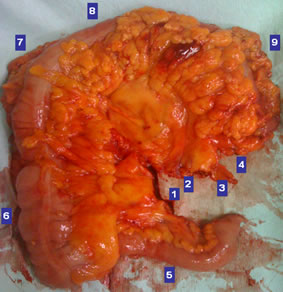
Εικόνα 13.
Παρασκεύασμα εκτεταμένης δεξιάς κολεκτομής που έγινε για καρκίνο της μεσότητας του εγκαρσίου κόλου.
- Ειλεοκολική αρτηρία. 2. Μέση κολική αρτηρία. 3. Ανιόν κλάδος αριστερής κολικής αρτηρίας. 4. Επιχείλιος αρτηρία. 5. Τελικός ειλεός. 6. Δεξιό κόλον. 7. Ηπατική καμπή. 8. Εγκάρσιο κόλον. 9. Σπληνική καμπή
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
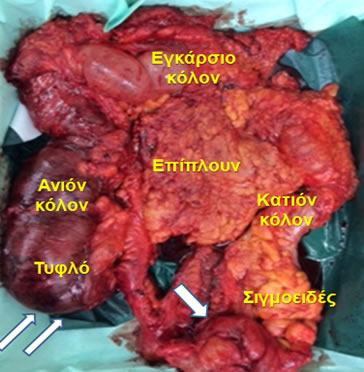
Εικόνα 14.
Παρασκεύασμα υφολικής κολεκτομής που έγινε για αποφρακτικό καρκίνο σιγμοειδούς (μονό βέλος), που οδήγησε σε ισχαιμία του δεξιού κόλου και διάτρηση του τυφλού (διπλό βέλος) καρκίνο της μεσότητας του εγκαρσίου κόλου.
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
Καρκίνος ορθού: Οι ριζικές χειρουργικές επεμβάσεις που εφαρμόζονται είναι η χαμηλή πρόσθια εκτομή και η κοιλιοπερινεϊκή εκτομή (Εικόνα 12).
Η χαμηλή πρόσθια εκτομή περιλαμβάνει την αφαίρεση του ορθοσιγμοειδούς και τη διενέργεια κολο-ορθικής ή κολο-πρωκτικής αναστόμωσης.
Η κοιλιοπερινεϊκή εκτομή περιλαμβάνει με το ορθοσιγμοειδές και την αφαίρεση του πρωκτικού αυλού, τη σύγκλειση του περινεϊκού τραύματος και τη δημιουργία μόνιμης τελικής κολοστομίας από το κατιόν κόλον.
Τα καρκινώματα του ανώτερου και μέσου τριτημορίου του ορθού αντιμετωπίζονται με χαμηλή πρόσθια εκτομή. Το άπω ογκολογικό όριο αρκεί να είναι 2 εκατοστά.
Τα καρκινώματα του κατώτερου τριτημορίου παραδοσιακά αντιμετωπίζονταν με κοιλιοπερινεϊκή εκτομή, αλλά, με την καθιέρωση του ασφαλούς ογκολογικού άπω ορίου στο 1 εκατοστό, η εκτέλεση μιας «πολύ» χαμηλής πρόσθιας εκτομής και δημιουργίας κολοπρωκτικής αναστόμωσης είναι εφικτή σε μεγάλο αριθμό ασθενών. Έτσι η διατήρηση του σφιγκτηριακού μηχανισμού είναι δυνατή (σφιγκτηροσωστικές επεμβάσεις) (Εικόνα 15).
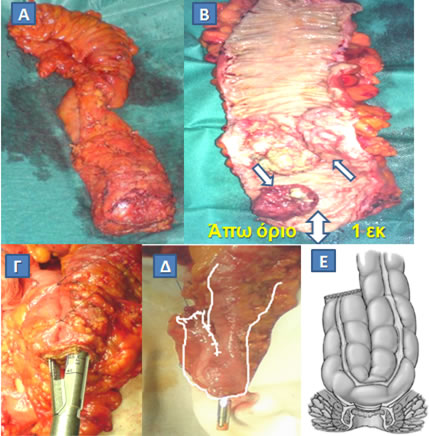
Εικόνα 15.
Διενέργεια σφιγκτηροσωστικής επέμβασης για κακοήθη νόσο του ορθού. Μετά την αφαίρεση (Α) και τη διάνοιξη (Β) του χειρουργικού παρασκευάσματος ανευρέθησαν δύο κακοήθη νεοπλάσματα επί του βλεννογόνου του ορθού (Β, μονά βέλη). Το όριο εκτομής (Β, διπλό βέλος) ήταν επαρκές (1 εκ). Το κατιόν κόλον αναδιπλώθηκε σε σχήμα J, τα σκέλη του οποίου αναστομώθηκαν με συρραπτικό (Γ), και, μτά την τοποθέτηση της κεφαλής του κυκλικού αναστομώτήρα (Δ) στην κορυφή του κολονικού θυλάκου, διενεργήθηκε κολο-πρωκτική αναστόμωση με διατήρηση του σφιγκτήρα (Ε).
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
Στην πραγματικότητα, σήμερα, η απόλυτη ένδειξη για τη διενέργεια της «ακρωτηριαστικής» κοιλιοπερινεϊκής εκτομής είναι η άμεση διήθηση των σφιγκτήρων από τον καρκίνο του κατώτερου ορθού, οπότε, αντί της «συμβατικής» κοιλιοπερινεϊκής εκτομής, προτιμάται η ευρεία «εξωανελκτηριακή» κοιλιοπερινεϊκή εκτομή, προκειμένου την πλήρη αφαίρεση του διηθημένου σφιγκτηριακού μηχανισμού και την επίτευξη επαρκούς περιμετρικού ογκολογικού ορίου (Εικόνα 16).
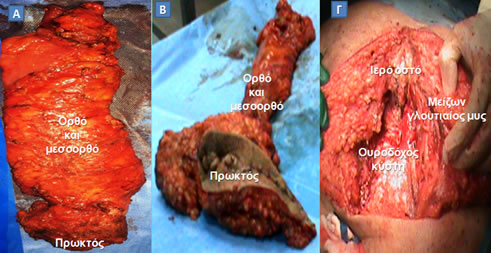
Εικόνα 16.
Α. Χειρουργικό παρασκεύασμα «συμβατικής» κοιλιοπερινεϊκής εκτομής. Β. Χειρουργικό παρασκεύασμα «εξωανελκτηριακής» κοιλιοπερινεϊκής εκτομής. Γ. Περνεϊκό έλλειμμα που απομένει μετά την ευρεία αφαίρεση πρωκτού, ορθοσιγμοειδούς, ανελκτήρων και κόκκυγα (ο ασθενής έχει τοποθετηθεί σε πρηνή θέση), το οποίο καλύπτεται με μυοδερματικό κρημνό από το μείζονα γλουτιαίο μυ.
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
Στις περιπτώσεις «πολύ» χαμηλών αναστομώσεων, οπότε η αποθηκευτική δυνατότητα των κοπράνων υπολείπεται, λόγω της απώλειας της αποθηκευτικής ιδιότητας του ορθού, προτιμάται η δημιουργία ενός κολονικού θυλάκου τύπου J (J-pouch) (Εικόνα 15), ο οποίος και αναστομώνεται με τον πρωκτικό αυλό, για να ελαττώσει τις αναπόφευκτες, ως ένα βαθμό, λειτουργικές διαταραχές (συχνές κενώσεις, έπειξη για αφόδευση).
Οποιοσδήποτε από τους τύπους επεμβάσεων και αν χρησιμοποιηθεί, πρέπει να γίνεται πλήρης και ολική αφαίρεση του μεσοορθικού λιπώδους περιβλήματος του ορθού (Εικόνα 17), με άθικτη την ιδίως μεσοορθική περιτονία και με επαρκές περιμετρικό όριο (το οποίο είναι ογκολογικά το πιο σημαντικό στον καρκίνο του ορθού), τεχνική γνωστή ως ολική μεσοορθική εκτομή (Total Mesorectal Excision, TME), διότι μέσα στο μεσοορθό περιλαμβάνονται λεμφαδένες και, πολλές φορές, εναποθέσεις και εμφυτεύσεις καρκινικών κυττάρων, ενώ, ταυτόχρονα, χρειάζεται να διατηρούνται τα αυτόνομα νευρικά πλέγματα της πυέλου, για την αποφυγή μετεγχειρητικών ουρογενετήσιων διαταραχών.
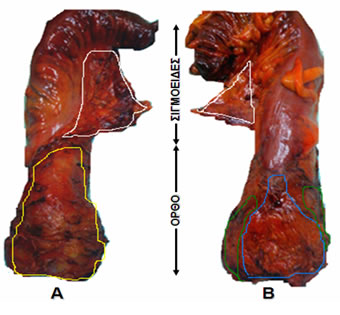
Εικόνα 17.
Χειρουργική παρασκεύασμα ορθοσιγμοειδούς μετά από ολική μεσοορθική εκτομή για καρκίνο του ορθού. Α. Οπίσθια άποψη: κίτρινο περίγραμμα στο οπίσθιο τμήμα του μεσοορθού, λευκό περίγραμμα στο μεσοσιγμοειδές. Β. Πρόσθια άποψη: μπλε περίγραμμα στο πρόσθιο τμήμα του μεσοορθού, πράσινο περίγραμμα στο πλάγιο τμήμα του μεσοορθού, λευκό περίγραμμα στο μεσοσιγμοειδές.
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
Σε επιλεγμένους ασθενείς ο καρκίνος του ορθού μπορεί να αντιμετωπιστεί αποτελεσματικά με τεχνικές εκτομής δια του πρωκτού (διορθική εκτομή, διορθική ενδοσκοπική μεκροχειρουργική), χωρίς να χρειάζεται η εκτέλεση μιας ριζικής διακοιλιακής επέμβασης (Εικόνες 18, 19). Τα κριτήρια που πρέπει να πληρούνται για τη διορθική εκτομή είναι:
- Κινητός όγκος που βρίσκεται στο κατώτερο 1/3 του ορθού
- Διάμετρος όγκου <3 εκ
- Διήθηση του καρκίνου στην υποβλεννογόνιο στιβάδα (Τ1) ή στη μυϊκή στιβάδα (Τ2), όπως αυτό διαπιστώνεται με το διορθικό υπερηχογράφημα
- Καρκίνος καλής ή μέσης διαφοροποίησης
- Απουσία λεμφαδενικών μεταστάσεων στην προεγχειρητική σταδιοποίηση με το διορθικό υπερηχογράφημα
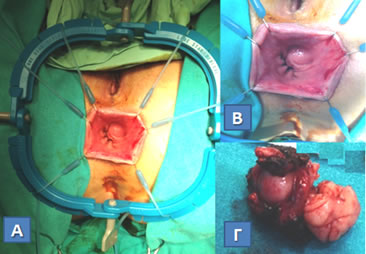
Εικόνα 18.
Διαπρωκτική αφαίρεση (Α, Β) υποβλεννογονίου στρωματικού όγκου (Gastrointestinal Stromal Tumor, GIST) ορθού (Γ). Η χρήση αυτοσυγκρατούμενου συστήματος πλαισίου-αγκίστρων Lone Star διευκόλυνε την επέμβαση.
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
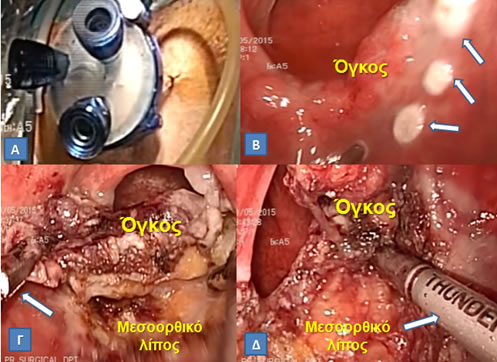
Εικόνα 19.
Α. Διαπρωκτική ελάχιστα επεμβατική χειρουργική (Transanal Minimally Invasive Surgery, TAMIS) με το ειδικό κανάλι πρόσβασης στο οποίο εισάγονται 3 μικρά trocars Το ορθό διατείνεται με εμφύσηση διοξειδίου άνθρακα (όπως στις λαπαροσκοπικές επεμβάσεις).
Β. Tα όρια εκτομής σημειώνονται στον ορθικό βλεννογόνο πέριξ της βλάβης με μονοπολική διαθερμία.
Γ, Δ. Με σύλληψη του όγκου με λαπαροσκοπική λαβίδα (Γ, βέλος), η εκτομή γίνεται σε όλο το πάχος έως και το μεσοορθικό λίπος και διευκολύνεται από τη χρήση ενέργειας διατομής-αιμοσυγκόλλησης για ελαχιστοποίηση της αιμορραγίας (Δ, βέλος).
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
Σύγχρονες προοπτικές τυχαιοποιημένες πολυκεντρικές μελέτες έχουν αποδείξει ότι, εφόσον υπάρχει η κατάλληλη εμπειρία, η λαπαροσκοπική προσπέλαση των καρκίνων του κόλου και του ορθού είναι ογκολογικά ισοδύναμη με την κλασσική «ανοικτή» κολεκτομή (Εικόνα 20).
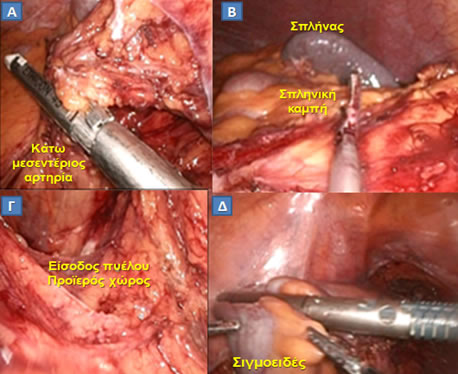
Εικόνα 20.
Διεγχειρητική άποψη σταδίων λαπαροσκοπικής επέμβασης στο παχύ έντερο.
Α. Απολίνωση κάτω μεσεντερίου αρτηρίας με ειδικό λαπαροσκοπικό κοπτορράπτη.
Β. Κινητοποίηση σπληνικής καμπής.
Γ. Είσοδος στον προϊερό χώρο.
Δ. Διατομή του σιγμοειδούς με ειδικό λαπαροσκοπικό κοπτορράπτη.
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
Επικουρική θεραπεία
Η χορήγηση μετεγχειρητικής χημειοθεραπείας ενδείκνυται στους ασθενείς με λεμφαδενικές (Ν1, Ν2, στάδιο ΙΙΙ ή C) ή/και απομακρυσμένες (Μ1, στάδιο ΙV ή D) μεταστάσεις.
Υπάρχει σαφής απόδειξη ότι η επικουρική χημειοθεραπεία ελαττώνει την υποτροπή της νόσου και αυξάνει την επιβίωση σε ορθοκολικό καρκίνο με θετικούς λεμφαδένες.
Η χημειοθεραπεία ωφελεί και ορισμένους ασθενείς με καρκίνο σταδίου ΙΙ που διαθέτουν χαρακτηριστικά υψηλού κινδύνου (Τ4, χαμηλής διαφοροποίησης, βλεννώδη).
To χημειοθεραπευτικό σκεύασμα που χρησιμοποιείται, κυρίως, είναι ο αντιμεταβολίτης 5-φθοριοουρακίλη (5-FU), ενώ τα σύγχρονα ογκολογικά πρωτόκολλα περιλαμβάνουν την προσθήκη νεότερων παραγόντων, όπως της οξαλιπλατίνης και της ιρινοτεκάνης.
Εκτός της χημειοθεραπείας, οι ασθενείς με καρκίνο του ορθού ωφελούνται από τη χορήγηση επικουρικής ακτινοθεραπείας, η οποία ελαττώνει τα ποσοστά της τοπικής υποτροπής και αυξάνει το διάστημα της ελεύθερης νόσου επιβίωσης.
Η χημειο-ακτινοθεραπεία ενδείκνυται σε καρκίνους ορθού Τ3 ή Τ4 με ή χωρίς λεμφαδενικές μεταστάσεις.
Για μεγάλους όγκους Τ3 και Τ4, ιδιαίτερα εάν υπάρχουν ενδείξεις τοπικής διήθησης της πυέλου, προτιμάται η προεγχειρητική χημειο-ακτινοθεραπεία (νέο-επικουρική θεραπεία), προκειμένου την υποσταδιοποίηση και τη συρρίκνωση του όγκου και την επίτευξη ριζικών επεμβάσεων με διατήρηση, πολλές φορές, των σφιγκτήρων.
Θεραπεία μεταστάσεων
Περίπου 20% των σθενών με ηπατικές μεταστάσεις από καρκίνο του παχέος εντέρου oφελούνται από εκτομή των μεταστατικών εστιών με 5ετή επιβίωση 30%.
Σε επιλεγμένους ασθενείς, η εκτομή ηπατικών και πνευμονικών μεταστάσεων μπορεί να σχετίζεται με μακρόχρονη επιβίωση.
Εκτός των χημειοθεραπευτικών πρωτοκόλλων, στην αντιμετώπιση της μεταστατικής νόσου, έχουν εισαχθεί τα φάρμακα της στοχευμένης θεραπείας, με κύριους εκπροσώπους τα μονοκλωνικά αντισώματα έναντι (1) του αγγειακού αυξητικού παράγοντα (VEGF), του Βevacizumab (Avastin) και (2) του επιδερμικού αυξητικού παράγοντα (EGF), του Cetuximab (Erbitux).
Παρακολούθηση ασθενών με καρκίνο παχέος εντέρου (follow-up)
Aν και η ανάγκη για εντατική επιτήρηση των ασθενών μετά το πέρας της θεραπείας αμφισβητείται, ένα δομημένο και κατευθυνόμενο πρωτόκολλο παρακολούθησης μπορεί να ανιχνεύσει πρώιμα την τοπική ή τη μεταστατική υποτροπή και να επιτρέψει την έγκαιρη έναρξη συμπληρωματικής θεραπείας ή και τη χειρουργική επανεπέμβαση, βελτιώνοντας, σε κάποιες περιπτώσεις, την ολική επιβίωση των ασθενών και εξασφαλίζοντας, σε άλλες, την αποτελεσματικότερη παρηγορική παρέμβαση.
Σύμφωνα με τις κατευθυντήριες οδηγίες του NCCN, η επιτήρηση των ασθενών μετά την αντιμετώπιση του ορθοκολικού καρκίνου περιλαμβάνει:
- Ιστορικό και αντικειμενική εξέταση κάθε 3-6 μήνες για 2 έτη και κάθε 6 μήνες για τα επόμενα 3 έτη.
- CEA κάθε 3-6 μήνες για 2 έτη και κάθε 6 μήνες για τα επόμενα 3 έτη.
- Αξονική τομογραφία κοιλίας και πυέλου κάθε χρόνο για 3 έτη.
- Κολονοσκόπηση 1 έτος μετά τη χειρουργική επέμβαση και, έκτοτε, ανάλογα με την κλινική ένδειξη (μπορεί να προστεθεί 1 κολονοσκόπηση στα 3 και στα 5 έτη, ειδάλλως εάν ο ασθενείς αναπτύξει ύποπτα συμπτώματα).
