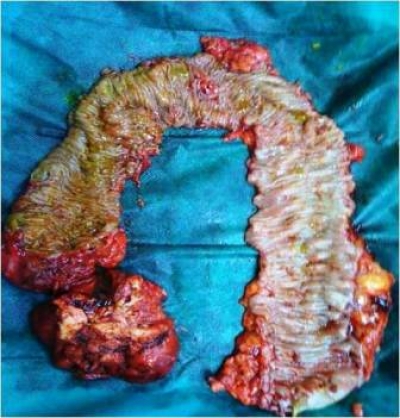
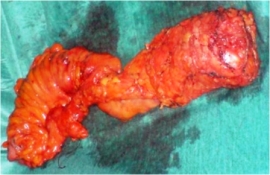
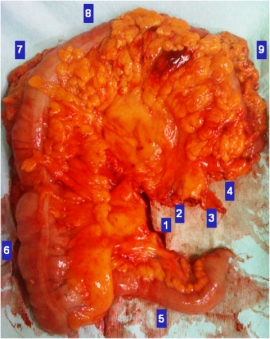
Η αιμορροϊδική νόσος είναι κοινή παθολογία που προσβάλλει το 4% του γενικού πληθυσμού παγκοσμίως. Αν και στους περισσότερους ασθενείς, η συντηρητική θεραπεία μπορεί να απαλύνει τα συμπτώματα της αιμορροϊδοπάθειας, τελικά, κάποια μορφή χειρουργικής ή, έστω, επεμβατικής θεραπείας θα απαιτηθεί στο 10% αυτών.
Οι ιδανικές θεραπείες πρέπει να στοχεύουν στην παθογένεια της αιμορροϊδοπάθειας Ο αιμορροϊδικός ιστός αποτελεί φυσιολογικό στοιχείο της ανατομίας του πρωκτικού αυλού. Αν και η «ανοικτή» και η «κλειστή» αιμορροϊδεκτομή αποτέλεσαν για δεκαετίες και, ίσως, ακόμη και σήμερα, συνεχίζουν να συνιστούν τη «χρυσή σταθερά» χειρουργικής θεραπείας και την τεχνική επιλογής για την εκρίζωση των αιμορροΐδων, είναι τεχνικές «αφαιρετικές», που εστιάζουν στην «εκτομή» ενός ιστού, που, κατά τα άλλα δεν είναι, τουλάχιστον σε όλη την έκτασή της αφαίρεσής του παθολογικός, αλλά, μάλλον περισσότερο δυσλειτουργικός. Οι επικρατούσες θεωρίες για την παθογένεια της αιμορροϊδοπάθειες είναι η «μηχανική», σύμφωνα με την οποία ο μυϊκός ινοελαστικός στηρικτικός ιστός του αιμορροϊδικού πλέγματος, ο οποίος συνίσταται από το σύνδεσμο του Parks και τις λείες μυϊκές ίνες του Tietz εκφυλίζεται με την πάροδο της ηλικίας, γεγονός που οδηγεί σε αύξηση της κινητικότητας και διόγκωση των αγγείων του πλέγματος και η «αγγειακή», σύμφωνα με την οποία τοπικός ερεθισμός οδηγεί σε διάνοιξη αρτηριοφλεβικών επικοινωνιών, αύξηση της αγγειακής πίεσης και διαστολή του αιμορροϊδικού πλέγματος. Εάν ληφθούν υπόψη οι θεωρίες της παθογένεσης της αιμορροϊδοπάθειας, η εκτομή των αιμορροΐδων, ως χειρουργική τεχνική, σε μικρό βαθμό θα μπορούσε να χαρακτηριστεί ως μέθοδος που «κατευθύνεται» στη διόρθωση της παθοφυσιολογικής δυσλειτουργίας ή της επαγόμενης από αυτήν ανατομικής ανωμαλίας της περιοχής. Απλά η αιμορροϊδεκτομή «εκριζώνει» το πρόβλημα. Δεν ήταν, ωστόσο, αυτή η έλλειψη επαρκούς παθοφυσιολογικής βάσης της αιμορροϊδεκτομής που την έκανε μάλλον ανεπιθύμητη στους ασθενείς με αιμορροΐδες, αλλά ο μετεγχειρητικός πόνος, που σε, άλλοτε άλλο βαθμό και για διάφορο χρονικό διάστημα ακολουθούσε την επέμβαση. Ο πόνος αυτός ήταν το κύριο συστατικό που οδήγησε στη «δυσφήμηση» των τεχνικών εκτομής, τουλάχιστον στο μυαλό των ασθενών, οι οποίο, ακόμη και σήμερα αναβάλλουν την οριστική θεραπεία τους επί μακρόν.
Εκτός της παράτασης της φθοράς της καθημερινής ποιότητας ζωής τους, οι ασθενείς, που ακολουθούν την αναβλητική αυτή τακτική, διατρέχουν τους εξής κινδύνους:
- τη διαιώνιση επικίνδυνων συμπτωμάτων της αιμορροϊδοπάθειας, βασικά της αιμορραγίας
- την αύξηση του βαθμού, του μεγέθους και της περιμέτρου προσβολής του πρωκτού από τους προβάλλοντες αιμορροϊδικούς όζους, κατάσταση που κάνει τη χειρουργική θεραπεία πιο δύσκολη τεχνικά, πιο επιπλεγμένη και, σαφώς πιο επώδυνη για τον ασθενή, ενώ θα μπορούσε να του στερήσει την ευκαιρία να εκμεταλλευτεί μία από τις ελάχιστα επεμβατικές μεθόδους, οι οποίες, μπορούν μεν να εφαρμοστούν σε μεγάλου βαθμού αιμορροϊδοπάθεια, η αποτελεσματικότητά τους, ωστόσο, αμβλύνεται αναλογικά με το μέγεθος των αιμορροΐδων
- την αναζήτηση βοήθειας από «μη χειρουργικές» μεθόδους, που υπόσχονται ανώδυνη θεραπεία, αν και έχουν απαξιωθεί, παγκοσμίως, από την κοινότητα των χειρουργών παχέος εντέρου και πρωκτού. Παράδειγμα τέτοιο είναι οι «επικίνδυνες» διαστολές του πρωκτού, που αν και λόγω της χάλασης του σφιγκτήρα, οδηγούν σε συμπτωματική ανακούφιση, έχουν επιπλοκές και, σαφώς, δεν προσφέρουν μακροπρόθεσμα απαλλαγή από την πάθηση. Διεθνώς, στις συστάσεις που προέρχονται από τις χειρουργικές εταιρείες παχέος εντέρου και πρωκτού, οι διαστολές δεν θεωρούνται έγκριτη τακτική για την αντιμετώπιση αιμορροϊδοπάθειας. Εκτός αυτού, ασθενείς, παρασυρόμενοι από τις «εμπορικές» τάσεις και τη διαφημιζόμενη «βαρύγδουπη» τεχνολογία, που όμως δεν έχει διέλθει του απαραίτητου κλινικού ελέγχου επαρκώς, πολύ δε περισσότερο αφορά σε πολλά υποσχόμενες ακριβές μεθόδους, καταλήγουν να «χειρουργηθούν» για τις αιμορροΐδες τους με αμφίβολα, σε βάθος χρόνου, αποτελέσματα.
Είναι αλήθεια ότι, αν και ουσιαστικά ακίνδυνες για τη ζωή των ασθενών και παρά την καλοήθη φύση τους, η παρουσία των αιμορροΐδων έχουν, πολλές φορές, δυσβάσταχτη αρνητική επίπτωση στην ποιότητα ζωής των ασθενών. Το στοιχείο αυτό σε συνδυασμό με το ότι οι επεμβάσεις για αιμορροΐδες συγκαταλέγονται στις πλέον «εμπορικές» της Ιατρικής «αγοράς», που συνήθως απαιτούν μονοήμερη νοσηλεία, μία νοσηλεία που είναι οικονομικά διαχειρίσιμη από ικανό μέρος του πληθυσμού, έχουν οδηγήσει, για αρκετά χρόνια τώρα, στην έγερση έντονου ενδιαφέροντος από την Ιατρική «βιομηχανία» για την εισαγωγή τεχνολογιών, των οποίων η αποτελεσματικότητα δεν δοκιμάστηκε επαρκώς μέσω των ενδεδειγμένων τακτικών της χειρουργικής επιστήμης. Επειδή υπόσχονταν εύκολο κέρδος, αποτέλεσαν πόλο έλξης για πολλούς χειρουργούς, που, δυστυχώς, προηγουμένως, είχαν μικρή ή και καθόλου ενασχόληση με τη χειρουργική του πρωκτού. Μάλιστα αφορούν πάντα μία ομάδα ασθενών με μία ιδιαιτέρα συχνή παθολογία, που στα μάτια πολλών «μη ειδικών» χειρουργών, θα μπορούσε, μέσα από μία επιδερμική θεώρηση, να κριθεί και εύκολη. Βέβαια, το ίδιο δεν συνέβη στα Ιδρύματα που έχουν μακρά παράδοση και εξειδικευμένες ομάδες με αποκλειστική ενασχόληση τη χειρουργική του παχέος εντέρου και του πρωκτού. Η εισαγωγή των νέων τεχνολογιών έγινε σταδιακά και μετά την αξιολόγηση τους με τις απαραίτητες κλινικές μελέτες. Έτσι, αν και η αντιμετώπιση μιας καλοήθους νόσου, όπως οι αιμορροϊδες, θα έχει πάντα επαγγελματικό ενδιαφέρον για τους χειρουργούς, αρκετές τουλάχιστον Ακαδημαϊκές και Ειδικές χειρουργικές ομάδες που δεν έχουν ως πρωταρχικό στόχο το οικονομικό κέρδος από την εφαρμογή μιας «καινοτόμας» και «επαναστατικής» τεχνολογίας στην αντιμετώπιση της αιμορροϊδοπάθειας, εστίασαν στη παθοφυσιολογική «χρησιμότητα» των νέων τεχνικών, αναλύοντας τον τρόπο με τον οποίο, διορθώνοντας την ανατομική βλάβη και όχι, απαραίτητα, αφαιρώντας τη βλάβη εξολοκλήρου, προσφέρεται λύση στο πρόβλημα της αιμορροϊδικής νόσου.
H πίεση της Ιατρικής «βιομηχανίας» για την ενσωμάτωση ακριβών τεχνολογιών επεκτάθηκε εξαρχής και στον τρόπο με τον οποίο διενεργείται η απλή αιμορροϊδεκτομή. Πέραν του κλασσικού χειρουργικού νυστεριού και του ψαλιδιού που παραδοσιακά χρησιμοποιείται στην εκτομή εφαρμόστηκαν και πιο εξελιγμένες τεχνολογικά μέθοδοι κοπής και καυτηριασμού των αιμορροϊδικών όζων, όπως η πιο φθηνή διαθερμία, αλλά και ιδιαιτέρως πιο ακριβές πηγές ενέργειας, όπως το ψαλίδι υπερήχων, η ηλεκτροθερμοπηξία και το laser. Ειδικά για το τελευταίο, που ήταν η ενέργεια του συρμού στη δεκαετία του 1990, όχι μόνο δεν αποδείχθηκαν πλεονεκτήματα από τη χρήση του, αλλά λόγω της ιστικής καταστροφής που προκαλούσε, ενοχοποιήθηκε και για πρωκτικές στενώσεις. Τουλάχιστον ως εργαλείο κοπής και αιμόστασης στις αιμορροϊδες δεν συστήνεται από τις σοβαρές εταιρείες της χειρουργικής παχέος εντέρου και πρωκτού. Όσον αφορά τις μοντέρνες μορφές ενέργειας, δεν αποδείχθηκε κάποιο όφελος, συγκριτικά με την παραδοσιακή αιμορροδεκτομή με το ψαλίδι,, στις διάφορες κλινικές μελέτες που έγιναν και στις μετα-αναλύσεις που προήλθαν από αυτές. Λιγότερο μετεγχειρητικό πόνο παρατηρήθηκε μόνο από την αιμορροϊδεκτομή με Ligasure, με τίμημα, ωστόσο, το υψηλότερο κόστος. Οι πληροφορίες αυτές πρέπει να περιλαμβάνονται στην ενημέρωση των ασθενών, οι οποίοι, πολλές φορές, προσέρχονται με το πρόβλημα των αιμορροΐδων, αρκετά αγχωμένοι και σε σύγχυση, αφού τη βασική πληροφόρησή τους την έχουν λάβει μόνο από ενημερωτικές έντυπες και ηλεκτρονικές «εμπορικές» πηγές, χωρίς, αρκετές φορές, σαφή επιστημονική βάση. Πολλές φορές, είναι ήδη πεισμένοι ότι το νυστέρι στην αιμορροϊδεκτομή είναι αυτό που προκαλεί τον πόνο μετεγχειρητικά και εναγωνίως ζητούν την αποφυγή του. Πρέπει να τους τονιστεί ότι η τεχνική, η οποία και πρέπει να περιλαμβάνει τη μικρότερη δυνατή εκτομή και το μέγιστο δυνατο σεβασμό στο ευαίσθητο πρωκτόδερμα, είναι αυτή που σε σημαντικό βαθμό καθορίζει το πόνο και όχι το «ακριβό» μέσο - εργαλείο που τους έχει διαφημιστεί.
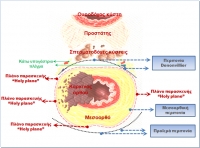
Οι δύο πλέον «διαφημισμένες» μοντέρνες ελάχιστα τραυματικές, «μη αφαιρετικές» τεχνικές, που, τουλάχιστον στη βασική τους εφαρμογή δεν απαιτούν αιμορροίδεκτομή, είναι η αιμορροϊδοπηξία με συρραπτικό (stapled hemorrhoidopexy, procedure for prolapsed hemorrhoids, PPH), γνωστή και ως τεχνική Longo από τον εμπνευστή της, και η υπερηχογραφικά καθοδηγούμενη απολίνωση των αιμορροϊδικών αγγείων (Doppler-guided hemorrhoidal artery ligation, DG-HAL) ή διαπρωκτική αιμορροϊδική απαγγείωση (Transanal Hemorrhoidal Dearterialization, THD) η οποία συνδυάζεται με ή χωρίς αιμορροϊδοπηξία με συνεχή ραφή ανάρτησης των αιμορροϊδικών όζων. Παθοφυσιολογικά μπορεί να θεωρηθεί ότι τουλάχιστον στοχεύουν στη διόρθωση των γενεσιουργών υποκείμενων μηχανισμών, που οδηγούν στη γένεση της αιμορροϊδοπάθειας. Η τεχνική PPH προσπαθεί να διορθώσει το «μηχανικό» πρόβλημα με την εξάλειψη της ορθοπρωκτικής βλεννογονικής διολίσθησης μέσω της περιμετρικής ανάρτησης των υποστηριγμάτων των αιμορροϊδων, δηλαδή του χαλαρού υποβλεννογονίου συνδετικού και λείου μυϊκού ιστού. Η HAL/THD, από μόνη της στοχεύει στο «αγγειακό» σκέλος της παθογένειας, με την ελάττωση της αρτηριακής άρδευσης στο υπερδιογκωμένο αιμορροϊδικό πλέγμα, η οποία επιτυγχάνεται με τον ακριβή, υπερηχογραφικά καθοδηγούμενο, εντοπισμό και την, εν συνεχεία, απολίνωση των τελικών κλάδων της άνω αιμορροϊδικής αρτηρίας, βασικού τροφοδοτικού αγγείου του κατώτερου ορθού, από όπου εξορμάται ο αιμορροϊδικός ιστός. Όταν η HAL/THD συνδυάζεται με την αιμορροϊδοπηξία, τότε, τουλάχιστον στα σημεία της μέγιστης πρόπτωσης των αιμορροΐδων, αποκαθίσταται η επανατοποθέτησή τους στην εγγύτερη περισσότερο «φυσιολογική» θέση τους, ενώ ο υποβλεννογόνιος ιστός ισχυροποιείται μέσω της ίνωσης που δημιουργείται από τη συνεχόμενη καθηλωτική ραφή της αιμορροϊδοπηξίας – βλεννογονοπηξίας.
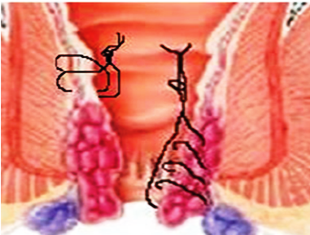
Υπερηχογραφικά καθοδηγούμενη απολίνωση αιμορροϊδικών αγγείων και αιμορροϊδοπηξία (διαγραμματική αναπαράσταση)
Βέβαια η αιμορροϊδοπηξία – βλεννογονοπηξία για την αντιμετώπιση της αιμορροϊδικής νόσου, συστατικό στοιχείο και των δύο μοντέρνων μεθόδων δεν αποτελεί σύγχρονη επινόηση. Η τεχνική αυτή στη βάση της διόρθωσης του χαλαρού, στηρικτικού του αιμορροϊδικού πλέγματος, υποβλεννογονίου ιστού περιγράφηκε για πρώτη φορά από τον Fournier και παρουσιάστηκε στο υψηλής απήχησης και ισχυρής επιστημονικής εμβέλειας χειρουργικό περιοδικό Annals of Surgery το 1949! Αυτήν ακριβώς την αιμορροϊδοπηξία, η οποία, εξάλλου μπορεί να γίνει και υπό άμεση όραση, με έναν απλό πρωκτοδιαστολέα και χωρίς απαραιτήτως με την αποκλειστική χρήση του εξοπλισμού που προσφέρουν οι εταιρείες, «αντιγράφουν» οι σύγχρονες τεχνικές. Το πρόβλημα με την τεχνική PPH ξεκινά από τη στιγμή που αποσκοπεί στην «περιμετρική» ανάρτηση του αιμορροϊδικού ιστού και, μάλιστα, με τη χρήση ενός συρραπτικού που απελευθερώνει μεταλλικούς αγκτήρες, οι οποίοι τοποθετούνται αμετακλήτως και μόνιμα επί του βλεννογόνου του κατώτερου ορθού, τμήμα του οποίου έχει προηγουμένως εκταμεί και επανασυρραφεί. Αντιθέτως στην τεχνική HAL/THD χρησιμοποιείται συνεχές απορροφήσιμο «μη μόνιμο» ράμμα, το οποίο τοποθετείται μόνο στις θέσεις πρόπτωσης των αιμορροϊδικών όζων και όχι σε όλη την περίμετρο του κατώτερου ορθού. Αυτό προσφέρει θεωρητικό πλεονέκτημα στην HAL/THD, αφού το όποιο λειτουργικό πρόβλημα και η όποια ανατομική επιπλοκή δυνητικά προέρχεται από την εφαρμογή της τεχνικής είναι αναστρέψιμα και λύονται μετά την απορρόφηση των ραμμάτων, ενώ οι τυχόν επιπλοκές της μπορεί να είναι σοβαρές και δυσεπίλυτες, αφού οι αγκτήρες του συρραπτικού παραμένουν μόνιμα.
Δύο μετα-αναλύσεις που δημοσιεύθηκαν το 2009 (Giordano et, Arch Surg 2009 & Burch et al, Colorectal Dis 2009) επιβεβαίωσαν ότι, αν και ο μετεγχειρητικός πόνος είναι λιγότερος και η επαναφορά στις καθημερινές δραστηριότητες είναι ταχύτερη μετά την εφαρμογή της τεχνικής PPH σε σύγκριση με τη συμβατική αιμορροϊδεκτομή, οι υποτροπές της αιμορροϊδοπάθειας και οι επανεπεμβάσεις για αιμορροΐδες είναι σε στατιστικά σημαντικό βαθμό συχνότερες μετά την PPH. Οι μελετητές που ασχολήθηκαν με την ανάλυση αυτών των αποτελεσμάτων δικαίως συστήνουν ότι οι ασθενείς πρέπει να ενημερώνονται ότι τελικώς είναι δική τους επιλογή ένα θέλουν να δεχθούν την υψηλή πιθανότητα υποτροπής και την πιθανή επανεπέμβαση, στην οποία πιθανά να χρειαστεί να υποβληθούν μελλοντικά, επωφελούμενοι όμως από τα βραχυπρόθεσμα πλεονεκτήματα της τεχνικής PPH, δηλαδή το λιγότερο πόνο. Ένα σημαντικότερο πρόβλημα, όμως, και από αυτό των συχνών υποτροπών είναι ο σχετικά υψηλός αριθμός των σοβαρών και δυσεπίλυτων επιπλοκών που έχουν αναφερθεί μετά την εφαρμογή της τεχνικής PPH. Επιπλοκές, όπως διάτρηση του ορθού κατά την εφαρμογή του συρραπτικού, πυελική σήψη από την επιμόλυνση των περιορθικών ιστών λόγω διαφυγής της αναστομωτικής γραμμής που αναπόφευκτα διενεργείται για την μηχανική περιμετρική αιμορροϊδοπηξία, ορθοκολπικά συρίγγια, αιμορραγίες, βαριά περιπρωκτική σήψη, που οδήγησε σε γάγγραινα Fournier, κολοστομία ή και θάνατο, δημιούργησαν έντονο σκεπτικισμό στις εξειδικευμένες ομάδες που ασχολούνται χειρουργικά με την περιοχή και ελάττωσε τον αρχικό ενθουσιασμό για την ανακάλυψη της «ανώδυνης» μεθόδου για τις αιμορροΐδες. Ακόμα και ειδικό σύνδρομο περιγράφηκε για τις λειτουργικές διοαταραχές που περιστασιακά ακολουθούν την τεχνική PPH, το μετά-PPH σύνδρομο. Χαρακτηρίζεται από έντονο πόνο και δυσάρεστο αίσθημα συχνής έπειξης για αφόδευση και μπορεί να επιμένει επί μακρόν, έως και 15 μήνες μετά το χειρουργείο. Αν και έχει ενοχοποιηθεί η απειρία των χειρουργών για πολλά από αυτά τα δυσάρεστα συμβάματα καθώς και η ανεπαρκής εκπαίδευσή τους στην τεχνική, δύο βασικοί παράμετροι πρέπει να ληφθούν σοβαρά υπόψη για την, αν όχι αποτυχία, πάντως για τη μη κατάληψη της υψηλής θέσης, την οποία φιλοδοξούσε να καταλάβει στις προτιμήσεις πολλών σοβαρών χειρουργικών ομάδων παχέος και πρωκτού. Η πρώτη παράμετρος αφορά στο ότι, λόγω του έντονου εμπορικού ενδιαφέροντος, πολλοί μη χειρουργοί πρωκτού ενεπλάκησαν και επέδειξαν ενδιαφέρον για μία τεχνική που, αν και τη διευκολύνει σημαντικά η τεχνολογία, δεν είναι καθόλου απλή και έχει τεχνικές λεπτομέρειες, τις οποίες μπορεί να μη συνειδητοποιεί κάποιος που δεν έχει ως πρωταρχική ενασχόλησή του την περιοχή του πρωκτού. Η δεύτερη παράμετρος αφορά εγγενή μειονεκτήματα της μεθόδου, από την άποψη ότι γίνεται με ένα πρωτυποποιημένο τρόπο, ακολουθώντας τα ίδια τεχνικά βήματα για όλους τους ασθενείς, και δεν λαμβάνει υπόψη την εκ των πραγμάτων διαφορετικότητα στην ανατομία της μίας ορθοπρωκτικής χώρας από την άλλη. Λαμβανομένων υπόψη της συχνότητας των υποτροπών, τις πιθανές σοβαρές επιπλοκές, αλλά και το κόστος του εργαλείου που χρησιμοποιείται, η τεχνική PPH σήμερα φαίνεται ότι πρέπει να διαφυλάσσεται μόνο για ασθενείς με περιμετρικώς προπίπτουσες, υψηλού βαθμού αιμορροΐδες, οι οποίες και επεκτείνονται πέραν των κλασσικών 3 θέσεων που ανατομικά συνήθως ανευρίσκονται.
Η «πτώση» της PPH έδωσε περαιτέρω ώθηση και στροφή ενδιαφέροντος στην άλλη ελάχιστα επεμβατική «μη αφαιρετική» τεχνική της τελευταίας δεκαετίας της HAL/THD. Aν και αυτή δεν αποτέλεσε την πανάκεια για την «ανώδυνη» αντιμετώπιση της αιμορροϊδικής νόσου, αφού, τουλάχιστον στα πρώτα χρόνια της εφαρμογής της στόχευε μόνο στην απολίνωση των αγγείων και την απαγγείωση του αιμορροϊδικού πλέγματος, οπότε και δεν ήταν επαρκής μέθοδος για τις προπίπτουσες 3ου και 4ου αιμορροΐδες, βελτιώθηκε σημαντικά όταν συνδυάστηκε με την αιμορροϊδοπηξία με συνεχή ραφή. Αυτή η προσθήκη ήταν κοινή τακτική σε πολλές χειρουργικές ομάδες που εφάρμοζαν τη μέθοδο εξ’ αρχής και γινόταν με το συμβατικό τρόπο, αλλά επεκτάθηκε με τις ειδικές τροποποιήσεις που έγιναν στον εξοπλισμό που διατέθηκε από τις συναφείς εταιρείες κατασκευής των ειδικών πρωκτοσκοπίων της HAL και της THD. Αν και οι υποτροπές δεν είναι άγνωστες, ειδικά εάν δεν συμπεριληφθεί και μία «ελάχιστη εκτομή» και δεν είναι μέθοδος πάντα «ανώδυνη» (βλέπε περισσότερα στην ενότητα «Ειδικές τεχνικές» στο θέμα «Η μέθοδος της απολίνωσης των αιμορροϊδικών αγγείων και οι παραλλαγές της στην αντιμετώπιση της αιμορροϊδοπάθειας») στις συγκριτικές μελέτες της HAL/THD με την PPH, η τεχνική HAL/THD ακολουθείτο από λιγότερο μετεγχειρητικό πόνο, είχε ταχύτερη ανάρρωση, σχετιζόταν με λιγότερες επιπλοκές και ήταν λιγότερο κοστοβόρα τεχνική από την PPH. Η τεχνική PPH, ωστόσο, υπερτερούσε όσον αφορά τις υποτροπές, που, αν και υπαρκτές, ήταν λιγότερες.
Οι ασθενείς πρέπει να ενημερώνονται για όλα τα πλεονεκτήματα και τα μειονεκτήματα των μεθόδων που προσφέρουν ίαση από την αιμορροϊδική νόσο. Οι «μύθοι» περί ολοκληρωτικά ανώδυνων, οριστικά απαλλακτικών, ανεπίπλεκτων και μακροπρόθεσμα αποτελεσματικών θεραπειών δεν αρμόζουν σε απόλυτο βαθμό στις «ελάχιστα τραυματικές» τεχνικές για την αιμορροϊδική νόσο. Οι επεμβάσεις που είναι «ελάχιστα τραυματικές» δεν είναι πάντα «ανώδυνες», πολύ δε περισσότερο δεν εξασφαλίζουν απόλυτα τη μη επανεμφάνιση αιμορροϊδικών όζων σε βάθος χρόνου. Η μεγαλύτερη ίσως συνεισφορά των «ελάχιστα τραυματικών» μεθόδων ήταν η επαναξιολόγηση της παθογένειας της αιμορροϊδικής νόσου και η καλύτερη κατανόηση των ανατομικών ανωμαλιών που υπόκεινται και πρέπει να διορθωθούν. Η παραδοχή, τέλος, ότι η εκριζωτική τακτική, αν και απολύτως αποτελεσματική, πρέπει να αμβλυνθεί και να κατευθυνθούμε σε τροποποιημένες τεχνικές που σέβονται το πρωκτόδερμα και το φυσιολογικό βλεννογόνο και στοχεύουν στο καθαρά παθολογικό στοιχείο της αιμορροΐδας. Το εάν αυτό θα επιτευχθεί αποκλειστικά με τη χρήση της σύγχρονης τεχνολογίας, το εάν αυτή δεν είναι απαραίτητη καθόλου ή το εάν τελικά θα ενσωματωθεί ως επιβοηθητική τροποποιημένων «ελάχιστα αφαιρετικών» τεχνικών ή ακόμα και στα πλαίσια μιας πλατφόρμας, όπου η τεχνική θα εξατομικεύεται αναλόγως του ασθενή, στα χέρια πάντα των εξειδικευμένων χχειρουργών παχέος εντέρου και πρωκτού, θα το δείξουν τα αποτελέσματα της εμπειρίας που σταδιακά συσσωρεύεται, αλλά κυρίως οι καλά σχεδιασμένες μελέτες από τις χειρουργικές ομάδες κύρους.
Εισαγωγή- Ορισμός
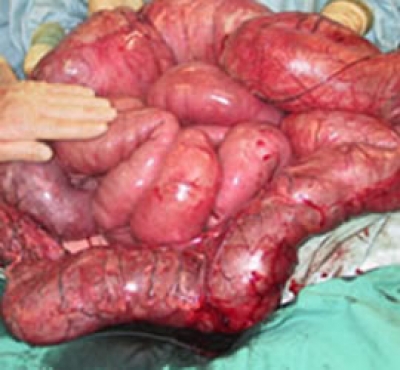
Η πρόπτωση του ορθού (procidentia) αποτελεί, αναντίρρητα, μια νοσολογική οντότητα με αναπηρική επίδραση στην ποιότητα ζωής του/της άτυχου ασθενούς. Η παρουσία της έχει δυσμενείς συνέπειες στις λειτουργίες της αφόδευσης και της εγκράτειας των κοπράνων. Το γεγονός ότι 100 περίπου χειρουργικές επεμβάσεις έχουν περιγραφεί για τη χειρουργική αποκατάσταση της πάθησης αυτής αναδεικνύει την αδυναμία πολλών από αυτές να οδηγήσουν σε απόλυτα ικανοποιητικά ανατομικά και λειτουργικά αποτελέσματα. Με τον όρο πρόπτωση του ορθού, περιγράφεται η κυκλοτερής, ολικού πάχους, προβολή του τοιχώματος του ορθού διά του πρωκτικού αυλού.
Ιστορικά δεδομένα
Η πρώτη κλινική περίπτωση πρόπτωσης του ορθού αναγνωρίστηκε σε μια αρσενική μούμια, που βρέθηκε στην Αντινόη της Αιγύπτου και φαίνεται να χρονολογείται από περίπου 500 χρόνια π.Χ. Ο Ιπποκράτης αναγνώρισε την πρόπτωση ως κλινική οντότητα και περιέγραψε αρκετές ειδικές θεραπείες. Για την ανάταξη των δύσκολων περιστατικών συνέστησε την ανάρτηση του ασθενούς από τους αστραγάλους του, ενώ για την επίτευξη μόνιμης ανάταξης συμβούλευε την εφαρμογή καυστικής ποτάσας επί του βλεννογόνου του ορθού.
Κατά τους Αναγεννησιακούς χρόνους, ο Vesalius (1514-1564), στα κειμενά του (De Humani Corpus, 1543), δίνει, για πρώτη φορά, λεπτομερή περιγραφή της ανατομίας του παχέος εντέρου, καθώς και του πρωκτού και του σφιγκτηριακού μηχανισμού του. Βασισμένοι σε αυτές τις περιγραφές, οι χειρουργοί του 16 ου αιώνα (Μercurialis, Riolannus, Fabricius, Pare) απέδωσαν την πρόπτωση σε δυσλειτουργία των ανελκτήρων και σε πάρεση των σφιγκτήρων μυών του πρωκτού. Ο John Hunter (1728-1793) την περιέγραψε ως εκστροφή του εντέρου εκτός του σώματος.
Στις αρχές του 20ου αιώνα, ο Moschovitz, στην επέμβαση που επινόησε, καταργούσε το βαθύ χώρο του Douglas, προκειμένου να εμποδίσει τις αυξημένες ενδοκοιλιακές πιέσεις να προωθήσουν το πρόσθιο τοίχωμα του ορθού μέσα από ένα χάσμα της πυελικής περιτονίας. Πολλές επεμβάσεις περιγράφησαν κατά τη διάρκεία των χρόνων που ακολούθησαν και ονόματα χειρουργών όπως των Ripstein, Delorme, Altemeier και άλλων συνδέθηκαν με χειρουργικές μεθόδους αποκατάστασης της πρόπτωσης του ορθού. Τέλος, η τεχνολογική πρόοδος των τελευταίων δεκαετιών έδωσε ώθηση στην ανάπτυξη και εξέλιξη των λαπαροσκοπικών επεμβάσεων, οι οποίες και αποτελούν τις μεθόδους αναφοράς στη χειρουργική θεραπεία πολλών ενδοπεριτοναϊκών νόσων. Το 1992, εκτελέστηκε η πρώτη λαπαροσκοπική ορθοσιγμοειδεκτομή για διόρθωση πρόπτωσης του ορθού από τον G.H. Ballantyne στη Βαλτιμόρη των Η.Π.Α.
Αιτιοπαθογένεια
Ο Moschovitz πρότεινε το 1912 τη θεωρία της κήλης κατ’ επολίσθηση μέσω ενός χάσματος της πυελικής περιτονίας. Η θεωρία βασίστηκε στην παρατήρηση ότι ο βαθύς χώρος του Douglas αποτελεί ανατομικό στοιχείο που χαρακτηρίζει την πλειοψηφία των περιπτώσεων ολικής πρόπτωσης του ορθού. Η δεύτερη θεωρία, η οποία προτάθηκε από τους Broden και Snellman (1968) υποστηρίζει ότι η πρόπτωση του ορθού είναι το τελικό αποτέλεσμα ενός φάσματος διαταραχών που αρχίζει με την εμφάνιση εγκολεασμού όλης της περιφέρειας του τοιχώματος ορθού και καταλήγει στην ολικού πάχους πρόπτωση του διά του πρωκτικού σωλήνα. Οι υποστηρικτές της άποψης αυτής, έτσι, αμφισβήτησαν την κήλη του χώρου του Douglas προς τον αυλό του ορθού σαν την πρωτοπαθή διαταραχή που οδηγεί στη πρόπτωση του ορθού. Στην πραγματικότητα όμως οι δύο παραπάνω παθογενετικές διαδικασίες είναι οι ίδιες. Έτσι, ο εγκολεασμός του πρόσθιου τοιχώματος του ορθού που περιγράφεται ως κήλη κατ’επολίσθηση μπορεί να περιγραφεί και ως εγκολεασμός που δεν έχει ακόμη αναπτυχθεί περιμετρικά σε ολόκληρη την περιφέρεια του τοιχώματος του ορθού.
Ταξινόμηση
Δεν υπάρχουν γενικώς αποδεκτά σχήματα ταξινόμησης για την πρόπτωση του ορθού. Σύμφωνα με την ταξινόμηση του Altemeier, που βασίζεται σε ανατομικά δεδομένα η πρόπτωση διακρίνεται στους παρακάτω τύπους:
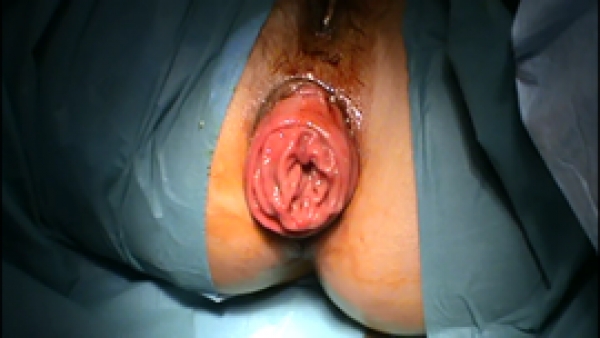
•Τύπος Ι: Προεκβολή του πλεονάζοντος βλεννογόνου ή ψευδο-πρόπτωση ή βλεννογονική πρόπτωση (mucosal prolapse), η οποία σχετίζεται και πρέπει να αντιμετωπίζεται στα πλαίσια του φάσματος της αιμορροϊδικής νόσου.
•Τύπος ΙΙ: Ενδοορθικός εγκολεασμός με συνοδό κήλη του cul-de-sac
•Τύπος ΙΙΙ: Κήλη κατ’ επολίσθηση του cul-de-sac, η οποία ορίζει και την πλειονότητα των περιπτώσεων.
Οι Beahrs, Theuerkauf και Hill πρότειναν ένα κλινικό σχήμα ταξινόμησης βασιζόμενοι στη θεώρηση της πρόπτωσης ως εγκολεασμού. Λαμβάνοντας υπόψη το βαθμό πληρότητας της πρόπτωσης, την κατηγοριοποίησαν ως εξής:
Ι: Ατελή (incomplete) βλεννογονική πρόπτωση (mucosal prolapse)
II: Πλήρη (complete) ολικού πάχους τοιχώματος πρόπτωση ορθού:
•1ου βαθμού, πρώϊμη, υψηλή, συγκαλυμένη (concealed), αφανής (invisible, occult), εσωτερική (internal) πρόπτωση (ενδοορθικός εγκολεασμός),
•2ου βαθμού (εμφανής κατά τη προσπάθεια)
•3ου βαθμού (εξωτερικά εμφανής)
Παρ’ όλα αυτά, τα συστήματα ταξινόμησης παραμένουν ατελή, κυρίως, λόγω του ότι δεν περιλαμβάνουν τις σημαντικές λειτουργικές εκφάνσεις της πρόπτωσης, όπως τον ποσοτικό και ποιοτικό βαθμό της συνοδού, πολλές φορές, ακράτειας.
Ανατομικές- Λειτουργικές ανωμαλίες
Οι ανατομικές ιδιομορφίες και τα ελλείματα που απαντώνται με την πρόπτωση του ορθού περιλαμβάνουν τα εξής: (1) έλλειμα στο πυελικό έδαφος με διάσταση του ανελκτήρα μυ του πρωκτού, (2) ένας ασυνήθιστα βαθύς χώρος του Douglas (oρθοκυστικός χώρος για τους άνδρες, ορθοκολπικός χώρος για τις γυναίκες), (3) πλεονάζον σιγμοειδές (δολιχοσιγμοειδές), (4) χαλαρός πρωκτικός σφιγκτήρας, και (5) απώλεια της οριζόντιας θέσης του ορθού και της οπίσθιας κυρτότητάς του σε σχέση με το ιερό, λόγω της χαλάρωσης των προϊερών προσφύσεών του. Οι υποστηρικτές της θεωρίας του εγκολεασμού θεωρούν ότι οι παραπάνω ανατομικές αλλαγές αποτελούν, ως επί το πλείστον, δευτερογενείς εκδηλώσεις (επιφαινόμενα) υποτροπιαζόντων επεισοδίων της πρόπτωσης.
Ο Spencer μελέτησε μανομετρικά ασθενείς με πρόπτωση του ορθού και παρατήρησε ότι το ορθοπρωκτικό ανασταλτικό αντανακλαστικό (ΟΠΑΑ) (recto-anal inhibitory reflex) δεν εκλυόταν ή παρουσίαζε σημαντική άμβλυνση. Άλλη μανομετρική μελέτη ανέδειξε ελαττωμένες πιέσεις ηρεμίας (resting) και φυσιολογικές πιέσεις προσπαθείας (squeeze), σχετιζόμενες, αντίστοιχα, με δυσλειτουργία του έσω σφιγκτήρα και φυσιολογική λειτουργική κατάσταση του έξω σφιγκτήρα. Στην ομάδα των ασθενών με πρόπτωση και ακράτεια, ωστόσο, ιστολογικές και ηλεκτρομυογραφικές μελέτες έδειξαν απονεύρωση των γραμμωτών μυών του σφιγκτηριακού συμπλέγματος (ηβοορθικού και έξω σφιγκτήρα). Οι Sun και συν, σε μια λεπτομερή συγκριτική μελέτη με υγιείς, κατέληξαν στο ότι τόσο οι πιέσεις ηρεμίας όσο και οι πιέσεις προσπαθείας ήταν μειωμένες στην ομάδα των ασθενών με πρόπτωση. Κατά την αύξηση της ενδοκοιλιακής πίεσης, οι πιέσεις στον πρωκτικό αυλό παρουσίαζαν σημαντική πτώση συγκριτικά με τις ενδοορθικές πιέσεις στους ασθενείς, φαινόμενο που δεν επαληθευόταν στους υγιείς. Με την πλήρωση του ορθού με φουσκωμένο μπαλλόνι, το μεγαλύτερο ποσοστό των ασθενών με πρόπτωση παρουσίαζε επαναλαμβανόμενες συσπάσεις του ορθού, ενώ ο ελάχιστος όγκος του ορθού που προκαλούσε έπειξη για αφόδευση και ο μέγιστος όγκος πλήρωσης που ήταν ανεκτός ήταν σημαντικά μικρότεροι στους ασθενείς. Φαίνεται, λοιπόν, ότι μια εγγενής υπερευαισθησία και υπεραντιδραστικότητα δημιουργούν τις κατάλληλες συνθήκες για την προώθηση και, συνεπώς την πρόπτωση του ανώτερου ορθού έως και τον πρωκτικό αυλό.
Τα περινεϊκά νεύρα (από τα Ι3- Ι4 νευροτόμια) και, ειδικά, οι αιδοιϊκοί κλάδοι τους (pudendal nerves) συμπαρασύρονται και παγιδεύονται από το προπίπτον ορθό, καταλήγοντας σε πάρεση και νευραπραξία (αιδοιϊκή νευροπάθεια, pudendal neuropathy). Σύμφωνα με τους Parks και συν, τα παραπάνω οδηγούν σε νευρογενή μυοπάθεια, χαλάρωση και αδυναμία του πυελικού εδάφους (ανελκτήρας, σφιγκτήρες). Αν ληφθεί, μάλιστα, υπόψιν η έναρξη της διεργασίας της πρόπτωσης αρκετά πιο ψηλά από το πυελικό έδαφος, όπως φαίνεται στον απεικονιστικό έλεγχο με αφοδευσιογραφία, η χαλάρωση των πυελικών μυών αποτελεί μάλλον το αποτέλεσμα και όχι το αίτιο της γένεσης της πρόπτωσης.
Προδιαθεσικοί παράγοντες
Σε μεγάλες σειρές ασθενών, όπως αυτή από το νοσοκομείο St. Mark’s (536 ασθενείς), το ιστορικό έντονης προσπάθειας στην αφόδευση με επιμένουσα δυσκοιλιότητα και οι συχνές διαρροϊκές κενώσεις αναφέρονται σαν βασικοί προδιαθεσικοί παράγοντες. Αν και η εγκυμοσύνη έχει ενοχοποιηθεί, η πρόπτωση εμφανίζεται συχνότερα στις άτοκες γυναίκες. Στην πραγματικότητα, σε αντίθεση με τις πρωτοπαθείς σφιγκτηριακές διαταρραχές της εγκράτειας, η πολυτοκία δεν αποτελεί προδιαθεσικό παράγοντα για την πρόπτωση του ορθού. Η οντότητα αυτή συνυπάρχει με προηγούμενες επεμβάσεις στην πύελο καθώς και με νευρολογικές και ψυχιατρικές πασθήσεις.
Επιδημιολογία
Εξαιτίας της φύσης της διαταραχής και του δισταγμού από πλευράς των ασθενών για αναζήτηση ιατρικής βοήθειας, η πραγματική συχνότητα της πρόπτωσης του ορθού είναι αδύνατο να υπολογισθεί. Οι περισσότεροι ασθενείς είναι γυναίκες, ενώ στους ενήλικες, η σχέση γυναικών προς άνδρες είναι περίπου 6:1. Η μεγαλύτερη συχνότητα παρουσιάζεται στις γυναίκες σε ηλικίες μεγαλύτερες των 50 ετών, ενώ στους άνδρες κατανέμεται ισότιμα στις ηλικιακές ομάδες.
Κλινική εικόνα
Συμπτωματολογία
Το κύριο ενόχλημα των ασθενών είναι η διά του πρωκτού προβάλλουσα μάζα καθαυτή, η οποία και έχει σημαντικά δυσμενή επίδραση στην ψυχολογία τους, ιδιαίτερα, μάλιστα, όταν συνοδεύεται από πραγματική ακράτεια των κοπράνων ή ακόμη και απλή συνεχή εκροή βλεννοαιματηρού υγρού, που λεκιάζει τα εσώρουχά τους. Αρχικά, η πρόπτωση είναι αυτόματα ή με τη βοήθεια χειρισμών από τον ασθενή ανατασσόμενη και εμφανίζεται κατά την προσπάθεια (αφόδευση, πτάρνισμα ή βήχας). Σε προχωρημένα στάδια μπορεί να προβάλλει μόνιμα και να προκαλέσει περίσφιγξη έως ακόμη και στραγγαλισμό και ισχαιμία του προπίπτοντος ορθού. Τα συμπτώματα αποφρακτικής δυσχεσίας, η δυσκοιλιότητα του τύπου της «απόφραξης της εξόδου» (outlet obstruction constipation), το αίσθημα ατελούς κένωσης και του τεινεσμού, που παρουσιάζονται στο 50% των περιπτώσεων πρόπτωσης οφείλονται στην απόφραξη του ορθικού αυλού από το εκολεαζόμενο τμήμα του αλλά και από το συχνά συνυπάρχον πλεονάζον σιγμοειδές που συμπαρασύρεται, συμμετέχοντας στο προπίπτον τμήμα του εντέρου.
Υψηλό ποσοστό ασθενών (50-80%) με πρόπτωση του ορθού βασανίζεται από ακράτεια κοπράνων. Η παθοφυσιολογία της δυσλειτουργίας αυτής έγκειται στα εξής: (1) στη λειτουργική ανεπάρκεια του έσω σφιγκτήρα, λόγω της συνεχούς έκλυσης του ΟΠΑΑ από την επαναλαμβανόμενη πλήρωση της ορθικής λυκήθου από το προπίπτον ορθό, (2) στη δυσλειτουργία του έξω σφιγκτήρα από την πιθανά συνοδεύουσα αιδοιϊκή νευροπάθεια και (3) στην άμβλυνση της ορθοπρωκτικής αισθητικότητας, λόγω του χρόνιου βλεννογονικού τραυματισμού. Η μακροχρόνια παραμονή του ορθού έξω από το πρωκτικό κανάλι συνεπάγεται την εξέλκωση του βλεννογόνου του και την εμφάνιση αιμορραγίας. Ο χρόνιος τραυματισμός της κορυφής του προπίπτοντος ορθού στην εσωτερική πλευρά του πρωκτικού δακτυλίου μπορεί να οδηγήσει στην ανάπτυξη μονήρους έλκους του ορθού (solitary rectal ulcer syndrome, SRUS) ή της πιο εκτεταμένης ιστολογικής παραλλαγής του, της εν τω βάθει κυστικής κολίτιδας (colitis cystica profunda, CCP).
Αντικειμενική εξέταση
Κατά την αρχική εξέταση του ασθενούς, η πρόπτωση είναι συχνά αναταγμένη. Ζητιέται από τον ασθενή να λάβει θέση καθιστή και να καταβάλει προσπάθεια εξώθησης, όπως επί αφόδευσης. Το προπίπτον ορθό εύκολα διακρίνεται με τη βοήθεια ενός αρθρωτού καθρέπτη, που τοποθετείται μερικά εκατοστά κάτω από τον πρωκτό του (έμμεση πρωκτική επισκόπηση). Η δακτυλική εξέταση δεν προκαλεί καθόλου από τη συνήθη δυσανασχέτηση στον ασθενή, ενώ η διαπιστούμενη, ψηλαφητικά, υποτονία των σφιγκτήρων είναι χαρακτηριστική. Η σιγμοειδοσκόπηση με άκαμπτο ή εύκαμπτο όργανο, η οποία, σωστό είναι, να συμπληρώνει την αρχική κλινική εξέταση, αποκαλύπτει, συχνά τον εξέρυθρο βλεννογόνο του προσθίου τοιχώματος του ορθού, που μπορεί να φέρει φλεγμονώδεις ή, ακόμη και κοκκιωματώδεις αλλοιώσεις, αλλά και αποκλείει τη συνύπαρξη ενός εγγύς ευρισκόμενου καρκινώματος ορθοσιγμοειδούς (συχνότητα: 5,7%).
Διαφορική διάγνωση
Η ολική πρόπτωση του ορθού πρέπει να διακρίνεται σαφώς από την ατελή βλεννογονική πρόπτωση. Η τελευταία έχει διαφορετική παθογένεια, ανάλογη της αιμορροϊδικής νόσου, και αντιμετωπίζεται όπως οι αιμορροϊδικοί όζοι με πρόπτωση. Οφείλεται στη χαλάρωση του υποστηρίζοντος συνδετικού ιστού ανάμεσα στην υποβλεννογόνια μυϊκή στιβάδα (muscularis mucosae) και στον καθαυτό μυϊκό χιτώνα (muscularis propria) του ορθού. Έτσι, ενώ στην πλήρη πρόπτωση συμμετέχουν όλες οι στιβάδες του τοιχώματος του ορθού, η βλεννογονική πρόπτωση ορίζεται από την προβολή μόνο του ορθικού βλεννογόνου και του υποβλεννογονίου.
Η αντικειμενική εξέταση βοηθά σημαντικά στο διαχωρισμό των διαφορετικών αυτών οντοτήτων. Οι ομόκεντρες πτυχές του προπίπτοντος ορθού στην ολική πρόπτωση διαφοροδιαγνώσκονται, επισκοπικά, εύκολα από τις ακτινωτές πτυχές της βλεννογονικής πρόπτωσης. Το πρωκτικό άνοιγμα παραμένει στην ανατομική θέση του στην πρώτη, με αποτέλεσμα την ψηλάφηση αύλακας (sulcus) μεταξύ του πρωκτού και του προπίπτοντος εντέρου, στοιχείο που δεν απαντάται στη βλεννογονική πρόπτωση, όπου το πρωκτόδερμα προβάλλει με την πρόπτωση του υπερκείμενου βλεννογόνου. Επιπλέον, πρέπει να γίνεται διάκριση της πρόπτωσης από ευμεγέθη πολύποδα, υποβλεννογόνιο λίπωμα ή κακοήθη νεοπλασία της περιοχής, ιδιαίτερα εάν συνυπάρχει μονήρες έλκος του ορθού.
Παρακλινικός και προεγχειρητικός έλεγχος
Όλοι οι ασθενείς πρέπει να υποβάλλονται σε πλήρη κολοσκοπικό έλεγχο, για τον αποκλεισμό άλλης παθολογίας στο εγγύς παχύ έντερο, ιδιαίτερα δε κάποιας κακοήθειας, η οποία και μπορεί να αποτελεί το οδηγό σημείο του εντερικού εγκολεασμού, που οδηγεί στην πρόπτωση. Ο βαριούχος υποκλυσμός μπορεί να αναδείξει ανατομικές ιδιομορφίες, όπως την παρουσία ενός πλεονάζοντος σιγμοειδούς, το οποίο μπορεί να χρειαστεί να εκταμεί κατά τη χειρουργική διόρθωση που θα ακολουθήσει.
Η αφοδευσιογραφία είναι ιδιαίτερα χρήσιμη στα αρχικά στάδια της πρόπτωσης, οπότε η τελευταία χρειάζεται να διακριθεί από τη βλεννογονικού τύπου πρόπτωση. Η σκιαγράφηση και των δύο όψεων του ορθού, ιδιαίτερα σε πρόσθιο-οπίσθια λήψη, κατά τη φάση της κένωσης του σκιαγραφικού, χαρακτηρίζουν την ολική πρόπτωση του ορθού. Επίσης, η απεικονιστική αυτή μέθοδος αποκλείει την παρουσία άλλων ανατομικών διαταραχών της περιοχής, που μπορεί να απαιτούν σύγχρονη χειρουργική διόρθωση (π.χ. περινεοκήλης, ορθοκήλης) καθώς και λειτουργικών ανωμαλιών, που μπορεί να αποτελούν αιτίες αποφρακτικής δυσκοιλιότητας (π.χ. παράδοξη σύσπαση του ηβοορθικού μυός) του ασθενούς. Στην τελευταία περίπτωση η διόρθωση της πρόπτωσης δεν θα οδηγήσει απαραίτητα και στη βελτίωση ή την εξάλειψη της δυσκοιλιότητας.
Η μέτρηση του χρόνου διάβασης του παχέος εντέρου με τη χρήση ακτινοσκιερών δισκίων (colonic transit study) αποκλείει την ταυτόχρονη με την πρόπτωση γενικευμένη δυσλειτουργία και αδράνεια του παχέος εντέρου (colonic inertia). Στην περίπτωση αυτή, τα ακτινοσκιερά δισκία (τα οποία φυσιολογικά απεκκρίνονται κατά το 80% το πολύ σε 5 ημέρες μετά τη λήψη τους) παραμένουν διάχυτα στα διάφορα τμήματα του παχέος εντέρου. Η ενδεδειγμένη θεραπεία είναι η υφολική κολεκτομή και η ειλεο-ορθική αναστόμωση για την αντιμετώπιση της κολονικής αδράνειας, με την προσθήκη ορθοπηξίας για τη διόρθωση της πρόπτωσης.
Η μανομετρία του πρωκτού και η δοκιμασία μέτρησης της καθυστέρησης (βραδύτητας ανταπόκρισης) μετά από ερεθισμό του αιδοιϊκού νεύρου (pudendal nerve terminal motor latency, PNTML) μπορούν να αποβούν χρήσιμες στις περιπτώσεις βαριάς ακράτειας. Σε σοβαρή σφιγκτηριακή δυσλειτουργία, όπως αυτή μπορεί να ανακύψει από τις δοκιμασίες αυτές, επεμβάσεις εκτεταμένης ορθοσιγμοειδεκτομής, οι οποίες, μάλλον επιδεινώνουν την ακράτεια, πρέπει να αποφεύγονται.
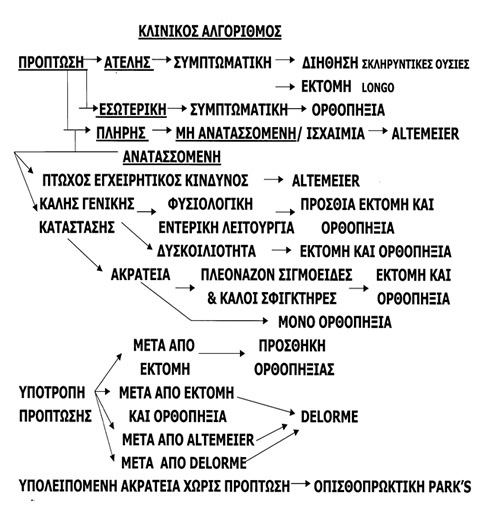
Επιλογή χειρουργικής μεθόδου
Οι κλασσικές χειρουργικές μέθοδοι αντιμετώπισης της πρόπτωσης του ορθού διακρίνονται σε διακοιλιακές επεμβάσεις (επεμβάσεις ορθοπηξίας, εκτομής ή συνδυασμού τους) και περινεϊκές. Τα τελευταία χρόνια, η καλοήθης φύση της νόσου επέτρεψε την εκτεταμένη χρησομοποίηση της λαπαροσκοπικής προσπέλασης στη διενέργεια των διακοιλιακών τεχνικών. Μια ποικιλία παραμέτρων συνεκτιμάται στην επιλογή της καταλληλότερης μεθόδου. Η ηλικία και το φύλο του ασθενούς, οι τυχόν συνυπάρχουσες νόσοι, η λειτουργία του υπολοίπου παχέος εντέρου και ο βαθμός της εγκράτειας πρέπει να λαμβάνονται σοβαρά υπόψιν πριν την τέλεση της χειρουργικής πράξης.
Οι διακοιλιακές επεμβάσεις, οι οποίες ενδείκνυνται απόλυτα σε νέους, υγιείς ασθενείς, με καλή ανοχή στη γενική αναισθησία, έχουν ταυτόχρονα το μειονέκτημα της αυξημένης βαρύτητας και, ως εκ τούτου, δεν γίνονται καλά ανεκτές από ηλικιωμένους, με συμπαρομαρτούντες νόσους, ασθενείς. Παρουσιάζουν, ωστόσο, σαφέστατα υψηλότερα ποσοστά ελέγχου της πρόπτωσης και καλύτερα λειτουργικά αποτελέσματα. Οι επεμβάσεις περινεϊκής προσπέλασης, αν και με υψηλότερα ποσοστά υποτροπής, αποτελούν την καταλληλότερη εναλλακτική για ασθενείς με σχετικά μειωμένο προσδόκιμο επιβίωσης, αφού μπορούν να διεκπαιρεωθούν υπό περιοχική ή επισκληρίδιο αναισθησία. Το κατδιοαναπνευστικό status των ασθενών πρέπει να μελετάται επιμελώς πριν από τη χρήση μιας λαπαροσκοπικής μεθόδου. Ασθενείς με χρόνια αποφρακτικά νοσήματα του πνεύμονα ή με σοβαρές καρδιακές αρρυθμίες πιθανά να έχουν δυσκολία στο να ανταπεξέλθουν τη συστηματική υπερκαπνία, που μπορεί να προκληθεί από ένα παρατεταμένης διάρκειας πνευμοπεριτόναιο με CO2. Eπειδή οι άνδρες με τη νόσο αυτή παρουσιάζονται σε νεότερες ηλικίες από ότι οι γυναίκες, προτοιμάται μια διακοιλιακή μέθοδος. Ο κίνδυνος, ωστόσο, βλάβης του προϊερού νευρικού πλέγματος και το ενδεχόμενο μελλοντικής στυτικής δυσλειτουργίας πρέπει να λαμβάνεται σοβαρά υπόψιν διεγχειρητικά. Για αυτό μερικές χειρουργικές ομάδες προτιμούν την περινεϊκή ορθοσιγμοειδεκτομή (Altemeier) σαν πρώτη επέμβαση στην ομάδα των νέων άρρενων ασθενών και, σε περίπτωση υποτροπής, την προσθήκη, με διακοιλιακή προσπέλαση, μιας ορθοπηξίας με ράμματα.
Η ακράτεια γενικά βελτιώνεται σε ποσοστό έως και 50-80% μετά τη χειρουργική διόρθωση της πρόπτωσης. Αν και η μανομετρία και οι λειτουργικές δοκιμασίες αρτιότητας των περινεϊκών νεύρων δεν μπορούν να προβλέψουν εύκολα τη μετεγχειρητική λειτουργική αποκατάσταση του σφιγκτηριακού μηχανισμού συνίσταται η αποφυγή εκτεταμένης εκτομής και η προτίμηση κάποιας από τις μεθόδους ορθοπηξίας στις περιπτώσεις με βαριά ακράτεια, με πολύ χαμηλές πιέσεις στη μανομετρία και με ιδιαίτερα υποτονικό σφιγκτήρα, εκτός κι αν συνυπάρχουν ανατομικές ιδιομορφίες που θα διορθωθούν χειρουργικά με την εκτομή (πλεονάζον σιγμοειδές). Η δυσκοιλιότητα, επίσης, βελτιώνεται, σε γενικές γραμμές, μετά τη χειρουργική επέμβαση. Παρ’ όλα αυτά, η επιμονή αποφρακτικού τύπου δυσκοιλιότητας και η ανάπτυξη, μετεγχειρητικά, μη προϋπάρχουσας δυσκοιλιότητας είναι πιθανές μετά από επεμβάσεις ορθοπηξίας με προσθετικό υλικό. Οι επεμβάσεις ορθοσιγμοειδεκτομής αποτελούν μεθόδους εκλογής σε ασθενείς με πρόπτωση και αποφρακτική δυσχεσία, εφόσον η παρουσία άλλης παθολογίας που να δικαιολογεί τη δυσκοιλιότητα (κολονική αδράνεια ή παράδοξη σύσπαση του ηβοορθικού μυός) έχει αποκλειστεί στον προεγχειρητικό έλεγχο.
Προεγχειρητικά, όλοι οι ασθενείς υποβάλλονται σε προετοιμασία του εντέρου με διαλύματα από το στόμα (π.χ. Fleet Phospha Soda) και με τοπικά δρώντα στον αυλό του εντέρου από του στόματος λαμβανόμενα αντιβιοτικά (ερυθρομυκίνη και νεομυκίνη).
Διακοιλιακές επεμβάσεις
Α. Επεμβάσεις ορθοπηξίας
Έως τις αρχές της δεκαετίας του 1990, η πρόσθια ορθοπηξία με πρόθεση, που αρχικά περιγράφηκε από τους Ripstein και Lanter και έγινε παγκόσμια γνωστή ως μέθοδος Ripstein, ήταν μια από τις πιο δημοφιλείς μεθόδους επισκευής της πρόπτωσης του ορθού. Βασίζεται στην αντίληψη ότι ο αρχικός εγκολεασμός, που οδηγεί και στη δημιουργία της πρόπτωσης οφείλεται στον ανατομικό ευθυασμό του ορθού, το οποίο έχει χάσει τη φυσιολογική καθήλωσή του στο ιερό. Έτσι, η μέθοδος αποσκοπούσε στην αποκατάσταση της οπίσθιας κυρτότητας του ορθού επί του ιερού, με τη βοήθεια υλικού που θα περιέβαλε δακτυλιωδώς το ορθό και θα το συγκρατούσε σταθερά επί της προϊεράς περιτονίας. Το πρώτο υλικό που χρησιμοποιήθηκε ήταν πλατεία περιτονία (fascia lata) από το μηρό. Αντικαταστάθηκε από προσθετικά πλέγματα (Teflon, Marlex, Gore-Tex).
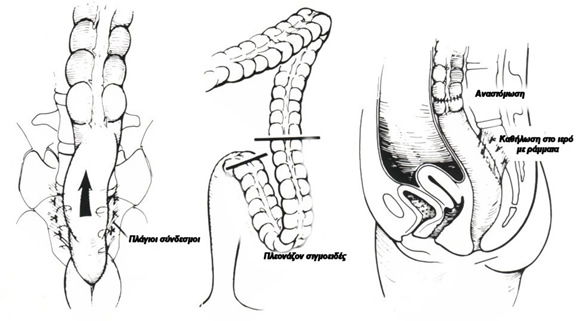
Tεχνική: Περιλαμβάνει: (1) την οπίσθια αμβλεία κινητοποίηση όλου του μήκους του ορθού έως το απώτερο άκρο του κόκκυγα, μετά τη διάνοιξη της οπίσθιας περιτοναϊκής ανάκαμψης και της διαίρεσης του ανώτερου τμήματος των πλαγίων συνδέσμων, (2) την τοποθέτηση πλέγματος πλάτους 5 εκ. γύρω από το ορθό και σε απόσταση 5 εκ. κάτω από την ιερά ακρολοφία (ακρωτήριο των μαιευτήρων), (3) τη συγκράτηση του πλέγματος με μη απορροφήσιμα ράμματα επί του ιερού 1 εκ. από τη μέση γραμμή, με προσοχή να μην τρωθούν τα αγγεία του προϊερού πλέγματος, (4) τη σταθεροποίηση του πλέγματος στο τοίχωμα του ορθού με ράμματα, κατά τρόπο ώστε να είναι δυνατή η δίοδος δύο δακτύλων μεταξύ του ορθού και του ιερού και (5) τη σύγκλειση του ελλείματος του περιτοναίου της πυέλου, προκειμένου τον ενταφιασμό του συνθετικού υλικού εντός της πυέλου και την αποφυγή της επαφής του με τις ενδοπεριτοναϊκά ευρισκόμενες έλικες του λεπτού εντέρου.
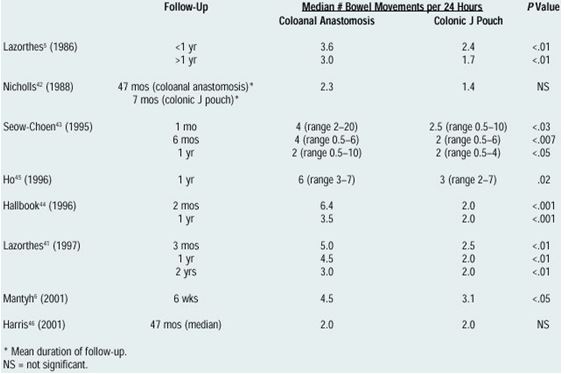
Αποτελέσματα: Λειτουργικά, σε μια σειρά ασθενών από τη Cleveland Clinic, η ακράτεια βελτιώθηκε στους μισούς περίπου από τους ασθενείς, αλλά η δυσκοιλιότητα επέμεινε στο 57% (σε αντίθεση με τις επεμβάσεις ορθοπηξίας που συνοδεύονταν από εκτομή (ορθο-)σιγμοειδούς, όπου το ποσοστό ήταν 17%), ενώ σε ένα ποσοσοστό 17% αναπτύχθηκε δυσκοιλιότητα που δεν υπήρχε προεγχειρητικά (λόγω σύγκαμψης του ορθού κεντρικά της ορθοπηξίας) (Tjandra και συν, 1993). Η επέμβαση έχει σχετικά χαμηλό ποσοστό υποτροπών (μέσος όρος< 5% στις διάφορες βιβλιογραφικές σειρές). Οι τελευταίες οφείλονται σε ανεπαρκή στήριξη του πλέγματος ή ατελή οπίσθια κινητοποίηση του ορθού, που οδηγεί στην παραμονή προπίπτοντος ορθού πέραν του σημείου καθήλωσης του. Υπάρχει ένα υπολογίσιμο ποσοστό επιπλοκών, το οποίο, στα ιδρύματα, όπου η μέθοδος χρησιμοποιήθηκε ευρέως τις δεκαετίες 1970-1980 ανέρχεται σε 26% (Cleveland Clinic) έως και 52% (Lahey Clinic). Μάλιστα σε μια μελέτη που έγινε με τη συμμετοχή πολλών μελών του American Society of Colon & Rectal Surgeons, η οποία συμπεριέλαβε 1111 ασθενείς, επιπλοκές, όπως ενσφήνωση κοπράνων και κοπρόσταση (6,7%), προϊερά αιμορραγία (2,6%), πυελικό απόστημα (2%) και άλλες ανήλθαν σε συνολικό ποσοστό 16,6%. Επανεγχείρηση απαιτήθηκε στο 5% των ασθενών και συνίστατο, εκτός των άλλων, σε πλάγια διατομή του πλέγματος για την απελευθέρωση του στενωμένου ορθού, αφαίρεση του πλέγματος (η οποία, σημειωτέον, αποτελεί εργώδη επέμβαση) με παροχέτευση της πυέλου και τελική κολοστομία, στις περιπτώσεις πυελικών σηπτικών επιπλοκών καθώς και λύση συμφυτικού ειλεού από τη συγκόλληση του λεπτού εντέρου επί του συνθετικού πλέγματος.
Εναλλακτικά προτάθηκε και, μάλιστα χρησιμοποιήθηκε ευρέως στη Μ. Βρεττανία, η οπίσθια ορθοπηξία με πρόθεση (μέθοδος Wells), προκειμένου την αποφυγή της περικύκλωσης του ορθού από το ξένο υλικό. Στην τεχνική αυτή η πρόθεση περιβάλλει το ορθό μερικώς, βοηθώντας σημαντικά στη διατήρηση της ευενδοτότητας του και την αποφυγή των στενωτικών επιπλοκών. Η χρήση του εμβαλώματος από πολυβινυλική αλκοόλη (σπόγγος Ivalon) αντικαταστάθηκε από άλλους χειρουργούς (και από τον ίδιο τον Ripstein, o οποίος τροποποίησε την τεχνική του και τη μετέτρεψε σε οπίσθια μόνο ορθοπηξία- τροποποιημένη τεχνική Ripstein) με άλλα συνθετικά πλέγματα, όπως το Marlex, και, ακόμη και με απορροφήσιμα υλικά, όπως τα Vicryl και Dexon (για την ελαχιστοποίηση των σηπτικών υλικών).
Τεχνική: Μετά την είσοδο στον προϊερό χώρο και την κινητοποίηση του ορθού, με διατήρηση, πάντα, των προϊερών πλεγμάτων, το εμβάλωμα καθηλώνεται στο ιερό και, στη συνέχεια περιβάλλει τα 2/3- ? του ορθού, με τα πλάγια άκρα του να προσδένονται στην πρόσθια όψη του ορθικού τοιχώματος, το οποίο παραμένει ακάλυπτο.
Αποτελέσματα: Η κοπρόσταση και οι στενώσεις του ορθού είναι σημαντικά λιγότερο συχνές από ότι με την Ripstein. H εμφάνιση πυελικών αποστημάτων αποτέλεσε συχνή επιπλοκή σε αρκετές σειρές, όπως σε αυτή του Goligher και συν, στην οποία η επίπτωση τους ανήλθε στο 16%. Η υποτροπή της πρόπτωσης δεν ξεπερνά το 10% και συχνά λαμβάνει τη μορφή βλεννογονικής πρόπτωσης (οι μισές από αυτές ανταποκρίνονται καλά σε υποβλεννογόνιο διήθηση με 5% φαινόλη). Αν και σε περιπτώσεις ακράτειας η λειτουργικότητα αποκαθίσταται σε 50-80% των ασθενών με πρόβλημα, η δυσκοιλιότητα εξακολουθεί να αποτελεί, συχνά, μετεγχειρητικό ενόχλημα. Η συχνότητα της τελευταίας, μάλιστα, σχεδόν διπλασιάζεται (από 24-30% προεγχειρητικά σε 44-50% μετεγχειρητικά).
Πολλές χειρουργικές ομάδες χρησιμοποιούν με επιτυχία την ορθοπηξία χωρίς πρόθεση. Η οπίσθια ανάρτηση του ορθού με μη απορροφήσιμα ράμματα (Prolene) αποτελεί επαρκή θεραπεία για την πρόπτωση, χωρίς δυσμενή επίδραση στα ποσοστά υποτροπών και με καλά λειτουργικά αποτελέσματα (Εικόνα 5), ενώ, ταυτόχρονα, αποφεύγονται τα δυσάρεστα σηπτικά συμβάματα στην πύελο, από την τοποθέτηση των πλεγμάτων. Στην προοπτική τυχαιοποιημένη μελέτη του Νovell και συν (1994) τα ποσοστά υποτροπών και λειτουργικής βελτίωσης ήταν συγκρίσιμα μεταξύ της ορθοπηξίας με Ivalon και ραμμάτων, ενώ οι σηπτικές επιπλοκές ήταν συχνότερες με το πρώτο.
Β. Επεμβάσεις εκτομής- ορθοπηξίας
Η σιγμοειδεκτομή σε συνδυασμό με την ορθοπηξία με ράμματα, που άρχισε να χρησιμοποιείται στο Πανεπιστήμιο της Minessota (1955) και είναι γνωστή ως τεχνική Golgberg- Frykman, αποτέλεσε τη βάση των χειρουργικών αρχών που διέπουν πολλές από τις σύγχρονες αποδεκτές διακοιλιακές και λαπαροσκοπικές χειρουργικές επεμβάσεις για την πρόπτωση.
Τεχνική: Τα στάδια της επέμβασης περιλαμβάνουν: (1) την κινητοποίηση του ορθού οπισθίως έως το πυελικό έδαφος, με διατήρηση των άνω αιμορροϊδικών αγγείων και των πλαγίων συνδέσμων του ορθού (η πρόσθια κινητοποίηση δεν είναι συχνά αναγκαία, λόγω του ιδιαίτερα βαθύ χώρου του Douglas, ο οποίος καθιστά το πρόσθιο τοίχωμα του ορθού αρκετά ευκίνητο, ενώ με τη μη διάνοιξη της πρόσθιας περιτοναϊκής ανάκαμψης διαχωρίζεται μερικώς τουλάχιστον η κολο-ορθική αναστόμωση από την πυελική κοιλότητα), (2) την υψηλή ανάρτηση του ορθού με καθήλωση των πλαγίων συνδέσμων στο περιόστεο του ιερού με μη απορροφήσιμα ράμματα, (3) την πρόσθια σύγκλειση της πρόσθιας ενδοπυελικής περιτονίας- πρόσθιας περιτοναϊκής ανάκαμψης (αν αυτή χρειάστηκε να διανοιγεί) η οποία επιτυγχάνει και την κατάργηση του χώρου του Douglas και (4) την εκτομή του πλεονάζοντος σιγμοειδούς και τη δημιουργία τελικο-τελικής κολο-ορθικής αναστόμωσης.
Αποτελέσματα: Η δυσκοιλιότητα και η ακράτεια βελτιώνονται σε ποσοστά περίπου 50- 60% η καθεμιά, ενώ έως και 30% των ασθενών με ακράτεια παρουσιάζουν λειτουργική επιδείνωση μετεγχειρητικά.
Υπάρχει η τάση, σήμερα, επέκτασης της εκτομής προς το ανώτερο ορθό με προσπάθεια διατήρησης της άνω αιμορροϊδικής αρτηρίας (για καλύτερη αιμάτωση της κολο-ορθικής ανστόμωσης) και δημιουργία της αναστόμωσης στο περιβαλλόμενο πρόσθιο-πλάγια από ορογόνο (σπλαγχνικό περιτόναιο) ανώτερο ορθό, με αποτέλεσμα την τέλεση ορθοσιγμοειδεκτομής ή (υψηλής) πρόσθιας εκτομής. Με αυτόν τον τρόπο αφαιρείται το σημείο της έναρξης της πρόπτωσης (που βρίσκεται στο ανώτερο ορθό), αποφεύγεται η σύγκαμψη του ορθού επί του κατώτερου τμήματος του μετεγχειρητικά, εκτέμνεται πρόσθετο έντερο από το ορθό που μπορεί να πλεονάζει και επικουρείται η επαναφορά της ανατομικά σωστής θέσης του ορθού σε οπίσθια επαφή με το ιερό.
Οι περισσότεροι επίσης συμφωνούν ότι η διατομή των πλαγίων συνδέσμων, οι οποίοι φέρουν κλάδους του πυελικού παρασυμπαθητικού πλέγματος, υπεύθυνους για την ευενδοτότητα και τη ρύθμιση της χωρητικότητας του ορθού πρέπει να αποφεύγεται.
Οι υποστηρικτές της αναγκαιότητας της εκτομής στην πλειονότητα των περιπτώσεων πρόπτωσης τονίζουν ως επιπρόσθετο πλεονέκτημα το γεγονός ότι η εκτομή του πλεονάζοντος τμήματος του παχέος εντέρου οδηγεί σε ένα βραχύτερο αριστερό κόλον που συγκρατείται εγγύς σταθερά από το φρενοκολικό σύνδεσμο. Έτσι, ακόμη κι αν οι άλλοι προδιαθεσικοί μηχανικοί παράγοντες επανέλθουν (βαθύς χώρος του Douglas, ρήξη της ορθοπηξίας), το ορθό δεν θα μπορεί να ξανακατέλθει, επειδή θα συγκρατείται από το ευθύ, βραχύ αριστερό κόλον.
Γ. Επεμβάσεις εκτομής
Πολλά από τα πλεονεκτήματα και τις αρχές των επεμβάσεων εκτομής για την πρόπτωση του ορθού αναλύθηκαν παραπάνω. Μια από τις περισσότερο χρησιμοποιημένες επεμβάσεις για τη διόρθωση της πρόπτωσης, η, οικεία σε πολλούς χειρουργούς, χαμηλή πρόσθια εκτομή, ξεκίνησε με τη χειρουργική σχολή της Mayo Clinic και τον Muir (1955). Οι θιασώτες της υποστήριξαν ότι η προσθήκη κάποιας μορφής ορθοπηξίας δεν είναι αναγκαία, διότι η ινώδης αντίδραση που δημιουργείται μετεγχειρητικά στην πύελο, μεταξύ της αναστομωτικής γραμμής και του ιερού, είναι αρκετή να συγκρατεί το έντερο και να αποκλείει την υποτροπή της πρόπτωσης. Μετά από μια σημαντική συγκριτική κλινική μελέτη από τους Schlinkert και συν (1985) που έδειξε τη σημαντικά υψηλότερη συχνότητα επιπλοκών (του τύπου κυρίως των αναστομωτικών διαφυγών) μετά από χαμηλές πρόσθιες εκτομές σε σχέση με τις (υψηλές) πρόσθιες εκτομές (19%), χωρίς να επηρεάζονται τα λειτουργικά αποτελέσματα και η επίπτωση των υποτροπών, οι χαμηλές πρόσθιες εκτομές, ως επί το πλείστον, εγκαταλείφθηκαν και η Mayo Clinic όρισε την πρόσθια εκτομή ως μέθοδο εκλογής.
Περινεϊκές επεμβάσεις
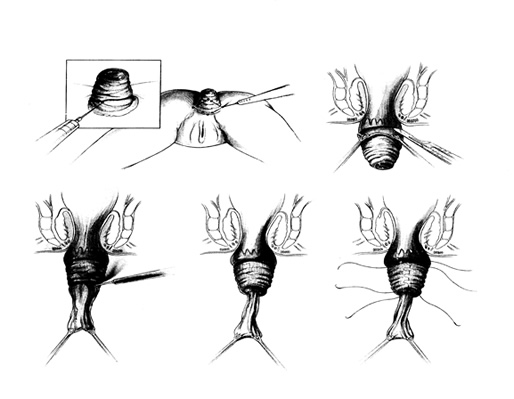
Α. Περινεϊκή ορθοσιγμοειδεκτομή (τεχνική Altemeier)
Η μέθοδος αυτή, αν και περιγράφηκε αρχικά από τον Miculicz (1889) και χρησιμοποιήθηκε ευρέως στη Μ. Βρεττανία από τον Miles (1933), σήμερα συστήνεται στους ηλικιωμένους ασθενείς με περιορισμένη ανοχή στη γενική αναισθησία και, ίσως, σε νεαρούς άνδρες με ιδιαίτερη ανησυχία για το μετεγχειρητικό ενδεχόμενο στυτικής δυσλειτουργίας, μετά από μια διακοιλιακή επέμβαση.
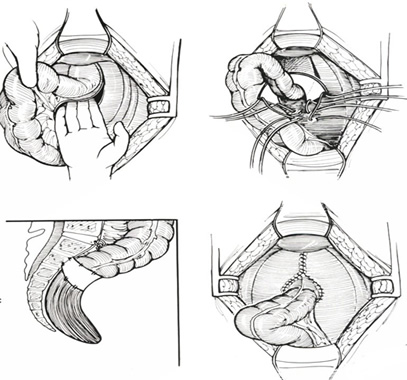
Τεχνική: Υπό περιοχική αναισθησία, ο ασθενής τοποθετείται σε γυναικολογική ή σε πρηνή θέση «σουγιά», και σε ήπια κλίση Trendelenburg, για την ελάττωση της διεγχειρητικής αιμορραγίας και για την απώθηση του λεπτού εντέρου μακρυά από την πύελο. Μια κυκλοτερής τομή λαμβάνει χώρα διά όλων των χιτώνων του προπίπτοντος ορθού, 1,5 εκ. ή 2,5 εκ. πάνω από την οδοντωτή γραμμή, ανάλογα με το αν η αναστόμωση γίνει με το χέρι ή με τη χρήση κυκλικού αναστομωτήρα, αντίστοιχα. Ο προβάλλων περιτοναϊκός σάκκος διανοίγεται και τα σιγμοειδικά αγγεία απολινώνονται και διατέμνονται. Μετά τη διάνοιξη του εγγύς εντερικού αυλού και την τοποθέτηση οδηγών ραμμάτων, το πλεονάζον ορθοσιγμοειδές εκτέμνεται προοδευτικά με ταυτόχρονη τοποθέτηση ολικού πάχους απορροφήσιμων ραμμάτων μεταξύ του εντέρου και του πρωκτικού αυλού. Η κολο-πρωκτική αναστόμωση μπορεί να εκτελεστεί και μηχανικά με τη χρήση κυκλικού αναστομωτήρα, μετά την τοποθέτηση purse-string ραμμάτων στο έντερο και στον πρωκτικό βλεννογόνο για την υποδοχή της κεφαλής και του στυλεού του αναστομωτήρα. Για την επίτευξη καλύτερων αποτελεσμάτων, όσον αφορά την ακράτεια, πολλοί συνιστούν την ταυτόχρονη διενέργεια σφιγκτηροπλαστικής ανελκτήρα, με τη συρραφή και σύσφιγξη του ανελκτήρα προσθίως της ορθοπρωκτικής γωνίας και του ηβοορθικού και του έξω σφιγκτήρα οπισθίως.
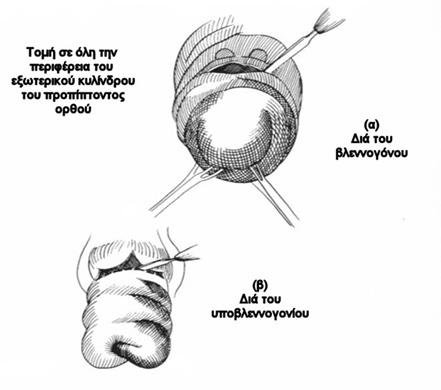
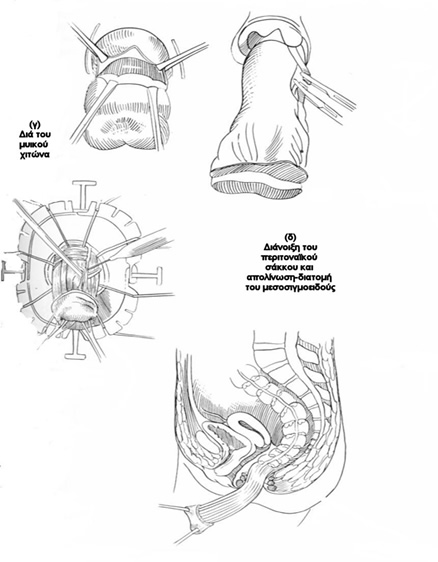
Αποτελέσματα: Οι περισσότερες επιπλοκές (περίπου 10%), που αφορούν κυρίως αναστομωτικές διαφυγές, μετεγχειρητική αιμορραγία και αναστομωτική στένωση αντιμετωπίζονται συνήθως με τοπικά μέτρα (τοπική παροχέτευση, διαστολές).
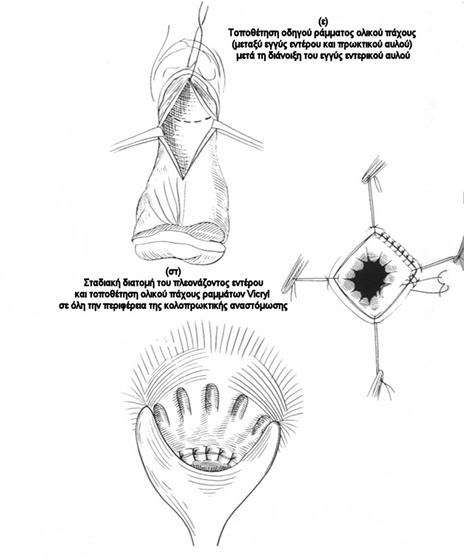
Β. Βλεννογονική εκτομή και πτύχωση του μυϊκού χιτώνα του ορθού (τεχνική Delorme)
Συνίσταται σε: (1) υποβλεννογόνια διήθηση με διάλυμα επινεφρίνης, (2) διαχωρισμό του βλεννογόνου από την υποκείμενη μυϊκή στιβάδα, (3) κυκλοτερή εκτομή του βλεννογόνου, (4) αναδίπλωση του μυϊκού στρώματος του ορθού με απορροφήσιμα ράμματα, δίκην ακορντεόν και (5) τη δημιουργία ορθοβλεννογονο-πρωκτικής αναστόμωσης.
Αποτελέσματα: Αν και τα λειτουργικά αποτελέσματα είναι από ικανοποιητικά έως και άριστα στο μεγαλύτερο ποσοστό των ασθενών, τα ποσοστά υποτροπής κυμαίνονται από 10- 25%.
Γ. Περιβρογχισμός του πρωκτού (τεχνική Thiersch)
Αυτή η πολύ σπάνια χρησιμοποιούμενη τεχνική σήμερα, μπορεί να έχει θέση σε ιδιαίτερα καταβεβλημένους ασθενείς με ελάχιστο προσδόκιμο επιβίωσης και συνίσταται σε περιβρογχισμό του πρωκτού με κάποιο συνθετικό υλικό. Το ποσοστό υποτροπών (40%) και των διαφόρων επιπλοκών, όπως κοπρόσταση (25%), λοιμώξεις (6- 33%), διαβρώσεις, διασπάσεις (7- 33%), ορθοκολπικά συρίγγια, γάγγραινα περινέου, κ.ά. είναι υψηλά.
Λαπαροσκοπική τεχνική
Όπως συνέβη με τις καλοήθεις παθήσεις του παχέος εντέρου και, πρόσφατα, ακόμη και με τις κακοήθειες του, η λαπαροσκοπική προσπέλαση κέρδισε έδαφος, τα τελευταία χρόνια, στην αντιμετώπιση της πρόπτωσης του ορθού. Το μικρότερο χειρουργικό τραύμα, η ελάττωση του μετεγχειρητικού άλγους, η επίσπευση της ανάρρωσης και το άριστο κοσμητικό αποτέλεσμα αποτελούν προφανή πλεονεκτήματα της τεχνικής. Η πλέον χρησιμοποιούμενη λαπαροσκοπική μέθοδος είναι η ορθοσιγμοειδεκτομή, συνήθως με την προσθήκη οπίσθιας ορθοπηξίας με ράμματα, ενώ για τις περιπτώσεις βαριάς ακράτειας και, ιδιαίτερα, όταν ο κίνδυνος μιας αναστομωτικής διαφυγής υπερβαίνει τον πιθανό κίνδυνο από την τοποθέτηση συνθετικού υλικού, οι υποστηρικτές του πλέγματος χρησιμοποιούν τη λαπαροσκοπική τροποποιημένη Ripstein οπίσθια ορθοπηξία με Marlex.
Tεχνική: Ο ασθενής τοποθετείται σε τροποποιημένη γυναικολογική θέση Lloyd- Davis 30?, με τους μηρούς και τα γόνατα ελαφρά κεκαμμένα και το δεξιό άνω άκρο σε επαφή κατά μήκος του κορμού. Το λαπαροσκόπιο πλαγίας οράσεως (30? ή 45?) εισάγεται από ένα 10 mm υπερ- ή υπο-ομφάλιο κανάλι εργασίας (ανάλογα με το σωματότυπο του ασθενούς). Τα trocars της δεξιάς κοιλιακής χώρας είναι τα κανάλια εργασίας και το 12 mm του δεξιού λαγονίου βόθρου χρησιμοποιείται για τη δίοδο του λαπαροσκοπικού ευθύγραμμου κοπτορράπτη. Το κανάλι της αριστερής μεσοκλειδικής γραμμής χρησιμοποιείται από τον 2ο χειρουργό για την έλξη του ορθοσιγμοειδούς. Ο χειρουργός και ο 1ος βοηθός- χειριστής λαπαροσκοπίου στέκονται στην αριστερή πλευρά του ασθενούς. Μετά την εγκατάσταση πνευμοπεριτοναίου με CO2 (έως 15 mmHg), οι έλικες του λεπτού εντέρου απομακρύνονται προς το δεξιό υποχόνδριο και το ορθοσιγμοειδές έλκεται προς τη μέση γραμμή. Αυτό παρασκευάζεται και κινητοποιείται πλήρως με διατομή του πλαγίου τοιχωματικού περιτοναίου της αριστερής παρακολικής αύλακας και με τη διάνοιξη της οπίσθιας περιτοναίκής ανάκαμψης. Τα σιγμοειδικά αγγεία απολινώνονται, η άνω αιμορροϊδική αρτηρία διατηρείται και το μεσοορθό παρασκευάζεται οπισθίως μέχρι και τη διάνοιξη της προϊεράς περιτονίας Waldeyer για την αποκάλυψη της πυελικής επιφάνειας των ανελκτήρων. Το ανώτερο ορθό διατέμνεται με τη βοήθεια του λαπαροσκοπικού ευθύγραμμου κοπτορράπτη, το ορθοσιγμοειδές εξωτερικεύεται μέσα από την υπερηβική τομή, που έχει διευρυνθεί, εκτέμνεται έξω από την κοιλιά, εισάγεται η κεφαλή του κυκλικού αναστομωτήρα εντός του κεντρικού κολοβώματος, το τελευταίο επανεισάγεται στην περιτοναϊκή κοιλότητα, το πνευμοπεριτόναιο επανεγκαθίσταται και, υπό λαπαροσκοπική όραση, εκτελείται η τελικο-τελική κολο-ορθική αναστόμωση μετά τη διαπρωκτική τοποθέτηση του στυλεού του κυκλικού αναστομωτήρα. Η οπίσθια ορθοπηξία με ράμματα συμπληρώνει την επέμβαση με την καθήλωση του ορθού με μη απορροφήσιμα ράμματα από τους πλάγιους παραορθικούς ιστούς- πλαγίους συνδέσμους άπω της αναστόμωσης επί της προϊεράς περιτονίας κάτω από το ακρωτήριο των μαιευτήρων.
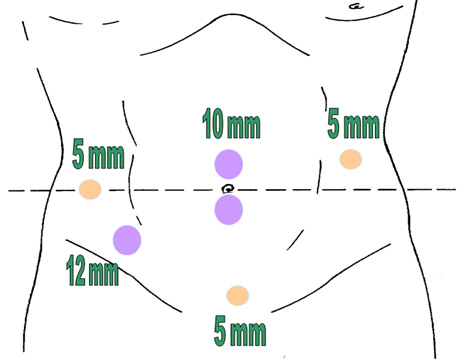
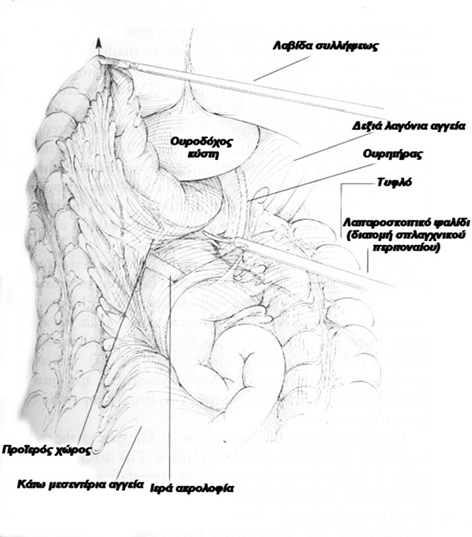
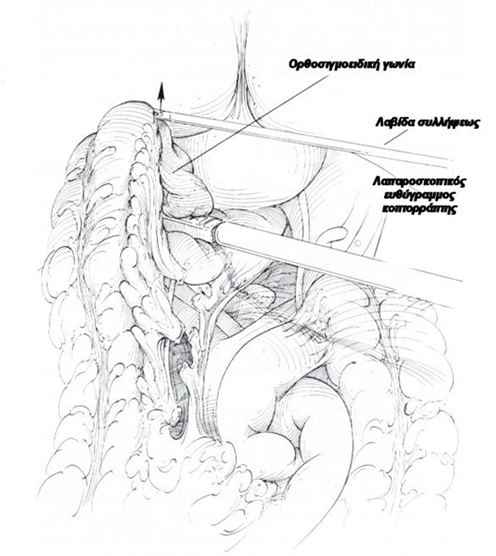
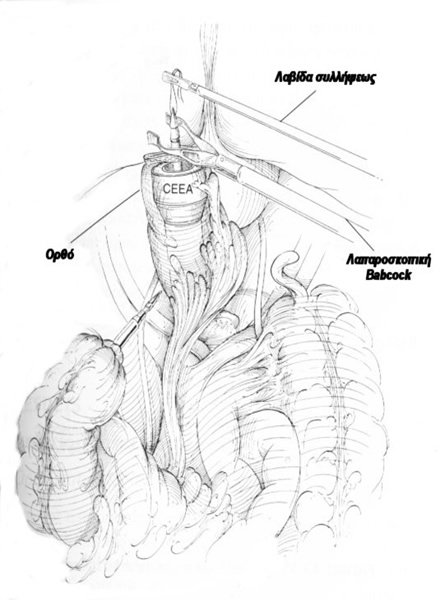
Αποτελέσματα: Είναι απόλυτα ικανοποιητικά μετά από λαπαροσκοπικές επεμβάσεις. Η ασφάλεια και αποτελεσματικότητα των λαπαροσκοπικών τεχνικών σε σχέση με τις ανοικτές για την αντιμετώπιση της πρόπτωσης έχουν επαληθευθεί σε πολλαπλές συγκριτικές μελέτες.
Αντιμετώπιση μετεγχειρητικής ακράτειας- υποτροπών πρόπτωσης του ορθού
Αν και η λειτουργική κατάσταση των σφιγκτήρων βελτιώνεται τόσο μανομετρικά όσο και κλινικά μετά τη χειρουργική επισκευή της πρόπτωσης, η ακράτεια μπορεί βασανίζει 20- 40% των ασθενών μετεγχειρητικά. Χρονικό διάστημα υπομονής 6-12 μηνών συστήνεται πριν τη λήψη επεμβατικών μέτρων, διότι η νευραπραξία των περινεϊκών νεύρων υφίεται σε ένα ποσοστό κατά το διάστημα αυτό. Οι διαιτητικοί χειρισμοί, η χορήγηση αντιδιαρροϊκών, του τύπου της λοπεραμίδης, και η βιοανατροφοδότηση (biofeedback) για την επανεκμάθηση της ορθοπρωκτικής λειτουργίας, μπορεί να αποβούν χρήσιμα στην ανάληψη ικανοποιητικής εγκράτειας. Αν τα μέτρα αυτά αποτύχουν, ενδείκνυται η διενέργεια οπίσθιας σφιγκτηροπλαστικής κατά Parks.
Εάν η πρόπτωση υποτροπιάσει μετά από διακοιλιακή επέμβαση εκτομής απαιτείται η προσθήκη ορθοπηξίας με ράμματα. Μετά από εκτομή και ορθοπηξία η υποτροπή αντιμετώπιζεται καλύτερα με μια περινεϊκή επέμβαση, κατά προτίμηση τη Delorme (η περινεϊκή ορθοσιγμοειδεκτομή μπορεί να αποβεί παρακινδυνευμένη, αφού η επανεκτομή που απαιτείται μπορεί να είναι τεχνικά δύσκολη λόγω της ίνωσης της πυέλου από την προηγούμενη εκτομή και η νέα αναστόμωση που θα απαιτηθεί μπορεί να έχει ελαττωμένη αιμάτωση). Μετά από μια περινεϊκή επέμβαση, η εκτέλεση της Delorme για την υποτροπή είναι επίσης η ενδεικνυόμενη.
Αντιμετώπισης της περίσφιγξης της πρόπτωσης
Στην επείγουσα περίσταση μιας μη ανατασσόμενης, αυτόματα, πρόπτωσης πρέπει να γίνονται οι απαραίτητοι χειρισμοί για την επαναφορά της εντός του ορθού. Η περιπρωκτική διήθηση με τοπικό αναισθητικό, η τοποθέτηση ζάχαρης επί του ορθικού βλεννογόνου για την ελάττωση του οιδήματος, η εφαρμογή πάγου ή κρύων επιθεμάτων και η διήθηση με υαλουρονιδάση μπορεί να αποβούν επιβοηθητικά. Εάν όμως υπάρχουσες αλλοιώσεις του βλεννογόνου εγείρουν έντονα την υποψία εγκατάστασης ήδη ισχαιμίας, η εκτέλεση επείγουσας περινεϊκής ορθοσιγμοειδεκτομής έχει απόλυτη ένδειξη.
Βιβλιογραφία
1.Broden B, Snellman B. Procidentia of the rectum studied with cineradiography. A contribution to the discussion of causative mechanism. Dis Colon Rectum. 1968 Sep-Oct;11(5):330-47.
2.Spencer RJ. Manometric studies in rectal prolapse. Dis Colon Rectum. 1984 Aug;27(8):523-5.
3.Altemeier WA, Culbertson WR, Schowengerdt C, Hunt J. Nineteen years' experience with the one-stage perineal repair of rectal prolapse. Ann Surg. 1971 Jun;173(6):993-1006.
4.Kupfer CA, Goligher JC. One hundred consecutive cases of complete prolapse of the rectum treated by operation. Br J Surg. 1970 Jul;57(7):482-7.
5.McMahan JD, Ripstein CB. Rectal prolapse. An update on the rectal sling procedure. Am Surg. 1987 Jan;53(1):37-40.
6.Ripstein CB. Procidentia: definitive corrective surgery. Dis Colon Rectum. 1972 Sep-Oct;15(5):334-6.
7.Roberts PL, Schoetz DJ Jr, Coller JA, Veidenheimer MC. Ripstein procedure. Lahey Clinic experience: 1963-1985. Arch Surg. 1988 May;123(5):554-7.
8.Tjandra JJ, Fazio VW, Church JM, Milsom JW, Oakley JR, Lavery IC. Ripstein procedure is an effective treatment for rectal prolapse without constipation. Dis Colon Rectum. 1993 May;36(5):501-7.
9.Allen-Mersh TG, Turner MJ, Mann CV. Effect of abdominal Ivalon rectopexy on bowel habit and rectal wall. Dis Colon Rectum. 1990 Jul;33(7):550-3.
10.Yoshioka K, Heyen F, Keighley MR. Functional results after posterior abdominal rectopexy for rectal prolapse. Dis Colon Rectum. 1989 Oct;32(10):835-8.
11.Madoff RD, Williams JG, Wong WD, Rothenberger DA, Goldberg SM. Long-term functional results of colon resection and rectopexy for overt rectal prolapse. Am J Gastroenterol. 1992 Jan;87(1):101-4.
12.Schlinkert RT, Beart RW Jr, Wolff BG, Pemberton JH. Anterior resection for complete rectal prolapse. Dis Colon Rectum. 1985 Jun;28(6):409-12.
13.Baker R, Senagore AJ, Luchtefeld MA. Laparoscopic-assisted vs. open resection. Rectopexy offers excellent results. Dis Colon Rectum. 1995 Feb;38(2):199-201.
14.Kairaluoma MV, Viljakka MT, Kellokumpu IH. Open vs. laparoscopic surgery for rectal prolapse: a case-controlled study assessing short-term outcome. Dis Colon Rectum. 2003 Mar;46(3):353-60.
Ορισμός
Τo τοξικό μεγάκολο περιγράφει την οξεία κολίτιδα, η οποία συνοδεύεται από συστηματικές τοξικές εκδηλώσεις και απεικονιστικά ευρήματα τμηματικής ή καθολικής μη αποφρακτικής διάτασης (> 6 εκατοστά σε διάμετρο) του παχέος εντέρου. Στη σύγχρονη κλινική ορολογία, αρμόζει καλύτερα ο όρος «τοξική κολίτιδα», αφού πολλοί ασθενείς αναπτύσσουν τοξικότητα, χωρίς την παρουσία διάτασης. Το τοξικό μεγάκολο, το οποίο αρχικά αναγνωρίστηκε από τον Marshak το 1950, αποτελεί μια ασυνήθη, καταστροφική, δυνητικά θανατηφόρο επιπλοκή κολίτιδας η οποία παρουσιάζεται συνηθέστερα στα πλαίσια της ελκώδους κολίτιδας, αλλά, πρόσφατα συχνά και μετά πό σοβαρή προσβολή ψευδομεμβρανώδους κολίτιδας. Πρέπει δε να διαφοροποιείται από άλλες νοσολογικές οντότητες, κατά τις οποίες υπάρχει χαρακτηριστική κολονική μη τοξική διάταση, όπως η ψευδοπαράλυση Ogilvie’s και η νόσος Hirschsprung’s.
Παθολογική φυσιολογία
Αν και η ακριβής παθοφυσιολογία του τοξικού μεγακόλου δεν έχει διασαφηνιστεί πλήρως, πολλοί παράγοντες μπορεί να συμβάλουν στην ανάπτυξη του. Σημεία και συμπτώματα οξείας κολίτιδας μπορεί να είναι παρόντα για χρονικό διάστημα έως και μία εβδομάδα πριν από την ανάπτυξη της διάτασης. Ο προσδιορισμός εκλυτικών ή προδιαθεσικών παραγόντων είναι συχνά εφικτός. Ενώ ο κίνδυνος του τοξικού μεγακόλου αυξάνει με τη σοβαρότητα της κολίτιδας, η ταχεία απόσυρση ή η αιφνίδια διακοπή της φαρμακευτικής αγωγής (στεροειδή, σουλφασαλαζίνη, και 5-αμινοσαλικυλικό οξύ) μπορεί να προκαλέσει τοξιναιμία και κολονική διάταση. Φάρμακα που επιδρούν αρνητικά στην κινητικότητα επίσης εμπλέκονται στην ανάπτυξη τοξικού μεγακόλου. Αυτά περιλαμβάνουν αντιχολινεργικά, αντικαταθλιπτικά, loperamide, και οπιοειδή. Βαριούχος υποκλυσμός και ορθοσκόπηση ενδέχεται να προκαλέσουν διάταση, να επηρεάσουν την αιμάτωση του παχέος εντέρου ή να επιδεινώσουν μια μικροδιάτρηση με επόμενη την πρόκληση τοξιναιμίας.
Το χαρακτηριστικό γνώρισμα της μικροσκοπικής εικόνας στο τοξικό μεγάκολο είναι η επέκταση της φλεγμονής σε βαθύτερες του βλεννογόνου στιβάδες. Η πρόοδος της φλεγμονής στις λείες μυϊκές ίνες του τοιχώματος οδηγεί στην αύξηση της τοπικής παραγωγής μονοξειδίου του αζώτου (ΝΟ) από τα φλεγμονώδη κύτταρα της περιοχής, όπως τα ιστικά μακροφάγα και τα ουδετερόφιλα που έλκονται από την κυκλοφορία. Το ΝΟ έχει ανασταλτική δράση στις μυϊκές ίνες με αποτέλεσμα την κολονική διάταση, Οι Mourelle και συν απέδειξαν την παρουσία αυξημένων ποσοστών συνθετάσης του ΝΟ στην ιδίως μυϊκή στιβάδα του κόλου ασθενών με τοξικό μεγάκολο.
Επιδημιολογία
Η συχνότητα που αναφέρεται στην βιβλιογραφία του τοξικού μεγακόλου εξαρτάται από την αιτιολογία. Ο διά βίου κίνδυνος ανάπτυξης τοξικού μεγακόλου ως επιπλοκή της ελκώδους κολίτιδας έχει εκτιμηθεί ότι είναι 1-2.5%. Σε μία σειρά από 1936 ασθενών που εισήχθησαν στο νοσοκομείο σε διάστημα 19 ετών, η συχνότητα παρουσίας του τοξικού μεγακόλου ανήλθε σε 6%, και, συγκεκριμένα σε 10% των ασθενών με ελκώδη κολίτιδα και 2,3% αυτών με νόσο Crohn. Στα πλαίσια ψευδομεμβρανώδους κολίτιδας, τοξικό μεγάκολο παρουσιάζεται σε ποσοστό 0.4-3% των ασθενών. Ο αριθμός αυτός αναμένεται να αυξηθεί σε αναλογία με την αύξηση του επιπολασμού της ψευδομεμβρανώδους κολίτιδας. Αυτή η αυξανόμενη συχνότητα εμφάνισης φαίνεται να οφείλεται στην αυξημένη χρήση των αντιβιοτικών ευρέος φάσματος.
Τα ποσοτά θνησιμότητας για το τοξικό μεγάκολο έχουν βελτιωθεί σημαντικά κατά τη διάρκεια των τελευταίων δεκαετιών, από 20% το 1976 σε ποσοστό 4-5% σήμερα. Η μείωση είναι αποτέλεσμα της έγκαιρης αναγνώρισης, της εντατικής ιατρικής αντιμετώπισης, της πρώϊμης εμπλοκής των χειρουργών στην αντιμετώπιση, στη βελτίωση των χειρουργικών τεχνικών και της μετεγχειρητικής φροντίδας. Σχετικά με την ελκώδη κολίτιδα, οι περισσότερες μελέτες δείχνουν ότι τα δύο φύλα έχουν επηρεαστεί εξίσου. Όλες οι ηλικίες προσβάλλονται, με έμφαση, ωστόσο, τους νεαρούς ενήλικες (20- 40 ετών). Η μέση διάρκεια της νόσου προηγουμένως είναι 3- 5 έτη, αλλά τοξικό μεγάκολο μπορεί να παρουσιαστεί και ως πρώτη εκδήλωση της ελκώδους κολίτιδας.
Αιτιολογία
Τα συνηθέστερα αίτια και εκλυτικοί παράγοντες για την ανάπτυξη τοξικού μεγακόλου συνοψίζονται παρακάτω:
- Φλεγμονώδη
Ελκώδης κολίτιδα
Ν. Crohn
- Λοιμώδη
Clostridium difficile
Salmonella, Shigella, Yersinia, Campylobacter
Cryptosporidium
Entamoeba histolytica
Cytomegalovirus
- Iσχαιμική κολίτιδα
- Κακοήθεια
Σάρκωμα Kaposi
- Άλλοι παράγοντες
Υποκαλιαιμία, υπομαγνησιαιμία
Βαριούχος υποκλυσμός
Διακοπή στεροειδών
Ναρκωτικά
Αντιχολινεργικά
Χημειοθεραπεία
Κολονοσκόπηση
Κλινική εικόνα
Οι ασθενείς έχουν συνήθως σημεία και συμπτώματα οξείας κολίτιδας που μπορεί να είναι ανθεκτική στη θεραπεία. Διάρροια, κοιλιακό άλγος, αιμορραγία από το ορθό, τεινεσμός, ταχυκαρδία, σημεία αφυδάτωσης, έμετος και πυρετός προεξάρχουν στην κλινική εμφάνιση. Η παρουσία περιτοναϊσμού μπορεί να υποδεικνύει διάτρηση, αλλά μπορεί να επισκιαστεί από τη χρήση των στεροειδών. Τα διαγνωστικά κριτήρια που αναπτύχθηκαν από τους Jalan και συν είναι χρήσιμα και κατευθύνουν τη διάγνωση:
- Ακτινολογικές ενδείξεις κολονικής διάτασης (εγκάρσιο κόλον > 6 εκατοστά σε διάμετρο)
- Τρία από τα ακόλουθα: Πυρετός (> 101,5 ° F), ταχυκαρδία (> 120), λευκοκυττάρωση (> 10.5), αναιμία
- Ένα από τα παρακάτω: Αφυδάτωση, αλλαγή της νοητικής κατάστασης, ανωμαλίες των ηλεκτρολυτών, υπόταση
Παρακλινικός έλεγχος
Η ανάπτυξη λευκοκυττάρωσης με αριστερή στροφή είναι συχνή στους ασθενείς αυτούς. Η αναιμία είναι αποτέλεσμα των αιματηρών διαρροιών, ενώ σε ανοσοκαταστλμένους ή εξαιρετικά τοξικούς ασθενείς οι τιμές των λευκών αιμοσφαιρίων μπορεί να είναι και χαμηλές. Οι ηλεκτρολυτικές διαταραχές είναι πολύ συχνές και οφείλονται στις διάρροιες, στη χρήση στεροειδών, στις συνεχιζόμενες απώλειες από το γαστρεντερικό και στη μειωμένη δυνατότητα του παχέος εντέρου για απορρόφηση ύδατος και NaCl λόγω της σοβαρής φλεγμονώδους προσβολής του. Η εκτίμηση της θρεπτικής κατάστασης του ασθενούς (λευκωματίνη, προαλβουμίνη) και οι χρόνοι πήξης είναι απαραίτητο να εκτιμούνται, ιδιαίτερα στην περίπτωση άμεσης χειρουργικής αντιμετώπισης.
Η απλή ακτινογραφία κοιλίας είναι απαραίτητη για τη διάγνωση του τοξικού μεγακόλου. Ακτινογραφικά ευρήματα περιλαμβάνουν τα εξής: Διάταση (> 6 εκ) στο εγκάρσιο κόλον, απώλεια κολονικών κυψελών, παρουσία "thumbprinting", παρουσία ενδοαυλικώνl μαλακών ιστικών μαζών (ψευδοπολύποδες), πιθανή παρουσία ελεύθερου ενδοπεριτοναϊκού αέρα (διάτρηση). Ο βαριούχος υποκλυσμός πρέπει αυστηρά να αποφεύγεται. Ο ρόλος της αξονικής τομογραφίας, αν και βιβλιογραφικά τεκμηριωμένος μάλλοω σε περιορισμένο βαθμό, φαίνεται να είναι σημαντικός σε δυσδιάγνωστες περιπτώσεις (σοβαρή ανοσοκαταστολή, ασθενείς με AIDS) και μπορεί να ανδείξει πέραν των ανωτέρω αναφερθέντων απεικονιστικών ευρημάτων τοπικές συλλογές και αποστήματα, συνεπεία διατρήσεων σε σοβαρές περιπτώσεις τοξικών μεγακόλων. Αν η διάγνωση είναι αβέβαιη και ο ασθενής δεν είναι τοξικός ή ασταθής, η εύκαμπτη ορθοσιγμοειδοσκόπηση μπορεί να επιχειρηθεί από έναν έμπειρο ενδοσκόπο.
Θεραπεία
Περιλαμβάνει 3 βασικούς στόχους: (1) Τη μείωση της κολονικής διάτασης για την πρόληψη της διάτρησης. (2) Τη διόρθωση διαταραχών ύδατος και ηλεκτρολυτών. (3) Την αντιμετώπιση της τοξιναιμίας και των παραγόντων που την προκάλεσαν. Η προσεκτική και συχνή παρακολούθηση της κατάστασης του ασθενούς είναι απαραίτητη, και, αρχικά, αιματολογικός και βιοχημικός έλεγχος με λήψη ακτινογραφιών κοιλίας σε όρθια ή πλαγία θέση είναι απαραίτητα κάθε 12 ώρες. Ευρέος φάσματος ενδοφλέβια αντιβιοτικά (αμπικιλλίνη, γενταμυκίνη, και μετρονιδαζόλη) πρέπει να χορηγούνται εξαρχής, ταυτόχρονα με την επιθετική ανάνηψη του ασθενούς. Η διακοπή φαρμάκων που αναστέλλουν την κινητικότητα του εντέρου (ναρκωτικά, αντιδιαρροϊκά, αντιχολινεργικοί παράγοντες) διακόπτονται. Η τοποθέτηση ρινογαστρικού σωλήνα είανι απαρίτητη. Μακρείς σωλήνες αποσυμπίεσης στο παχύ έντερο μπορεί να είναι χρήσιμοι, αλλά πρέπει να τοποθετούνται υπό ακτινοσκοπικό έλεγχο και να φθάνουν έως τον τελικό ειλεό. Η ενδοφλέβια χορήγηση στεροειδών είναι η βάση της συντηρητικής θεραπευτικής αντιμετώπισης. Ενδοφλέβια υδροκορτιζόνη είναι απαραίτητη για ασθενείς που λαμβάνουν κορτικοστεροειδή ή που έχουν υποστεί θεραπεία με κορτικοστεροειδή πρόσφατα.
Η συνεχής αξιολόγηση της κλινικής εικόνας παραμένει ουσιώδης. Τεχνικές ανακατανομής του ενδοκολονικού αέρα, όπως τοποθέτηση του ασθενούς σε γόνατο-αγκωνιαία θέση μπορεί να αποβούν αποτελεσματικές. Η χρήση της παρεντερικής διατροφής περιορίζεται σε σοβαρά υποθρεπτικούς ασθενείς. Ορισμένες αναφορές τονίζουν ότι η κυκλοσπορίνη Α μπορεί να είναι ευεργετική για τη θεραπεία της σοβαρής ελκώδους κολίτιδας ή τοξικού μεγακόλου. Δεδομένα υποδεικνύουν ότι η κυκλοσπορίνη μπορεί να παρέχει μια πρώτη ανταπόκριση σε ποσοστό ως 80%, το οποίο όμως μειώνεται στη συνέχεια με τη συνεχιζόμενη χρήση της. Η κυκλοσπορίνη έχει σημαντικές αρνητικές επιπτώσεις, συμπεριλαμβανομένων των ευκαιριακών λοιμώξεων και ανοσοκαταστολή, υπέρταση, νεφρική τοξικότητα, και νευρολογικές επιπλοκές. Αν και απαιτούνται περαιτέρω μελέτες, η θεραπεία με κυκλοσπορίνη μπορεί να μειώσει την ανάγκη για επείγουσα κολεκτομή. Ελάχιστες ναφορές υπάρχουν όσον αφορά την ευεργετική δράση του infliximab (αντι-TNF-άλφα μονοκλωνικό αντίσωμα), της λευκοκυτταρο-αφαίρεσης και του υπερβαρικού οξυγόνου στην αντιμετώπιση του τοξικού μεγακόλου.
Χειρουργική αντιμετώπιση
Η πρώϊμη εμπλοκή της χειρουργικής ομάδας είναι απαραίτητη, όταν η υπάρχει σοβαρή υποψία ανάπτυξης τοξικού μεγακόλου. Οι ενδείξεις για επείγουσα παρέμβαση περιλαμβάνουν την διάτρηση, τη μαζική αιμορραγία (6-8 U αίματος), την αύξηση της τοξικότητας και την κλινική και απεικονιστική επιδείνωση της κολονικής διάτασης. Οι περισσότεροι συνιστούν επείγουσα κολεκτομή εάν το μεγάκολο παραμένει ή εαν δεν υπάρχει σημαντική βελτίωση μετά από 48- 72 ώρες. Το σκεπτικό για την έγκαιρη χειρουργική επέμβαση βασίζεται στην 5-πλάσια αύξηση της θνησιμότητας μετά από ελεύθερη διάτρηση. Εάν ο ασθενής δείχνει κλινική βελτίωση, η αναμονή 7 ημερών μπορεί να δικαιολογηθεί.
Η υφολική κολεκτομή, τελική ειλεοστομία και σύγκλειση ορθικού κολοβώματος κατά Hartmann ή η υφολική κολεκτομή, ειλεοστομία και βλεννογονικό συρίγγιο αποτελούν τις επεμβάσεις εκλογής στην αντιμετώπιση της οξείας κολίτιδας. Η επείγουσα ολική πρωκτο-ορθοκολεκτομή και τελική ειλεοστομία πρέπει να αποφεύγεται διότι (1) ο ασθενής συνήθως είναι πολύ άρρωστος για να ανεχθεί την πυελική Παρασκευή και την, κατά συνέπεια επιμήκυνση του χειρουργικού χρόνου, (2) διαφυλάσσεται η δυνατότητα για τη μελλοντική δημιουργία ειλεϊκής λυκήθου, και (3 ) περίπου το 50% των ασθενών με νόσο Crohn έχουν ελάχιστη συμμετοχή του ορθού. Η πρωτογενής αποκατάσταση εντερικής συνέχειας σε ν. Crohn και η ειλεολύκηθο-πρωκτική αναστόμωση σε ελκώδη κολίοτιδα διενεργούνται σε δεύτερο χρόνο, μετά την πάροδο του οξέος επεισοδίου.
Βιβλιογραφία
- Actis GC, Ottobrelli A, Pera A, et al. Continuously infused cyclosporine at low dose is sufficient to avoid emergency colectomy in acute attacks of ulcerative colitis without the need for high-dose steroids. J Clin Gastroenterol. Jul 1993;17(1):10-3.
- Bartlett JG, Perl TM. The new Clostridium difficile--what does it mean?. N Engl J Med. Dec 8 2005;353(23):2503-5.
- Gan SI, Beck PL. A new look at toxic megacolon: an update and review of incidence, etiology, pathogenesis, and management. The American Journal of Gastroenterology. 2003;98:2363-2371.
- Gan SI, Beck PL. A new look at toxic megacolon: an update and review of incidence, etiology, pathogenesis, and management. The American Journal of Gastroenterology. 2003;98:2363-2371.
- Grant CS, Dozois RR. Toxic megacolon: ultimate fate of patients after successful medical management. Am J Surg. Jan 1984;147(1):106-10.
- Greenstein AJ, Sachar DB, Gibas A. Outcome of toxic dilatation in ulcerative and Crohn''s colitis. J Clin Gastroenterol. Apr 1985;7(2):137-43.
- Guslandi M. Nitric oxide and inflammatory bowel diseases. Eur J Clin Invest. Nov 1998;28(11):904-7.
- Heppell J, Farkouh E, Dube S. Toxic megacolon. An analysis of 70 cases. Dis Colon Rectum. Dec 1986;29(12):789-92.
- Jalan KN, Sircus W, Card WI, et al. An experience of ulcerative colitis. I. Toxic dilation in 55 cases. Gastroenterology. Jul 1969;57(1):68-82.
- Lee EC, Truelove SC. Proctocolectomy for ulcerative colitis. World J Surg. 1980;4(2):195-201
- Levine CD. Toxic megacolon: diagnosis and treatment challenges. AACN Clin Issues. Nov 1999;10(4):492-9.
- Maconi G, Sampietro GM, Ardizzone S. Ultrasonographic detection of toxic megacolon in inflammatory bowel diseases. Dig Dis Sci. Jan 2004;49(1):138-42.
- Morris JB, Zollinger RM Jr, Stellato TA. Role of surgery in antibiotic-induced pseudomembranous enterocolitis. Am J Surg. Nov 1990;160(5):535-9.
- Mourelle M, Casellas F, Guarner F, et al. Induction of nitric oxide synthase in colonic smooth muscle from patients with toxic megacolon. Gastroenterology. Nov 1995;109(5):1497-502.
- Mourelle M, Vilaseca J, Guarner F, et al. Toxic dilatation of colon in a rat model of colitis is linked to an inducible form of nitric oxide synthase. Am J Physiol. Mar 1996;270(3 Pt 1):G425-30
- Panos MZ, Wood MJ, Asquith P. Toxic megacolon: the knee-elbow position relieves bowel distension. Gut. Dec 1993;34(12):1726-7.
- Present DH. Toxic megacolon. Med Clin North Am. Sep 1993;77(5):1129-48.
- Present DH, Wolfson D, Gelernt IM, et al. Medical decompression of toxic megacolon by "rolling". A new technique of decompression with favorable long-term follow-up. J Clin Gastroenterol. Oct 1988;10(5):485-90.
- Roy MA. Inflammatory bowel disease. Surg Clin North Am. Dec 1997;77(6):1419-31.
- Sawada K, Egashira A, Ohnishi K. Leukocytapheresis (LCAP) for management of fulminant ulcerative colitis with toxic megacolon. Digestive Diseases and Sciences. 2005;50:767-773.
- Shimada Y, Iiai T, Okamoto H. Toxic megacolon associated with cytomegalovirus infection in ulcerative colitis. J Gastroenterol. 2003;38(11):1107-8.
- Sriram PV, Reddy KS, Rao GV. Infliximab in the treatment of ulcerative colitis with toxic megacolon. Indian J Gastroenterol. Jan-Feb 2004;23(1):22-3.
- Weissleder, R, Rieumont MJ, Wittenberg J. Primer of Diagnostic Imaging. St. Louis, Mo: Mosby; 1997:. 192.
- Wodzinski MA, Snowden JA, Reilly JT. Toxic megacolon complicating chemotherapy for acute myeloid leukaemia. Postgrad Med J. Dec 1994;70(830):921-3.
Εισαγωγή
Οι αρχές που διέπουν τη θεραπευτική στρατηγική του καρκίνου του ορθού διαφέρουν σημαντικά από αυτές που ακολουθούνται στην αντιμετώπιση του υπόλοιπου παχέος εντέρου. Στόχοι της χειρουργικής θεραπείας του καρκίνου του ορθού, η οποία και αποτελεί το βασικό μέσο εκρίζωσης του εν λόγω όγκου και επίτευξης μακράς επιβίωσης των ασθενών, αποτελούν η διενέργεια μιας ριζικής, ογκολογικά σωστής θεραπευτικής εκτομής και η ελαχιστοποίηση των τοπικο-περιοχικών υποτροπών. Ο τοπικός έλεγχος της νόσου είναι πολλές φορές δύσκολος, ενώ τα ποσοστά των υποτροπών εξακολουθούν να αποτελούν πηγή ανησυχίας για τους χειρουργούς της περιοχής.
Η επιτυχία όμως των επεμβάσεων και των υπόλοιπων θεραπευτικών επιλογών για τον καρκίνο του ορθού δεν κρίνεται μόνο από την επίτευξη του επιθυμητού ογκολογικού αποτελέσματος, αλλά και από τα λειτουργικά επακόλουθα που, αναπόφευκτα, μπορούν να επιφέρουν οι πυελικές επεμβάσεις. Έτσι θέματα που εμπίπτουν σε διαταραχές της λεγόμενης Σχετιζόμενης με την Υγεία Ποιότητας Ζωής (Ηealth-Related Quality of Life, HRQOL) έχουν γίνει σημαντικά, ενώ ένας αυξανόμενος αριθμός μελετών εστιάζονται σε αυτά. Αν και η ακριβής συχνότητά της διαταραχής της και οι σχετικοί προδιαθεσικοί παράγοντες δεν έχουν πλήρως διευκρινιστεί, η σεξουαλική λειτουργία είναι ένα από τα στοιχεία της Ποιότητας Ζωής που μπορεί να υποστεί σημαντικές αλλαγές μετεγχειρητικά. Διαταραχές της λειτουργίας της ουροδόχου κύστης είναι επίσης συχνές.
Σημαντική διαφοροποίηση μπορεί να επέλθει και στην εντερική λειτουργία και στη σφιγκτηριακή επάρκεια. Άλλες παράμετροι της ποιότητας ζωής (συναισθηματική ευεξία, κοινωνική ζωή, κλπ) βρίσκονται σε κίνδυνο γιατί τέτοιες ογκολογικές επεμβάσεις πιθανόν να οδηγήσουν τον ασθενή σε «απομόνωση» και «αναπηρία». Ο χειρουργός παχέος εντέρου οφείλει να ενημερώνει τους ασθενείς με καρκίνο του ορθού για τις πιθανές επερχόμενες λειτουργικές διαταραχές, ώστε οι ασθενείς να έχουν ρεαλιστικές προσδοκίες από την επέμβαση, να κατέχει τις απαραίτητες γνώσεις χειρουργικής ανατομικής και φυσιολογίας, προκειμένου να αποφευχθούν ή, τουλάχιστον, να ελαχιστοποιηθούν τέτοιες λειτουργικές διαταραχές, αλλά και να είναι προετοιμασμένος για την αντιμετώπιση μιας λειτουργικής δυσπραγίας, η οποία, παρά το άριστο ογκολογικό αποπτέλεσμα, μπορεί να «βασανίσει» τον ασθενή μετεγχειρητικά.
Ουρογενετήσιες διαταραχές
Ανατομία αυτόνομων νευρικών πλεγμάτων
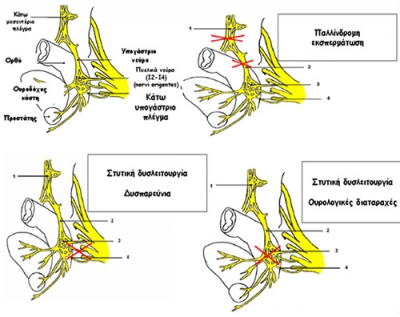
Το κάτω μεσεντέριο αυτόνομο νευρικό πλέγμα δημιουργείται από μεταγαγγλιονικές προαορτικές συμπαθητικές ίνες (από τα Ο3-Ι1 νευροτόμια) στη θέση της έκφυσης της κάτω μεσεντερίου αρτηρίας από την αορτή. Οι ίνες που εκβάλλουν από το πλέγμα αυτό οδηγούν στη δημιουργία του άνω υπογαστρίου πλέγματος στο διχασμό της αορτής στις κοινές λαγόνιες αρτηρίες. Από αυτό το πλέγμα προέρχονται το δεξιό και το αριστερό υπογάστρια νεύρα, τα οποία κατέρχονται στην πύελο μεταξύ της προϊεράς τοιχωματικής πυελικής περιτονίας και της σπλαγχνικής πυελικής ή ιδίως μεσοορθικής περιτονίας. Ιατρογενής τραυματισμός των παραπάνω συμπαθητικών πλεγμάτων και νεύρων οδηγεί σε παλλίνδρομη εκσπερμάτωση (Εικόνα 1). Τα συμπαθητικά υπογάστρια νεύρα ενώνονται με τα παρασυμπαθητικά πυελικά νεύρα από τα Ι2-Ι4 (nervi erigentes) προσθιοπλαγίως του ορθού, όπισθεν των σπερματοδόχων κύστεων και του προστάτη, μπροστά από την περιτονία Dennonvilliers, όπου και σχηματίζουν το κάτω υπογάστριο (πυελικό) πλέγμα. Είναι σε αυτή τη θέση που συμβαίνουν οι περισσότερες και πιο σοβαρές ιατρογενείς κακώσεις κατά τη χαμηλή πρόσθια εκτομή. Τραυματισμός του νευρικού αυτού πλέγματος οδηγεί σε στυτική δυσλειτουργία (ανικανότητα) και νευρογενή κύστη (άτονη ουροδόχο κύστη, επίσχεση ούρων) (Εικόνα 1).
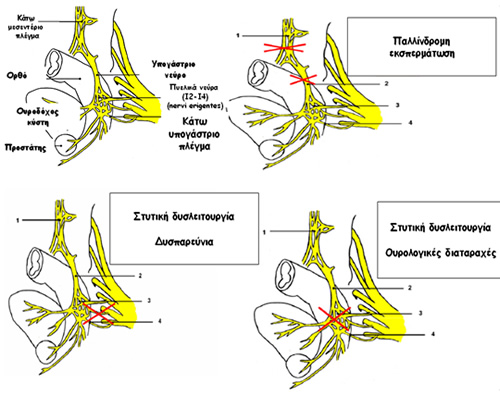
Εικόνα 1. Αυτόνομα νεύρα της πυέλου και θέσεις ιατρογενούς τραυματισμού κατά τη χειρουργική του ορθού
Ουρολογικές διαταραχές μετά από «ανοικτή» ΧΠΕ
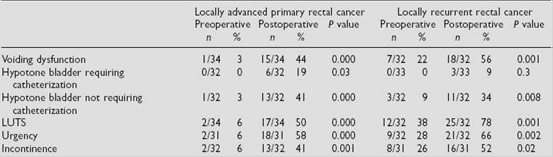
Σε μελέτες που αφορούσαν γενικά στην «ανοικτή» χειρουργική αντιμετώπιση του καρκίνου του ορθού, τα μετεγχειρητικά ποσοστά δυσλειτουργίας στην κένωση της κύστης, έπειξης για ούρηση και ακράτειας ούρων έφθαναν το 44%, 58% και 41%, αντίστοιχα (Εικόνα 2).
Σεξουαλική δυσλειτουργία μετά από «ανοικτή» ΧΠΕ
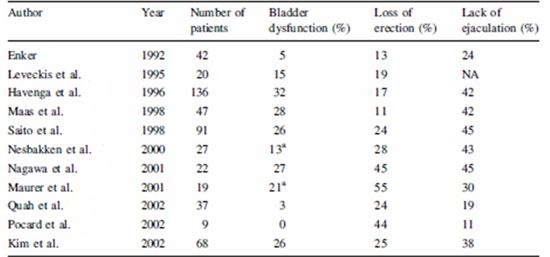
Στη μελέτη των Hendren και συν (Αnn Surg, 2005), ενώ το 61% των γυναικών και το 91% των ανδρών ήταν σεξουαλικά ενεργείς προ του χειρουργείου, το 29% των γυναικών και το 45% ανδρών ανέφεραν χειρότερη σεξουαλική ζωή μετεγχειρητικά, μετά την εκτομή του καρκίνου του ορθού και, κατά περίπτωση, την απαραίτητη επιουρική θεραπεία. Η διενέργεια κοιλιοπερινεϊκής εκτομής, η χορήγηση ακτινοθεραπείας και η προχωρημένη ηλικία των ασθενών αποτέλεσαν σημαντικούς παράγοντες κινδύνου.
Εικόνα 2. Μετεγχειρητικές λειτουργικές διαταραχές ούρησης
(Eur J Surg Oncol. 2001 Apr;27(3):265-72.)
Οι αναφορές από τις δεκαετίες 1980 και 1990 παρουσίαζαν τη σεξουαλική ανικανότητα ως μία, πολλές φορές, αναπόφευκτη λειτουργική επιπλοκή και «τίμημα» για την ογκολογική θεραπεία μετά τις ριζικές χειρουργικές εκτομές για τον καρκίνο του ορθού, με ποσοστά στυτικής δυσλειτουργίας που έφθαναν και το 100%. Η εισαγωγή και η ευρεία εφαρμογή της Ολικής Μεσοορθικής Εκτομής (Total Mesorectal Excision, TME), ειδικά με την εκτέλεση προσεκτικής διατήρησης των αυτόνομων νεύρων (Nerve sparing TME), οδήγησε σε ελαττωμένα ποσοστά στυτικής δυσλειτουργίας. Στη μελέτη των Mauer και συν (Brit J Surg, 2001) η ΤΜΕ πέτυχε τη διατήρηση της στύσης και της εκσπερμάτωσης σε σημαντικά μεγαλύτερο βαθμό από ότι η «συμβατική» ΧΠΕ. Φαίνεται ότι, αν και πιο ριζική, η ΤΜΕ διενεργείται σε σωστά ανατομικά πλάνα, γεγονός που βοηθά αποτελεσματικά στη διατήρηση των νεύρων.
Άλλες σειρές ασθενών μετά από ΤΜΕ έχουν σχετικά ικανοποιητικά αποτέλεσματα, αν και η παρουσία σεξουαλικών διαταραχών μετά από «ανοικτή» ΧΠΕ δεν παύει να αποτελεί συχνή λειτουργική επιπλοκή (Εικόνα 3).
Στην πρόσφατη συστηματική ανασκόπηση (Ho και συν, Dis Colon & Rectum, 2011) σχετικών μελετών που δημοσιεύθηκαν μετά το 2000 η επίπτωση της μετεγχειρητικής σεξουαλικής δυσλειτουργίας για τους άνδρες και τις γυναίκες ήταν 23-35% και 18-23%, αντίστοιχα, ενώ εάν συμπεριληφθούν και οι μελέτες που χρησιμοποίησαν προτυποποιημένα ερωτηματολόγια (που έχουν τη δυνατότητα να ανιχνεύουν και ηπιότερες μεταβολές της σεξουαλικότητας), τα αντίστοιχα ποσοστά φθάνουν το 23-66% και 19-62%. Στην ανασκόπηση αυτή χρησιμοποιήθηκαν μελέτες που εστίαζαν τόσο στην «ανοικτή» όσο και στη λαπαροσκοπική εκτομή του ορθικού καρκίνου, καθώς και σχετικές συγκριτικές μελέτες μεταξύ των προσεγγίσεων αυτών.
Οι παράγοντες που σχετίζονται με τη σεξουαλική δυσλειτουργία συνοψίζονται ως εξής:
A. Σχετιζόμενοι με τη θεραπεία:
•ΤΜΕ: Έχει καλύτερα αποτελέσματα.
•Η λαπαροσκοπική έναντι της «ανοικτής» προσέγγισης (βλ. παρακάτω)
•Η εκτεταμένη λεμφαδενική εκτομή (Extended Lymph Node Disection): Δεν φαίνεται να επηρεάζει σημαντικά (Ho και συν, Dis Colon & Rectum, 2011).
•Η δημιουργία στομίας: Η σεξουαλική ζωή επιδεινώνεται σύμφωνα με 2 μελέτες, ενώ δεν φαίνεται να επηρεάζεται σημαντικά σύμφωνα με 2 άλλες (Ho και συν, Dis Colon & Rectum, 2011).
•Η χορήγηση (νέο-) επικουρικής ακτινοθεραπείας: Σύμφωνα με την Ολλανδική μελέτη (Dutch TME trial), στην οποία συγκρίθηκαν τα αποτελέσματα μετά από ΤΜΕ έναντι ακτινοθεραπείας + ΤΜΕ, οι ασθενείς που είχαν λάβει και ακτινοθεραπεία είχαν χειρότερη σεξουαλική λειτουργία.
B. Σχετιζόμενοι με τον ασθενή
•Το προεγχειρητικό status της σεξουαλικής λειτουργίας επηρεάζει σημαντικά τη μετεγχειρητική ικανότητα του ασθενούς (Hendren και συν, Ann Surg, 2005, Stamopoulos και συν, Surg Endosc, 2009)
•Η προχωρημένη ηλικία είναι επιβαρυντικός παράγοντας (Hendren και συν, Ann Surg, 2005)
•Το φύλο: Οι άνδρες βρίσκονται σε μεγαλύτερο κίνδυνο, πιθανά αφού οι περισσότερες γυναίκες σε τέτοιες ηλικίες είναι σεξουαλικά ανενεργείς. Αυτή την παρατήρηση την έχει επιβεβαιώσει η μελέτη MRC-CLASSIC, η οποία συνέκρινε τη λαπαροσκοπική με την «ανοικτή» χειρουργική για ορθοκολικό καρκίνο.
Γ. Σχετιζόμενοι με τα χαρακτηριστικά του όγκου
•Η κοιλιοπερινεϊκή εκτομή που αφορά, ως γνωστόν, στη χειρουργική αντιμετώπιση των καρκίνων του κατώτερου ορθού, εφόσον αυτοί δεν είναι αφαιρέσιμοι με κάποια σφιγκτηροδιασωστική επέμβαση, σχετίζεται με υψηλότερο ποσοστό σεξουαλικών δυσλειτουργιών (Hendren και συν, Ann Surg, 2005, Stamopoulos και συν, Surg Endosc, 2009). Αν και υπάρχουν υποψίες ότι το ύψος της αναστόμωσης αποτελεί παράγοντα κινδύνου, στη μελέτη των Gurren και συν (Eur J Surg Oncol, 2005), η πολύ χαμηλή πρόσηια εκτομή με κολοπρωκτική αναστόμωση συνοδευόταν με χαμηλότερα ποσοστά στυτικής δυσλειτουργίας.
Εικόνα 3. Σεξουαλικές διαταραχές μετά από ΤΜΕ
Ουρογενετήσιες διαταραχές μετά από λαπαροσκοπική ΧΠΕ
Τα πλεονεκτήματα της λαπαροσκοπικής προσέγγισης στη χειρουργική αντιμετώπιση του καρκίνου του ορθού είναι η σημαντικά βελτιωμένη ορατότητα των ανατομικών δομών της «στενής» πυέλου, λόγω της μεγέθυνσης που προσφέρει η χρήση του λαπαροσκοπίου και του καλού φωτισμού καθώς και η κατ΄ ανάγκην ανατομική παρασκευή σε εμβρυολογικά ανάγγεια πλάνα, αφού η παραμικρή απώλεια του χειρουργικού πλάνου μπορεί να προκαλέσει αιμορραγίες που παραβλάπτουν το πεδίο και ελέγχονται δύσκολα με τα λαπαροσκοπικά εργαλεία, κάτι, βέβαια, που μπορεί να προκαλέσει πρόβλημα, αλλά, οπωσδήποτε όχι της αυτής εμβέλειας, και στην «ανοικτή» χειρουργική. Επομένως ο «λαπαροσκόπος» χειρουργός «αναγκάζεται» να είναι ιδιαίτερα προσεκτικός. Ακόμη και το γεγονός ότι βασίζεται σε σχεδόν αποκλειστικά «οξείες» παρασκευές των ιστών, αντί για την ευκολία των «αμβλέων», αδρών παρασκευών της «ανοικτής» χειρουργικής, τον βοηθά στην κατά το δυνατόν καλύτερη διατήρηση των περιτονιών (προϊεράς, μεσοορθικής, Dennonvillier’s), οι οποίες αποτελούν και τις ιστικές δομές-κλειδιά για την ολική μεσοορθική εκτομή. Τα παραπάνω βοηθούν σημαντικά στην επίτευξη διατήρησης και την αποφυγή τραυματισμού των αυτόνομων νεύρων και πλεγμάτων και, συνεπώς, την εκτέλεση μιας «νευρο-σωστικής» ολικής μεσοορθικής εκτομής (Nerve sparing TME). Ένα πιθανό μειονέκτημα της λαπαροσκοπικής ΧΠΕ είναι το ότι πολλές από τις πυελικές παρασκευές γίνονται με τη χρήση εργαλείων (ψαλίδι υπερήχων κλπ), που, λόγω της ανάγκης αρχικής σύλληψης και μετά διατομής των παρασκευαζόμενων ιστών, μπορούν να οδηγήσουν σε άμεση ακούσια ιατρογενή κάκωση (ιδιαίτερα του στυτικού πυελικού πλέγματος κατά την προσθιοπλάγια μεσοορθική παρασκευή) ή σε τραυματισμό λόγω θερμικής διασποράς.
Στις σύγχρονες μελέτες που επικεντρώνονται στη λαπαροσκοπική χαμηλή πρόσθια εκτομή (ΧΠΕ) δυσλειτουργία της ουροδόχου κύστης εμφανίζεται σε ποσοστό 0-12%.
Σε δύο μελέτες σύγκρισης της λαπαροσκοπικής με την «ανοικτή» εκτομή για καρκίνο του ορθού, η σεξουαλική λειτουργία ελέγχθηκε ως δευτερογενές αποτέλεσμα. Στην αναδρομική μελέτη κοορτής των Quah και συν (Brit J Surg, 2002), όπου χρησιμοποιήθηκε και το ΙΙΕF (Ιnterrnational Indesx for Erectile Dysfunction) ως πρότυπο ερωτηματολόγιο και δείκτης αντικειμενικής αξιολόγησης της στυτικής δυσλειτουργίας για τους άνδρες, το ποσοστό των ασθενών που ήταν σεξουαλικά ενεργείς 3 έτη μετά την επέμβαση ήταν 76.2% (16/21 ασθενείς) μετά από λαπαροσκοπική έναντι 89.3% (25/28 ασθενείς) μετά από «ανοικτή» εκτομή (p=0,26). Το ποσοστό της εμμένουσας νεοεμφανιζόμενης στυτικής δυσλειτουργίας μετά από λαπαροσκοπική ήταν σημαντικά αυξημένο σε σχέση με την «ανοικτή» εκτομή (40.0% έναντι 13.6%, p=0.004). Kατά την ανάλυση των αποτελεσμάτων από την τυχαιοποιημένη συγκριτική μελέτη CLASSIC (μόνο 50% των ασθενών απάντησαν στα σχετικά ερωτηματολόγια) βρέθηκε τάση συσχέτισης της λαπαροσκοπικής χειρουργικής με χειρότερα scores σεξουαλικής ικανοποίησης και στυτικής λειτουργίας μετεγχειρητικά σε σύγκριση με την «ανοικτή» (p=0,063 και p=0,068, αντίστοιχα).
Αντίθετα με τα παραπάνω, στην προοπτική μη τυχαιοποιημένη μελέτη των Yang και συν (Εur J Surg Oncol, 2007) αναδείχθηκε η καλύτερη, βραχυπρόθεσμα, σεξουαλική λειτουργία και ο μεγαλύτερος βαθμός σεξουαλικής ικανοποίησης, μακροπρόθεσμα, μετά από λαπαροσκοπική σε σχέση με τη συμβατική χειρουργική του ορθού. Τα αποτελέσματα που προέκυψαν από την προοπτική παρακολούθηση, ανά τακτά χρονικά διαστήματα, της σεξουαλικής λειτουργίας μετά από λαπαροσκοπική και «ανοικτή» προσέγγιση για τον καρκίνο του ορθού στην Α΄ Προπαιδευτική Χειρουργική Κλινική ΕΚΠΑ, στο Ιπποκράτειο Νοσοκομείο Αθηνών δεν συνηγορούν στην ύπαρξη στατιστικών σημαντικών διαφορών στο συνολικό και στους επιμέρους τομείς του IIEF score ανάμεσα στους δύο τύπους επεμβάσεων (Stamopoulos P, Theodoropoulos GE, Papailiou J, et al, Surg Endosc, 2009). Στη συγκεκριμένη όμως μελέτη, οι 20 από τους 22 ασθενείς που είχαν εμμένουσα σεξουαλική δυσλειτουργία (ΙΙΕF score < 43) 6 μήνες μετά από το χειρουργείο είχαν υποβληθεί σε «ανοικτή» χειρουργική εκτομή του ορθού (p=0,076), γεγονός που υποστηρίζει μόνο με τάση για σημαντικότητα τη λαπαροσκοπική χειρουργική.
Μετεγχειρητική εντερική λειτουργία, διαταραχές κενώσεων
Επιστροφή εντερικής λειτουργίας
Ανάμεσα στα βραχυπρόθεσμα πλεονεκτήματα της λαπαροσκοπικής ΧΠΕ είναι η ταχύτερη επιστροφή της λειτουργίας του εντέρου και ο βραχύτερος χρόνος του μετεγχειρητικού ειλεού, τα οποία και μεταφράζονται σε ταχύτερη έξοδο από το νοσοκομείο. Αυτές οι παρατηρήσεις υποστηρίζονται από προοπτικές συγκριτικές τυχαιοποιημένες (Εικόνα 4) και μη τυχαιοποιημένες (Εικόνα 5) μελέτες μεταξύ της λαπαροσκοπικής και της «ανοικτής» χειρουργικής στον καρκίνο του ορθού.
Εικόνα 4. Προοπτικές συγκριτικές τυχαιοποιημένες μελέτες μεταξύ της λαπαροσκοπικής και της «ανοικτής» χειρουργικής στον καρκίνο του ορθού
Εικόνα 5. Προοπτικές συγκριτικές μη τυχαιοποιημένες μελέτες μεταξύ της λαπαροσκοπικής και της «ανοικτής» χειρουργικής στον καρκίνο του ορθού
Διαταραχές των κενώσεων μετά από ΧΠΕ
Μετά από ΧΠΕ η ακράτεια (ακούσια απώλεια εντερικού περιεχομένου) αποτελεί ένα δυσάρεστο λειτουργικό επακόλουθο. Ακράτεια στερεών κοπράνων, υδαρών κοπράνων, αερίων και αλλαγή της καθημερινότητας των ασθενών εξαιτίας των παραπάνω μπορεί να εμφανίστούν σε ποσοστά έως και 6,5%, 16%, 29% και 42%, αντίστοιχα.
Αυτό το φαινόμενο οφείλεται στα παρακάτω:
•Τραύμα σφιγκτήρα (βίαιη διαστολή κατά την τοποθέτηση του κυκλικού αναστομωτήρα)
•Αιδοιϊκή νευροπάθεια
•Ελαττωμένη ορθική διατασιμότητα
•Απώλεια ορθικού reservoir
•Kοπρόσταση, ψευδοδιάρροια
•Ελαττωμένος χρόνος διάβασης, διάρροια από την απώλεια μήκους παχέος εντέρου
Ένα άλλο λειτουργικό επακόλουθο της ΧΠΕ είναι η εμφάνιση του συνδρόμου προσθίας εκτομής. Αυτό χαρακτηρίζεται από αυξημένη συχνότητα κενώσεων, έπειξη για αφόδευση (αδυναμία αναβολής κένωσης για 15΄, urgency), τεινεσμό, διαβροχή, κατάτμηση και πολλαπλότητα συχνών, μικρών κενώσεων (stool fragmentation/clustering), δηλαδή πολλαπλές κενώσεις σε 1-2 ώρες με αίσθημα ορθικής πλήρωσης. Εμφανίζεται σε 1/3 ασθενών, οι οποίοι έχουν 3-14 κενώσεις/ημέρα.
Οφείλεται στα παρακάτω:
•Απώλεια ορθικού reservoir
•Aντικατάσταση ορθού από λιγότερο ευένδοτο κατιόν ή σιγμοειδές
•Ασυνέχεια του μυϊκού χιτώνα & ενδοτοιχωματικών νευρικών πλεγμάτων οδηγεί σε διαταραχή των συντονισμένων κολονικών μαζικών κινήσεων (mass movements)
•Aπονεύρωση ορθού
•Σφιγκτηριακοί τραυματισμοί από stapler
Η δημιουργία μιας κoλονικής νεοληκύθου τύπου J (Colonic J-pouch, CJP) βοηθά στην εξάλειψη του συνδρόμου προσθίας εκτομής και προσφέρει καλύτερα λειτουργικά αποτελέσματα έναντι της ευθείας κολο-πρωκτικής αναστόμωσης έως και 2 έτη μετεγχειρητικά στην «ανοικτή» χειρουργική (Εικόνα 6).
Εικόνα 6. Η δημιουργία κoλονικής νεοληκύθου τύπου J οδηγεί σε μικρότερο αριθμό κενώσεων σε σύγκριση με την ευθεία αναστόμωση
Η δημιουργία κoλονικής νεοληκύθου τύπου J μειώνει τις δυσμενείς λειτουργικές συνέπειες και μετά από τη λαπαροσκοπική ΧΠΕ. Τα χαρακτηριστικά της πρόσφατης μελέτης της ομάδας του Μ. Li από το Hong-Kong (Cheung et al, Colorectal Dis, 2011), όπου συμπεριελήφθησαν 103 ασθενείς με κολονική νεολήκυθο τύπου J μετά από 10ετή παρακολούθηση συνοψίζονται παρακάτω:
•3 (1-10) κενώσεις/ημέρα
•Επιτακτική αφόδευση: 20%
•Ακράτεια σε αέρια:17%
•Ακράτεια σε υδαρή κόπρανα: 15%
•Ακράτεια σε στερεά κόπρανα: 2,2%
•Νυκτερινή διαβροχή: 12%
Ποιότητα ζωής
Αν και η «φυσική κατάσταση» των ασθενών είναι επιδεινωμένη 3 μήνες μετά από τη λαπαροσκοπική ΧΠΕ συγκριτικά με προεγχειρητικά, η «συναισθηματική ευεξία» ανευρίσκεται σημαντικά βελτιωμένη στους 3 μήνες, με τη συνολική QOL να είναι τελικά σε καλύτερα επίπεδα σε σύγκριση με πριν το χειρουργείο, όπως αυτό αντανακλάται από τη βαθμολόγηση ειδικών ερωτηματολογίων μέτρησης και αξιολόγησης της QOL, όπως το SF-36 και το ΕORTC-QLQ C30 (European Organization for Research and Treatment of Cancer) (Breunkink et al, Dis Colon & Rectum, 2006).
Κατά την παρακολούθηση της QOL ασθενών της Α΄ Προπαιδευτικής Χειρουργικής Κλινικής ΕΚΠΑ, στο Ιπποκράτειο Νοσοκομείο Αθηνών (95 λαπαροσκοπικές κολεκτομές, 19 καρκίνοι ορθού), οι επεμβάσεις στο ορθό συσχετίστηκαν με σημαντικά περισσότερα προβλήματα «ακράτειας», «προβλημάτων στομίας» και «ανικανότητας» συγκριτικά με τις υπόλοιπες λαπαροσκοπικές επεμβάσεις στο παχύ έντερο, όπως αυτό φάνηκε από τη βαθμολόγηση του νεοχρησιμοποιούμενου ερωτηματολογίου ΕORTC-QLQ CR29 (αποτελέσματα παρουσιάστηκαν στο American Society of Colon and Rectal Surgeons 2011 Annual Meeting Vancouver, Canada, May, 2011 και στο 6th Annual Congress International Society of Laparoscopic Colorectal Surgeons, Colchester, UΚ, September 2011) (Eικόνα 7).
Εικόνα 7. Στατιστικά σημαντικές διαφορές με τη χρήση του ΕORTC-QLQ CR29 (Incont: Incontinence, «προβλήματα ακράτειας», Stoma: «Προβλήματα στομίας», Impot: Impotence, «ανικανότητα»)
Βιβλιογραφία
1.Hendren SK, O’Connor BI, Liu M, et al. Prevalence of male and female sexual dysfunction is high following surgery for rectal cancer. Ann Surg. 2005;242:212–223.
2.Rosen RC, Riley A, Wagner G, Osterloh IH, Kirkpatrick J, Mishra A. The international index of erectile function (IIEF): a multidimensional scale for assessment of erectile dysfunction. Urology. 1997;49:822– 830.
3.Camilleri-Brennan J, Steele RJ. Prospective analysis of quality of life and survival following mesorectal excision for rectal cancer. Br J Surg. 2001;88:1617–1622.
4.Guren MG, Wiig JN, Dueland S, et al. Quality of life in patients with urinary diversion after operation for locally advanced rectal cancer. Eur J Surg Oncol. 2001;27:645– 651.
5.Kim NK, Aahn TW, Park JK, et al. Assessment of sexual and voiding function after total mesorectal excision with pelvic autonomic nerve preservation in males with rectal cancer. Dis Colon Rectum. 2002;45:1178 –1185.
6.Quah HM, Jayne DG, Eu KW, Seow-Choen F. Bladder and sexual dysfunction following laparoscopically assisted and conventional open mesorectal resection for cancer. Br J Surg. 2002;89: 1551–1556.
7.Jayne DG, Brown JM, Thorpe H, Walker J, Quirke P, Guillou PJ. Bladder and sexual function following resection for rectal cancer in a randomized clinical trial of laparoscopic versus open technique. Br J Surg. 2005;92:1124 –1132.
8.Marijnen CA, van de Velde CJ, Putter H, et al. Impact of shortterm preoperative radiotherapy on health-related quality of life and sexual functioning in primary rectal cancer: report of a multicenter randomized trial. J Clin Oncol. 2005;23:1847– 1858.
9.Yang L, Yu YY, Zhou ZG, et al. Quality of life outcomes following laparoscopic total mesorectal excision for low rectal cancers: a clinical control study. Eur J Surg Oncol. 2007;33:575–579.
10.Breukink SO, van Driel MF, Pierie JP, Dobbins C, Wiggers T, Meijerink WJ. Male sexual function and lower urinary tract symptoms after laparoscopic total mesorectal excision. Int J Colorectal Dis. 2008;23:1199 –1205.
11.Morino M, Parini U, Allaix ME, Monasterolo G, Brachet Contul R, Garrone C. Male sexual and urinary function after laparoscopic total mesorectal excision. Surg Endosc. 2009;23:1233–1240.
12.Asoglu O, Matlim T, Karanlik H, et al. Impact of laparoscopic surgery on bladder and sexual function after total mesorectal excision for rectal cancer. Surg Endosc. 2009;23:296 –303.
13.Stamopoulos P, Theodoropoulos GE, Papailiou J, et al. Prospective evaluation of sexual function after open and laparoscopic surgery for rectal cancer. Surg Endosc. 2009;23:2665–2674.
14.Cheung HYS, Ng KH, Leung LH. Laparoscopic sphincter-preserving total mesorectal excision: 10-year report. Colorectal Dis. 2011;13:627-631
Η πρόοδος στη λαπαροσκοπική αντιμετώπιση καλοηθών ενδοκοιλιακών παθήσεων οδήγησε στην εφαρμογή των λαπαροσκοπικών και των λαπαροσκοπικά υποβοηθούμενων τεχνικών στη χειρουργική καλοηθών αλλά και κακοηθών παθήσεων του παχέος εντέρου. Αν και η πρώτη βιβλιογραφική αναφορά λαπαροσκοπικής κολεκτομής παρουσιάστηκε στη βιβλιογραφία το 1991, η ελάχιστα επεμβατική προσπέλαση των χειρουργικών παθήσεων, αρχικά, τουλάχιστον, δεν υιοθετήθηκε με μεγάλο ενθουσιασμό. Παρά τη συσσώρευση εμπειρίας, το ποσοστό των κολεκτομών που εκτελείται λαπαροσκοπικά σήμερα δεν ξεπερνά το 10%. Ο βασικός λόγος είναι οι τεχνικές απαιτήσεις και η πολυπλοκότητα των λαπαροσκοπικών εκτομών του παχέος εντέρου. Eπίσης, για πολλά χρόνια, λόγω της απουσίας καλά σχεδιασμένων συγκριτικών μελετών, η αβεβαιότητα και η ανησυχία των χειρουργών για το αν η λαπαροσκοπική αφαίρεση των κακοηθειών του παχέος εντέρου είναι τόσο ογκολογικά επαρκής όσο και η συμβατική κολεκτομή, αποτέλεσε σημαντικό εμπόδιο για την ευρεία αποδοχή και εφαρμογή της μεθόδου. Η εμφάνιση μάλιστα περιπτώσεων με μεταστάσεις στις θέσεις εισόδου των trocars μετά τις πρώτες λαπαροσκοπικές κολεκτομές για καρκίνο σκίασε ακόμη περισσότερο την ογκολογική ασφάλεια των επεμβάσεων αυτών. Η ολοκλήρωση τυχαιοποιημένων κλινικών μελετών και η παρουσίαση των αποτελεσμάτων τους τα τελευταία χρόνια σχεδόν εξάλειψαν, ωστόσο, τους φόβους για την επάρκεια της λαπαροσκοπικής ογκολογικής προσπέλασης. Εξ’ άλλου η λαπαροσκοπική χειρουργική μπορεί να προάγει τη θεραπευτική στρατηγική στην αντιμετώπιση του ορθοκολικού καρκίνου. Η λαπαροσκοπική σταδιοποίηση, ειδικά όταν συνδυάζεται με τη χρήση της λαπαροσκοπικής υπερηχοτομογραφίας του ήπατος προσφέρει σημαντικές πληροφορίες στον κλασσικό προεγχειρητικό απεικονιστικό έλεγχο με την αξονική τομογραφία.
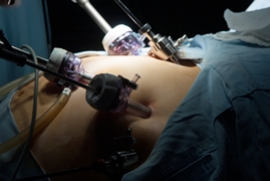
Η ελάττωση του μετεγχειρητικού άλγους, του ειλεού και της νοσηλείας συνολικά αποτελούν πλεονέκτημα της λαπαροσκοπικής προσέγγισης. Η επάνοδος στην εργασία είναι ταχύτερη, ενώ το κοσμητικό αποτέλεσμα καλύτερο. Από τα σημαντικότερα πλεονεκτήματα έναντι των «ανοικτών» κολεκτομών είναι η μειωμένη νοσηρότητα από τις χειρουργικές λοιμώξεις των τομών, λόγω του μικρότερου μεγέθους τους στη λαπαροσκοπική χειρουργική, καθώς και της μικρότερης συχνότητας ανάπτυξης μετεγχειρητικών κοιλιοκηλών, λόγω του μικρότερου σε έκταση τραυματισμού της κοιλιακής περιτονίας. Πιθανολογείται επίσης η ελάττωση της ανοσολογικής καταστολής που υφίσταται ο οργανισμός μετεγχειρητικά, η οποία φαίνεται να δρα ευνοϊκά στη μεγιστοποίηση του οφέλους που εκλαμβάνεται από τη χορήγηση της επικουρικής χημειοθεραπείας. Η μεγάλη καμπύλη εκμάθησης, ο αυξημένος διεγχειρητικός χρόνος και το κόστος των λαπαροσκοπικών επεμβάσεων εξακολουθούν να αποτελούν τα βασικά μειονεκτήματα των ελάχιστα επεμβατικών προσπελάσεων.
Η απώλεια του απτικού αισθήματος κατά την εκτέλεση των λαπαροσκοπικών επεμβάσεων μπορεί να αποτελέσει εμπόδιο στην ολοκλήρωσή της. Η προεγχειρητική σήμανση της νεοπλασματικής βλάβης με χρωστική (μελάνη της Ινδικής) κατά την κολονοσκόπηση και η διαθεσιμότητα διεγχειρητικής κολονοσκόπησης βοηθούν σημαντικά σε περιπτώσεις μικρών ή δύσκολα εντοπιζόμενων όγκων. Αντενδείξεις στην εκτέλεση μιας λαπαροσκοπικής κολεκτομής αποτελούν τα παρακάτω: καρδιοαναπνευστική ή αναπνευστική αστάθεια ή ανεπάρκεια, διαταραχές πήξης, υπερβολική παχυσαρκία, εγκυμοσύνη, επέκταση του όγκου σε παρακείμενα όργανα, διάτρηση του παχέος εντέρου με διάχυτη περιτονίτιδα, εντερο-εντερικά ή εντερο-δερματικά συρίγγια, σημαντική διάταση του εντέρου από τον αποφρακτικό όγκο. 20-30% των ασθενών παρουσιάζονται με καρκίνο σταδίου IV. Λόγω της αδυναμίας εκτέλεσης θεραπευτικής εκτομής στους ασθενείς αυτούς, η λαπαροσκοπική τμηματική κολεκτομή με ή χωρίς λαπαροσκοπική δημιουργία στομίας επιτυγχάνουν την αποφυγή μιας μείζονος λαπαροτομής, αφού παύουν να υφίστανται οι ανησυχίες για μια ευρεία ογκολογική εκτομή στην ομάδα των ασθενών αυτών. Μάλιστα οι εν λόγω ασθενείς μπορούν να ξεκινήσουν τη μετεγχειρητική χημειο-ακτινοθεραπεία ταχύτερα, λόγω της μικρότερης νοσηρότητας και της ταχύτερης ανάρρωσης που συνδυάζει η λαπαροσκοπική προσέγγιση. Το όφελος από τη λαπαροσκόπηση είναι αναμφισβήτητα το μέγιστο για τους ασθενείς με μεταστατική νόσο, στους οποίους η χορήγηση των επικουρικών θεραπειών είναι αυτή που, κατά κύριο λόγο θα επιτελέσει στην παράταση του χρόνου επιβίωσής τους.
Χειρουργική τεχνική
Η προεγχειρητική ετοιμασία του ασθενούς δεν διαφέρει σημαντικά από αυτήν που ακολουθείται για τις «ανοικτές» κολεκτομές. Ο πλήρης μηχανικός καθαρισμός του παχέος εντέρου και η χορήγηση της απαραίτητης χημειοπροφύλαξης είναι αναγκαία. Η προφύλαξη από φλεβοθρομβωτικά επεισόδια λόγω του παρατεταμένου πνευμοπεριτοναίου και της θέσης λιθοτομής, καθώς και της κατάστασης υπερπηκτικότητας που επάγεται και συντηρείται από την ύπαρξη της κακοήθειας, είναι επίσης απαραίτητη. Επιτυγχάνεται δε σήμερα με την υποδόρια χορήγηση ηπαρινών χαμηλού μοριακού βάρους.
Η εργαλειοδοσία του χειρουργείου πρέπει να διαθέτει πάντα και τον απαραίτητο χειρουργικό εξοπλισμό που απαιτείται σε μια «ανοικτή» κολεκτομή, αφού το ενδεχόμενο μετατροπής της λαπαροσκοπικής επέμβασης σε λαπαροτομία είναι πάντα πιθανό. Η ουροδόχος κύστη καθετηριάζεται και τοποθετείται ρινογαστρικός σωλήνας. Συνήθως η θέση λιθοτομής είναι απαραίτητη, όχι μόνο για την τοποθέτηση του χειρουργού ανάμεσα στα πόδια του ασθενούς κατά την εκτέλεση ορισμένων βημάτων των λαπαροσκοπικών κολεκτομών, αλλά και για τη δυνατότητα πρόσβασης για διεγχειρητική κολονοσκόπηση, εφ’ όσον ο όγκος δεν εντοπίζεται εύκολα.
Τα βασικά βήματα της λαπαροσκοπικής κολεκτομής δεν διαφέρουν από αυτά που ακολουθούνται στις «ανοικτές» κολεκτομές, εκτός, ίσως από την προσπέλαση που ακολουθείται κατά την κινητοποίηση του φέροντος τον όγκο τμήματος του παχέος εντέρου. Έτσι, ενώ στη συμβατική κολεκτομή η κινητοποίηση πραγματοποιείται από τα «πλάγια προς τα μέσα» (lateral-to-medial), η λαπαροσκοπική κινητοποίηση, συνήθως, πραγματοποιείται από τα «μέσα προς τα έξω» (medial-to-lateral). Τούτο σημαίνει ότι, κατά τη λαπαροσκοπική κινητοποίηση πρώτα κινητοποιείται το μεσόκολο με συνοδό λεμφαδενεκτομή και διαίρεση του σύστοιχου αγγειακού μίσχου στη ρίζα του και στη συνέχεια το τμήμα του εντέρου που φέρει τον όγκο. Έτσι, ο χειρουργός εκμεταλλεύεται τη φυσική συγκράτηση του δεξιού ή αριστερού κόλου από το πλάγιο κοιλιακό τοίχωμα, η οποία και διευκολύνει τη λαπαροσκοπική κινητοποίηση τεχνικά σε σημαντικό βαθμό, ενώ, ταυτόχρονα, εξασφαλίζεται η ριζικότητα και η ογκολογική επάρκεια της εκτομής με τον ενωρίς λεμφαγγειακό έλεγχο και την έλλειψη χειρισμών επί του όγκου, πριν να έχει διασφαλιστεί προηγουμένως η απολίνωση του αγγείων που τροφοδοτούν το αντίστοιχο τμήμα του παχέος εντέρου.
Κατά την τυπική λαπαροσκοπική κολεκτομή ο χειρουργός και ο χειριστής της κάμερας στέκονται στην αντίθετη από την πλευρά της παθολογίας, ενώ ο πρώτος βοηθός, ο οποίος έχει ως κύριο ρόλο την έλξη των ιστών προς παρασκευή προς την αντίθετη φορά από αυτή του χειρουργού στέκεται στην πλευρά του κόλου που έχει το νεόπλασμα. Η κινητοποίηση της ηπατικής και της δεξιάς κολικής καμπής επιτυγχάνεται με το χειρουργό να στέκεται ανάμεσα στα πόδια του ασθενή, ο οποίος βρίσκεται σε θέση λιθοτομής. Αν και νεοπλασίες σε όλα τα τμήματα του παχέος εντέρου προσφέρονται για λαπαροσκοπική αφαίρεση, τα νεοπλάσματα του εγκαρσίου κόλου αποτελούν ιδιαίτερη πρόκληση για το λαπαροσκόπο χειρουργό. Στην προσπάθεια αφαίρεσης κακοηθών βλαβών του εγκαρσίου κόλου, τα μέσα κολικά αγγεία, ο στόμαχος και το δωδεκαδάκτυλο διατρέχουν κίνδυνο τρώσης, ενώ η δυνατότητα επαρκούς έλξης του τμήματος αυτού του εντέρου είναι μάλλον περιορισμένη. Εκτός και αν η λαπαροσκοπική ομάδα έχει αποκτήσει ιδιαίτερη εμπειρία στη λαπαροσκοπική χειρουργική του εντέρου, οι κακοήθειες του εγκαρσίου κόλου ασφαλέστερα αντιμετωπίζονται με λαπαροτομία.
Δεξιά κολεκτομή
Αν μερικοί χειρουργοί προτιμούν την τοποθέτηση του ασθενούς σε θέση λιθοτομής, η οποία διευκολύνει την κινητοποίηση της ηπατικής καμπής, η λαπαροσκοπική δεξιά κολεκτομή μπορεί να εκτελεστεί με τον ασθενή σε ύπτια θέση καθ’ όλη τη διάρκεια του χειρουργείου. Ένα trocar 10mm τοποθετείται υπερομφαλίως με την τεχνική Hasson, το πνευμοπεριτόναιο εγκαθίσταται με επίπεδα ενδοπεριτοναϊκής πίεσης 10-12 mmHg και εισάγεται το λαπαροσκόπιο πλαγίας οράσεως (300). Υπό λαπαροσκοπική όραση τρία ακόμη trocars 10-12mmHg εισάγονται υπερηβικά, στο επιγάστριο και στη δεξιά μέση κοιλιακή χώρα (παραομφαλίως εκτός της θήκης του ορθού κοιλιακού μυός). Ο λόγος για τη χρήση των trocars μεγάλου μεγέθους είναι η δυνατότητα που προσφέρουν για την υποδοχή του λαπαροσκοπίου και των ενδοσκοπικών συρραπτικών, διότι κατά τη διάρκεια της επέμβασης τα εργαλεία αυτά μπορεί να χρειάζεται να εισάγονται από διαφορετικές θέσεις trocars για την τεχνική διευκόλυνση ολοκλήρωσης των διαφόρων λαπαροσκοπικών βημάτων. Άλλοι προτιμούν τη χρήση trocars 5mm και την τοποθέτηση μόνο ενός μεγάλου διαμετρήματος trocar (12mmHg) στη δεξιά κοιλιακή χώρα, από όπου θα εισαχθεί το ενδοσκοπικό συρραπτικό, εάν, βεβαίως αυτό χρειαστεί κατά την επέμβαση. Εάν χρησιμοποιηθούν απλά αιμοστατικοί αγκτήρες για την απολίνωση των αγγείων του μεσοκόλου, τότε απαιτείται η τοποθέτηση αναλόγου μεγέθους trocar (5 ή 10mm), ανάλογα με το εργαλείο λαπαροσκοπικών clips που θα χρησιμοποιηθεί.
Πολλοί επίσης προτιμούν την τοποθέτηση των trocars εκτός της μέσης γραμμής (π.χ. στο αριστερό άνω και κάτω τεταρτημόριο της κοιλίας και στη δεξιά παραομφάλια χώρα- η τομή για το τελευταίο θα επεκταθεί στο τέλος της επέμβασης για την αφαίρεση του παρασκευάσματος). Πάντως η τοποθέτηση των trocars εξαρτάται από την εμπειρία και τις προτιμήσεις του χειρουργού, τη θέση του όγκου και την ανατομική κατασκευή του ασθενούς. Επιπλέον 5mm trocars μπορούν να τοποθετηθούν πάντα κατά την επέμβαση, για τη διευκόλυνση της έλξης και την αποκάλυψη των ιστών. Ο κανόνας που προτείνεται από τους περισσότερους, ωστόσο, είναι η τοποθέτηση να γίνεται κατά τρόπο αμφιθεατρικό πέριξ της βλάβης και τα trocars εργασίας να «βλέπουν» την περιοχή που εργάζεται ο χειρουργός, ενώ το λαπαροσκόπιο να βρίσκεται ανάμεσα σε αυτά και σε επαρκή απόσταση, στην κορυφή ενός νοητού τριγώνου, του οποίου οι άλλες δύο γωνίες είναι τα trocars εργασίας (triangulation).
Eκτιμάται η εξαιρεσιμότητα του όγκου και αποφεύγονται οι χειρισμοί επί του τμήματος του ανιόντος κόλου που φέρει τον όγκο. Η χειρουργική τράπεζα στρέφεται προς τα αριστερά και ο ασθενής τοποθετείται σε θέση αντί-Trendelenburg, για την καλύτερη δυνατή έκθεση του δεξιού κόλου. Το λεπτό έντερο απομακρύνεται προς τα αριστερά με ατραυματικές λαβίδες συλλήψεως. Συλλαμβάνεται το δεξιό μεσόκολο στο ύψος του τυφλού και χαράσσεται το περιτόναιο που το καλύπτει με ψαλίδι υπερήχων ή με μονοπολική διαθερμία προσαρτημένη πάνω σε λαπαροσκοπικό ψαλίδι ή άγκιστρο διατομής. Αποκαλύπτεται η ειλεοκολική αρτηρία και φλέβα και απολινώνονται, κατά προτίμηση χωριστά, με τη χρήση ενδοσκοπικού κοπτοσυρραπτικού οπλισμένου με αγγειακή κεφαλή staples (35mm) ή με ενδοσκοπικούς αιμοστατικούς αγκτήρες (clips). Η απολίνωση γίνεται όσο το δυνατόν κοντά στην έκφυση της ειλεοκολικής από την άνω μεσεντέριο αρτηρία και για αυτό το λόγο η αποκάλυψή της πρέπει να είναι πλήρης με διάνοιξη του μεσοκολικού παραθύρου κεφαλικά με κατεύθυνση προς το δωδεκαδάκτυλο. Μετά την απολίνωση των ειλεοκολικών διανοίγεται το ανάγγειο πλάνο ανάμεσα στο μεσόκολο προς το κοιλιακό τοίχωμα του ασθενούς και το οπισθοπεριτοναϊκό λίπος προς τη ράχη του ασθενούς. Εκεί αναγνωρίζεται και η οπισθοπεριτοναϊκή πορεία του δεξιού ουρητήρα. Στο 50% των ασθενών ανευρίσκονται τα δεξιά κολικά αγγεία κοντά στην έκφυση της ειλεοκολικής, τα οποία και απολινώνονται παρόμοια.
Η παρασκευή συνεχίζεται προς την 3η μοίρα του δωδεκαδακτύλου και προς τη ρίζα του εγκαρσίου μεσοκόλου. Η παρασκευή γίνεται προσεκτικά και αμβλέως έως ότου φανεί το δωδεκαδάκτυλο, το οποίο προσεκτικά διαχωρίζεται από την οπισθοπεριτοναϊκή πλευρά της ηπατικής κολικής καμπής. Ο δεξιός κλάδος της μέσης κολικής αρτηρίας ανγνωρίζεται και απολινώνεται. Στο στάδιο αυτό το δεξιό κόλον και το μεσόκολον του είναι απελευθερωμένα από το οπισθοπεριτόναιο και τις αγγειακές τους προσφύσεις. Το παρασκεύασμα συγκρατείται από τη δεξιά πλάγια πτυχή του τοιχωματικού περιτοναίου (γραμμή Toldt) και το γαστροκολικό σύνδεσμο του δεξιού εγκαρσίου κόλου. Το τελευταίο διανοίγεται και επιτυγχάνεται η είσοδος στον ελάσσονα επιπλοϊκό θύλακο ύπερθεν και όπισθεν του εγγύς εγκαρσίου με προσοχή να αποφευχθεί οποιοσδήποτε τραυματισμός στο παρακείμενο δωδεκάδακτυλο.
Η ηπατική καμπή έλκεται προς τα αριστερά και διαχωρίζεται από τις συμφύσεις της με το πλάγιο κοιλιακό τοίχωμα. Ολοκληρώνεται η απελεύθερωση όλου του ανιόντος από το πλάγιο κοιλιακό τοίχωμα με παρασκευή του κατά μήκος της δεξιάς γραμμής του Τoldt. Mετά την πλήρη κινητοποίηση του δεξιού κόλου και του μεσοκόλου, το ευκίνητο, πια, παρασκεύασμα εξωτερικεύεται από μικρή εγκάρσια λαπαροστομία στο δεξιό κοιλιακό τοίχωμα ή από μικρή υπερ-υπο-ομφάλια τομή. Το τραύμα της τομής καλύπτεται από ειδικό πλαστικό κάλυμμα, το οποίο, ανάλογα με την τεχνική κατασκευή του μπορεί να λειτουργήσει και ως διαστολέας της τομής. Η διατομή του τελικού ειλεού και του εγκαρσίου κόλου (αν και αυτή εκτελείται με ενδοσκοπικά συρραπτικά ενδοπεριτοναϊκά, πριν τη μικρή λαπαροτομία από κάποιους χειρουργούς) εκτελείται συνήθως εξωκοιλιακά. Η ειλεο-εγκαρσία αναστόμωση επίσης εκτελείται εξωκοιλιακά, συνήθως με αυτόματα συρραπτικά εργαλεία της «ανοικτής» χειρουργικής.
Aριστερή κολεκτομή
Ο ασθενής τοποθετείται σε τροποποιημένη θέση λιθοτομής με τους μηρούς σε σχεδόν οριζόντια θέση. Το δεξιό άνω άκρο σταθεροποιείται κατά μήκος του κορμού του ασθενούς. Το αρχικό 10mm trocar τοποθετείται υπερομφαλίως για την εγκατάσταση του πνευμοπεριτοναίου και την εισαγωγή του λαπαροσκοπίου πλαγίας οράσεως. Ένα από τα δύο trocars που τοποθετούνται στη δεξιά πλάγια κοιλιακή χώρα είναι μεγάλης διαμέτρου (12mm) για τη μετέπειτα εισαγωγή του ενδοσκοπικού κοπτορράπτη. Τουλάχιστον ένα trocar 5-10mm εισάγεται στην αριστερή πλάγια κοιλιακή χώρα, το οποίο χρησιμοποιείται από τον 1ο βοηθό για την έλξη του αριστερού κόλου, αλλά και από το χειρουργό, σαν trocar εργασίας, κατά την κινητοποίηση της σπληνικής καμπής, που γίνεται ως επί το πλείστον με το χειρουργό να στέκεται ανάμεσα στα πόδια του ασθενούς. Βοηθητικά 5mm trocars μπορούν τα τοποθετηθούν στο επιγάστριο κατά τη μέση γραμμή ή και στο δεξιό υποχόνδριο. Αυτά χρησιμοποιούνται από το 2ο βοηθό- χειριστή κάμερας για να ασκήσουν έλξη προς τα μέσα της σπληνικής καμπής, του άπω εγκαρσίου ή κεφαλική έλξη επί του μείζονος επιπλόου, κατά τη φάση της κινητοποίησης της σπληνικής καμπής.
Αρχικά ο χειρουργός και ο χειριστής του λαπαροσκοπίου στέκονται στη δεξιά πλευρά και ο 1ος βοηθός στα αριστερά του ασθενούς. Μετά τη λαπαροσκοπική σταδιοποίηση, που περιλαμβάνει πλήρη επισκόπηση της περιτοναϊκής κοιλότητας, την εκτίμηση της εξαιρέσιμότητας του όγκου (αποκλεισμός διήθησης κατά συνέχεια ιστών παρακείμενων του όγκου οργάνων), τον αποκλεισμό περιτοναϊκών εμφυτεύσεων και την εκτίμηση της ηπατικής επιφάνειας, ακόμη και του παρεγχύματος του με το λαπαροσκοπικό υπερηχοτομογράφημα, οι έλικες του λεπτού εντέρου απομακρύνονται από την πύελο, προς τα δεξιά και κεφαλικά με τη χρήση ατραυματικών λαβίδων. Συγκρατούνται, με τη βοήθεια της βαρύτητας, μακριά από το κατιόν κόλον και το ορθοσιγμοειδές με τη στροφή του ασθενούς σε θέση Trendelenburg.
Ο 1ος βοηθός έλκει το μεσοσιγμοειδές κεφαλικά και προς τα αριστερά και ο χειρουργός χαράσσει το περιτόναιο του μεσοσιγμοειδούς στα δεξιά της περιτοναϊκής πτυχής που δημιουργείται από την κάτω μεσεντέρια αρτηρία, στο ύψος της ιεράς ακρολοφίας. Με οξεία και αμβλεία παρασκευή διαχωρίζει το μεσοσιγμοειδές προς τα πάνω από το οπισθοπεριτόναιο προς τα κάτω έως την ανεύρεση του αριστερού ουρητήρα που βρίσκεται στη βάση του μεσοσιγμοειδούς και διασταυρώνεται με τα αριστερά λαγόνια αγγεία. Ο ουρητήρας και τα οπισθοπεριτοναϊκά, επίσης, ευρισκόμενα γοναδικά αγγεία αφήνονται προς τα κάτω, ενώ τα μεσοσιγμοειδικά αγγεία συγκρατούνται προς τα πάνω. Διευρύνεται το μεσοκολικό παράθυρο δεξιά και αριστερά της κάτω μεσεντερίου κατά μήκος της αορτής, με διαφύλαξη του συμπαθητικού προαορτικού νευρικού πλέγματος. Η κάτω μεσεντέριος απολινώνεται 1- 2 εκ από την εκφυσή της από την αορτή.
Η παρασκευή του μεσοκόλου του κατιόντος κόλου συνεχίζεται προς τα πάνω, με φορά προς το σύνδεσμο του Treitz. Το μεσόκολον εδώ είναι ανάγγειο, εκτός από τη θέση κάτω από την ουρά του παγκρέατος, όπου ανευρίσκεται η κάτω μεσεντέριος φλέβα, η οποία και απολινώνεται. Διαχωρίζεται το κινητοποιημένο μεσόκολον από την περιτονία του Gerota στο ύψος του αριστερού νεφρού, έως τη σπληνική καμπή. Το κινητοποιημένο μεσόκολον και το αριστερό κόλον έτσι διαχωρίζονται από τις οπισθοπεριτοναϊκές δομές (μέση προς πλάγια προσπέλαση) και συγκρατούνται πλέον από την πλάγια περιτοναϊκή ανάκαμψη, κατά μήκος της γραμμής του Τoldt.
Ο χειρουργός συλλαμβάνει το σιγμοειδές και το έλκει προς τα δεξιά, δηλαδή προς τη μέση γραμμή. Ταυτόχρονα ο 1ος βοηθός ασκεί αντίθετη έλξη στην περιτοναϊκή ανάκαμψη προς τα αριστερά και έτσι καθίσταται δυνατή η διατομή της με κεφαλική φορά κατά μήκος του σιγμοειδούς και του κατιόντος κόλου ως τη σπληνική καμπή. Ιδιαίτερη προσοχή δίνεται πάλι στην αποφυγή τραυματισμού των οπισθοπεριτοναϊκών στοιχείων (ουρητήρα- λαγονίων).
Ακολουθεί η φάση της κινητοποίησης της σπληνικής καμπής. Η σπληνική καμπή προσεγγίζεται καλύτερα με παρασκευή κατά μήκος και ύπερθεν της άπω, αριστερής μοίρας του εγκαρσίου κόλου. Με κεφαλική ανάσπαση του μείζονος επιπλόου και ουραία έλξη του εγκαρσίου, παρασκευάζεται το ανάγγειο πλάνο του γαστροκολικού συνδέσμου και επιτυγχάνεται η είσοδος στον ελάσσονα επιπλοϊκό θύλακο πάνω από το πάγκρεας. Η διατομή συνεχίζεται αφήνοντας το σπλήνα προς το αριστερό υποχόνδριο, ενώ τελευταία διατέμνεται ο σπληνοκολικός σύνδεσμος, προκειμένου την τελική απελευθέρωση και κινητοποίηση της σπληνικής καμπής.
Με τη χρήση του ενδοσκοπικού κοπτορράπτη το ανώτερο ορθό διατέμνεται. Διενεργείται μικρή τομή 3- 4 εκ υπερηβικά (κάθετη ή τύπου Pfennastiel), στο αριστερό ή στο δεξιό λαγόνιο βόθρο, από όπου εξωτερικεύεται το παρασκεύασμα. Η κολεκτομή διενεργείται εξωσωματικά και στο εγγύς κολόβωμα του εντέρου τοποθετείται η κεφαλή του κυκλικού αναστομωτήρα. Το κολόβωμα του παχέος εντέρου εισάγεται στην κοιλιά και η μικρή λαπαροτομία συγκλείεται. Επανεγκαθίσταται το πνευμοπεριτόναιο. Ο κυκλικός αναστομωτήρας εισάγεται διορθικά και, υπό λαπαροσκοπική όραση συνδέεται με την κεφαλή του κολοβώματος του κόλου. Μετά την πυροδότηση του ολοκληρώνεται η κολοορθική αναστόμωση.
Χαμηλή πρόσθια και κοιλιοπερινεϊκή εκτομή
Ολοκληρώνονται οι φάσεις της κινητοποίησης του μεσοκόλου, του διαχωρισμού του από το οπισθοπεριτόναιο και η απολίνωση των μεσεντερίων αγγείων, όπως περιγράφηκαν στην αριστερή κολεκτομή. Η πυελική κινητοποίηση του ορθού ξεκινά με την ανάσπαση της οθοσιγμοειδικής περιοχής προς το κοιλιακό τοίχωμα από το χειρουργό και τον 1ο βοηθό. Η οπίσθια περιτοναϊκή ανάκαμψη, στο επίπεδο της ιεράς ακρολοφίας διανοίγεται και λαμβάνει χώρα η είσοδος στον οπισθο-ορθικό χώρο. Αναγνωρίζονται τα υπογάστρια νεύρα του ανώτερου συμπαθητικού πυελικού πλέγματος, τα οποία επικάθονται επί του ιερού σε ένα επίπεδο όπισθεν της αρχής της ιδίως περιτονίας του μεσοορθού. Το πλάνο παρασκευής βρίσκεται μπροστά από το εν λόγω νευρικό πλέγμα.
Πριν από την έναρξη της μεσοορθικής εκτομής, το περιτόναιο χαράσσεται και από τις δύο πλευρές του ανώτερου ορθού στα πλάγια και εμπρός κατά μήκος της πρόσθιας περιτοναϊκής ανάκαμψης, του επιπέδου, δηλαδή, μετάπτωσής στο μέσο τριτημόριο του ορθού. Η μεσοορθική παρασκευή, πρώτα ολοκληρώνεται πίσω από το ορθό. Η οπίσθια μεσοορθική εκτομή συνίσταται στην κινητοποίηση κατά μήκος του ανάγγειου πλάνου του προϊερού χώρου, ανάμεσα στην τοιχωματική ενδοπυελική προϊερά περιτονία και την ιδίως περιτονία του μεσοορθού (σπλαγχνικό πέταλο της ενδοπυελικής περιτονίας).
Τα υπογάστρια συμπαθητικά νεύρα, μετά την ιερά ακρολοφία, «ταξιδεύουν» προσθιο-πλάγια, 2 εκ επί τα εντός της κατώτερης μοίρας των ουρητήρων. Η λαπαροσκοπική παρασκευή, με τη μεγέθυνση που προσφέρει, βοηθά σημαντικά στην αναγνώριση των νευρικών πλεγμάτων της πυέλου και της μεσοορθικής εκτομής με ακρίβεια, έτσι ώστε να φυλάσσεται ακέραια η ιδίως περιτονία του μεσοορθού και να αποφεύγεται η είσοδος στο μεσοορθικό λίπος. Η οξεία παρασκευή συνεχίζεται προς το πυελικό έδαφος, έως το σημείο συνάντησης του μεσοορθού με το πυελικό αυτόνομο νευρικό πλέγμα, το οποίο βρίσκεται οπισθοπλάγια. Το πυελικό (κατώτερο υπογάστριο) πλέγμα αποτελείται από τη σύντηξη των υπογαστρίων συμπαθητικών νεύρων και των παρασυμπαθητικών ινών από τις Ι2- Ι4 πρόσθιες νευρικές ρίζες. Σε αυτό ακριβώς το επίπεδο το μεσοορθό πρέπει να διαχωριστεί προσεκτικά από το πυελικό νευρικό πλέγμα, το οποίο πρέπει να διαφυλαχθεί, εκτός από τους κλάδους του που οδεύουν απευθείας στο ορθό, οι οποίοι και μπορούν να θυσιαστούν. Στο επίπεδο του 4ου ιερού σπονδύλου, ο οπισθοϊερός σύνδεσμος (περιτονία Waldeyer) διατέμνεται οξέως. Η κινητοποίηση οπισθίως ολοκληρώνεται με την ανεύρεση των μυών του πυελικού εδάφους.
Η πρόσθια κινητοποίηση διενεργείται μετά τη διάνοιξη του ορθοκυστικού ή ορθοκολπικού χώρου, προς τα κάτω, μπροστά από την περιτονία Denonvillier, με πρόσθια έλξη του προστάτη και των σπερματοδόχων κύστεων στον άνδρα και του κόλπου στις γυναίκες, από τον 1ο βοηθό. Οπισθοπλάγια των σπερματοδόχων κύστεων βρίσκεται η συνέχεια του υπεύθυνου για την ουρογεννητική λειτουργία πυελικού πλέγματος. Η διαίρεση του ορθού γίνεται 2 εκ, τουλάχιστον, κάτω από την κακοήθη βλάβη, με τη βοήθεια ενός ενδοσκοπικού ευθύγραμμου συρραπτικού με αρθρούμενη κεφαλή μήκους 45mm, η οποία τοποθετείται σε κάθετη γωνία με το τοίχωμα του ορθού.
Η κινητοποίηση της σπληνικής καμπής, η αφαίρεση του παρασκευάσματος και η δημιουργία της κολο-ορθικής ή κολο-πρωκτικής αναστόμωσης γίνεται παρόμοια με την αριστερή κολεκτομή.
Στην περίπτωση που διενεργείται κοιλιοπερινεϊκή εκτομή, μετά την κινητοποίηση του κατιόντος κόλου και του ορθού, διατέμνεται το παχύ έντερο στο επίπεδο της αρχής του σιγμοειδούς με τη βοήθεια του ενδοσκοπικού κοπτορράπτη. Διενεργείται ο περινεϊκός χρόνος της εκτομής του πρωκτού, όπως και στη συμβατική επέμβαση, και, όλο το παρασκεύασμα διεκβάλλεται και αφαιρείται από το περίνεο. Μετά τη σύγκλειση της περινεϊκής τομής, επανεγκαθίσταται το πνευμοπεριτόναιο, συλλαμβάνεται το κολόβωμα του κόλου και φέρεται στο πλάγιο κοιλιακό τοίχωμα, από όπου εξωτερικεύεται για τη δημιουργία της μόνιμης κολοστομίας.
Αποτελέσματα
Η ανάγκη αξιολόγησης των ογκολογικών αποτελεσμάτων και της επιβεβαίωσης της ογκολογικής επάρκειας των λαπαροσκοπικών κολεκτομών σε σύγκριση με τις «ανοικτές» οδήγησε στη διενέργεια αρκετών τυχαιοποιημένων κλινικών μελετών, ήδη από τις αρχές της δεκαετίας του 1990. Το 2004 δημοσιεύθηκαν τα απώτερα ογκολογικά αποτελέσματα μιας μεγάλης πολυκεντρικής τυχαιοποιημένης μελέτης από τις ΗΠΑ, της μελέτης COST (Clinical Outcomes of Surgical Therapy). Τα απώτερα αποτελέσματα από δύο μεγάλες Ευρωπαϊκές μελέτες, την πανευρωπαϊκή μελέτη COLOR (Colon Carcinoma Laparoscopic or Open Resection) και τη Βρετανική μελέτη MRC-CLASSIC (Μedical Research Council Conventional versus Laparoscopic-Assisted Surgery in Colorectal Cancer) επιβεβαίωσαν την ογκολογική ισοδυναμία της λαπαροσκοπικής με την «ανοικτή» κολεκτομή για καρκίνο.
Όσον αφορά τα άμεσα, μετεγχειρητικά αποτελέσματα, αρκετές κλινικές μελέτες που συνέκριναν τις κλασσικές με τις λαπαροσκοπικές κολεκτομές βρήκαν υπολογίσιμες διαφορές στο μετεγχειρητικό πόνο, στην επαναφορά της εντερικής λειτουργίας και στη διάρκεια της νοσηλείας. Έτσι, στη χρήση της μετεγχειρητικής αναλγησίας υπήρξαν μικρές, αλλά σημαντικές διαφορές στην ανάγκη για ναρκωτικά αναλγητικά. Στη μελέτη COST οι ασθενείς που υποβλήθηκαν σε κλασσικές κολεκτομές χρειάστηκαν ενδοφλέβια ναρκωτικά αναλγητικά για 4 ημέρες, κατά μέσο όρο, ενώ αυτοί που τυχαιοποιήθηκαν στην εκτέλεση λαπαροσκοπικών επεμβάσεων για 3,2 ημέρες (p<0,001). Γενικά η επιστροφή της εντερικής λειτουργίας, όπως αυτή μετράται έως τη στιγμή εμφάνισης παραγωγής αερίων είναι ταχύτερη κατά 1 ημέρα μετά τις λαπαροσκοπικές κολεκτομές. Επίσης, η μελέτη COST αναφέρει τη μείωση τη μείωση της ενδονοσοκομειακής νοσηλείας κατά 1 ημέρα, ενώ οι Ευρωπαϊκές μελέτες κατά 2 ημέρες. Οι τυχαιοποιημένες μελέτες δεν έχουν βρει διαφορές στη χειρουργική θνητότητα. Το ίδιο φαίνεται να συμβαίνει και όσον αφορά τη νοσηρότητα, με εξαίρεση τη μονοκεντρική μελέτη τη; Βαρκελώνης του Lacy, όπου οι επιπλοκές μετά τις «ανοικτές» κολεκτομές ήταν σημαντικά περισσότερες από αυτές μετά τις λαπαροσκοπικές (p= 0,001).
Το ενδιαφέρον των μελετών επικεντρώθηκε σημαντικά στην ογκολογική επάρκεια των λαπαροσκοπικώνν κολεκτομών. Τόσο στην πολυκεντρική μελέτη COST, όσο και στις μονοκεντρικές συγκριτικές μελέτες των Milsom και συν και Lacy και συν δεν αναφέρθηκαν διαφορές στα χειρουργικά όρια εκτομής και στον αριθμό των αφαιρεθέντων λεμφαδένων. Τα δεδομένα που υπάρχουν σήμερα υποστηρίζουν την άποψη ότι η συχνότητα των υποτροπών μετά τις λαπαροσκοπικές και τις «ανοικτές» κολεκτομές είναι παρόμοια. Οι αρχικοί φόβοι για κακοήθεις υποτροπές στις θέσεις των trocars δεν επιβεβαιώθηκαν. Στη μελέτη COST τα ποσοστά υποτροπής ήταν παρόμοια και στις δύο ομάδες ασθενών (0,5% στην ομάδα της λαπαροσκοπικής κολεκτομής έναντι 0,2% σε αυτή της «ανοικτής»). Η μελέτη των Lacy και συν πιστοποίησαν 1 μόνο υποτροπή στις θέσεις των trocars, ενώ η μελέτη του Leung από το Hong Kong δεν αναφέρει καμία υποτροπή και στις δύο ομάδες ασθενών. Η μελέτη του Hong Kong και αυτή της COST κατέληξαν ότι τα ποσοστά των τοπικο-περιοχικών υποτροπών είναι συγκρίσιμα μεταξύ των δύο ειδών εκτομών.
Οι Lacy και συν από την Ισπανία, ωστόσο, βρήκαν μια τάση για χαμηλότερη επίπτωση ογκολογικών υποτροπών στην ομάδα της λαπαροσκοπικής προσπέλασης (17% έναντι 27%, p= 0,007). Oι μη τυχαιοποιημένες μελέτες των αρχών της δεκαετίας του 1990 δεν κατέληξαν στην παρουσία κάποιας διαφοράς όσον αφορά τη συνολική επιβίωση των ασθενών. Στην Ισπανική μελέτη των Lacy και συν, ωστόσο, και, κατά την ανάλυση των υποομάδων των ασθενών ανάλογα με το στάδιο, ανεβρέθηκε σημαντική διαφορά υπέρ της λαπαροσκοπικής προσέγγισης στους ασθενείς σταδίου ΙΙΙ. Αυτά τα αποτελέσματα δεν επαληθεύθηκαν από τις άλλες μελέτες. Μάλιστα, η μελέτη COST κατέληξε στο ότι η συνολική 3-ετής επιβίωση είναι παρόμοια ανάμεσα στους ασθενείς που υποβάλλονται σε λαπαροσκοπικές και σε συμβατικές κολεκτομές. Γενικά σήμερα, υπάρχει συμφωνία μεταξύ των ειδικών ότι η λαπαροσκοπική κολεκτομή είναι ογκολογικά επαρκής και μπορεί να προσφέρεται στους ασθενείς με καρκίνο του παχέος εντέρου αντί της κλασσικής κολεκτομής.
Βιβλιογραφία
1. Finlayson E, Nelson H. Laparoscopic colectomy for cancer. Am J Clin Oncol. 2005 Oct;28(5):521-5.
2. Veldkamp R, Gholghesaei M, Bouvy ND, Kazemier G, Bonjer HJ. Laparoscopic resection of colonic cancer. Scand J Surg. 2003;92(1):97-103
3. Weeks JC, Nelson H, Gelber S, Sargent D, Schroeder G; Clinical Outcomes of Surgical Therapy (COST) Study Group. Short-term quality-of-life outcomes following laparoscopic-assisted colectomy vs open colectomy for colon cancer: a randomized trial. JAMA. 2002 Jan 16;287(3):321-8.
4. Chang GJ, Nelson H. Laparoscopic colectomy. Curr Gastroenterol Rep. 2005 Oct;7(5):396-403.
5. Larson DW, Nelson H. Laparoscopic colectomy for cancer. J Gastrointest Surg. 2004 Jul-Aug;8(5):636-42.
6. Bloomston M, Kaufman H, Winston J, Arnold M, Martin E. Surgical management of colorectal cancer in the laparoscopic era: a review of prospective randomized trials. J Natl Compr Canc Netw. 2005 Jul;3(4):517-24.
7. Paraskeva PA, Aziz O, Darzi A. Laparoscopic surgery for colon cancer. Surg Clin North Am. 2005 Feb;85(1):49-60.
8. Barlehner E, Benhidjeb T, Anders S, Schicke B. Laparoscopic surgery for colon and rectal cancer. Surg Technol Int. 2004;13:93-9.
9. Sim R, Milsom JW. Laparoscopic colectomy for malignancy. Semin Laparosc Surg. 2000 Jun;7(2):101-17.
10. Veldkamp R, Gholghesaei M, Bonjer HJ, Meijer DW, Buunen M, Jeekel J, Anderberg B, Cuesta MA, Cuschierl A, Fingerhut A, Fleshman JW, Guillou PJ, Haglind E, Himpens J, Jacobi CA, Jakimowicz JJ, Koeckerling F, Lacy AM, Lezoche E, Monson JR, Morino M, Neugebauer E, Wexner SD, Whelan RL; European Association of Endoscopic Surgery (EAES). Laparoscopic resection of colon Cancer: consensus of the European Association of Endoscopic Surgery (EAES). Surg Endosc. 2004 Aug;18(8):1163-85. Epub 2004 Jun 23.
11. COLOR Study Group. COLOR: a randomized clinical trial comparing laparoscopic and open resection for colon cancer. Dig Surg. 2000;17(6):617-622.
12. Tisminezky B, Nelson H. Laparoscopic approach to colon cancer. Adv Surg. 2000;34:67-119
13. Stocchi L, Nelson H. Wound recurrences following laparoscopic-assisted colectomy for cancer. Arch Surg. 2000 Aug;135(8):948-58.
14. Davies MM, Larson DW. Laparoscopic surgery for colorectal cancer: the state of the art. Surg Oncol. 2004 Aug-Nov;13(2-3):111-8.
15. Lacy AM, Garcia-Valdecasas JC, Delgado S, Castells A, Taura P, Pique JM, Visa J. Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomised trial.Lancet. 2002 Jun 29;359(9325):2224-9.
16. Leung KL, Kwok SP, Lam SC, Lee JF, Yiu RY, Ng SS, Lai PB, Lau WY. Laparoscopic resection of rectosigmoid carcinoma: prospective randomised trial. Lancet. 2004 Apr 10;363(9416):1187-92.
Στον καρκίνο του παχέος εντέρου το 95% αφορά σποραδικές περιπτώσεις ενώ στο 5% υπάρχει κάποιου είδους κληρονομικότητα που μπορεί να μεταβιβάζεται με επικρατή ή υπολειπόμενο χαρακτήρα. Το πιο συχνά παρατηρούμενο σύνδρομο είναι το Lynch που χαρακτηρίζεται από καρκίνους του παχέος εντέρου, του ενδομητρίου και διάφορους άλλους όγκους (1). Το σύνδρομο αυτό προκαλείται από μεταλλαγές στα γονίδια επιδιόρθωσης του DNA (MLH1, MSH2, MSH6 και PMS2). Η οικογενής αδενωματώδης πολυποδίαση παρατηρείται στο 1% των περιπτώσεων καρκίνου του παχέος εντέρου (2) και χαρακτηρίζεται από την ανάπτυξη εκατοντάδων έως χιλιάδων αδενωματωδών πολυπόδων στο παχύ έντερο ενώ συχνά παρατηρούνται και εξωεντερικές εκδηλώσεις της νόσου. Η πιθανότητα κακοήθους εξαλλαγής κάποιου εκ των πολυάριθμων πολυπόδων και ανάπτυξης καρκίνου σε νεαρή ηλικία αγγίζει το 100% (3).
Στο 8% των οικογενειών περιγράφεται μια ήπια μορφή του συνδρόμου με ανάπτυξη μικρότερου αριθμού πολυπόδων στο παχύ έντερο και σε μεγαλύτερη ηλικία (attenuated FAP) (4). Το σύνδρομο της οικογενούς αδενωματώδους πολυποδίασης μεταβιβάζεται κατά τον αυτοσωμικό επικρατή χαρακτήρα και προκαλείται από μεταλλαγές του γονιδίου APC (Adenomatous Polyposis Coli), το οποίο παίζει σημαντικό ρόλο στην κυτταρική αύξηση. Σχετικά πρόσφατα ανακαλύφθηκε ένα επιπλέον γονίδιο του οποίου οι μεταλλαγές προκαλούν πολυποδίαση, το MUTYH, και η πολυποδίαση που σχετίζεται με το συγκεκριμένο γονίδιο μεταβιβάζεται με τον αυτοσωμικό υπολειπόμενο χαρακτήρα (5).
Οικογενής αδενωματώδης πολυποδίαση (Familial adenomatous polyposis – FAP)
Η οικογενής αδενωματώδης πολυποδίαση έχει επίπτωση 1 ανά 10000 γεννήσεις και προκαλείται από μεταλλαγές του γονιδίου APC. Το 15-20% αυτών αφορούν πρωτοεμφανιζόμενες περιπτώσεις καθώς δεν εντοπίζονται σε προηγούμενες γενεές (6). Η κλινική εκδήλωση του συνδρόμου περιλαμβάνει την ανάπτυξη εκατοντάδων πολυπόδων στο παχύ έντερο κατά τη διάρκεια της παιδικής και εφηβικής ηλικίας. Εάν δεν αντιμετωπισθούν χειρουργικά θα αναπτυχθεί καρκίνος του παχέος εντέρου μέχρι την ηλικία των 40-50 ετών.
Στο 8% των ασθενών εμφανίζεται μια ηπιότερη μορφή του συνδρόμου με μικρότερο αριθμό πολυπόδων στο έντερο και καθυστερημένη ηλικία εμφάνισης αυτών. Στο 5% περίπου των ασθενών αναπτύσσονται και πολύποδες στο ανώτερο γαστρεντερικό σύστημα και κυρίως στο δωδεκαδάκτυλο, οι οποίοι εάν δεν αντιμετωπισθούν μπορούν να οδηγήσουν σε καρκίνο. Στο 10-15% των περιπτώσεων αναπτύσσονται δεσμοειδείς όγκοι που αν και είναι καλοήθεις δύναται να συμπεριφέρονται επιθετικά λόγω αύξησης του όγκου τους και πίεσης παρακείμενων ζωτικής σημασίας ιστών. Οι εξωεντερικές εκδηλώσεις του συνδρόμου της οικογενούς αδενωματώδους πολυποδίασης συνοψίζονται στον Πίνακα 1.
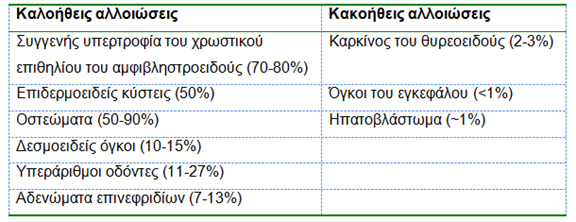
Πίνακας 1.
Εξωεντερικές εκδηλώσεις οικογενούς αδενωματώδους πολυποδίασης
Η βασική διάγνωση του συνδρόμου γίνεται κλινικά με την ανεύρεση περισσοτέρων από 100 πολυπόδων στο παχύ έντερο των ασθενών. Όσον αφορά την κλινική διάγνωση της ηπιότερης μορφής του συνδρόμου, εδώ υπάρχουν μεγαλύτερες δυσκολίες. Πρόσφατα διαγνωστικά κριτήρια περιλαμβάνουν: α) τουλάχιστον 2 ασθενείς με 10-99 πολύποδες σε ηλικία άνω των 30 ετών, β) 1 ασθενής με 10-99 πολύποδες σε ηλικία άνω των 30 ετών και 1 πρώτου βαθμού συγγενής με καρκίνο του παχέος εντέρου και λίγους πολύποδες. Άλλοι ερευνητές έχουν προτείνει (10): α) κληρονομικότητα με επικρατή χαρακτήρα, β) παρουσία 3-99 πολυπόδων σε ηλικία άνω των 20 ετών.
Στο 70% των ασθενών με τυπική οικογενή αδενωματώδη πολυποδίαση ανιχνεύονται μεταλλαγές του γονιδίου APC, ενώ στην ηπιότερη μορφή του συνδρόμου το ποσοστό φθάνει μόλις το 25% (4). Σε όλους τους ασθενείς πρέπει να δίνεται γενετική καθοδήγηση καθώς όταν ανιχνευθεί η μεταλλαγή στο γονίδιο APC πρέπει να ακολουθεί προληπτικός έλεγχος στους πρώτου βαθμού συγγενείς. Τα μέλη της οικογένειας που εντοπίζονται να φέρουν τη μεταλλαγή πρέπει να εντάσσονται σε πρόγραμμα παρακολούθησης από την εφηβική ηλικία.
Στον Πίνακα 2 συνοψίζονται οι κατευθυντήριες οδηγίες αντιμετώπισης τόσο του τυπικού συνδρόμου όσο και της ήπιας μορφής αυτού.

Πίνακας 2:
Πρωτόκολλο παρακολούθησης του εντέρου σε ασθενείς με οικογενή πολυποδίαση
Η εκτομή του παχέος εντέρου με πολυποδίαση πριν οι πολύποδες εξαλλαχθούν είναι ιδιαίτερα σημαντική καθώς μειώνονται η νοσηρότητα και θνητότητα που σχετίζονται με την ανάπτυξη καρκίνου. Όσον αφορά την επέμβαση εκλογής για τους ασθενείς με πολυποδίαση πρέπει να σημειωθεί ότι οι δύο κύριες επιλογές είναι από τη μια μεριά η αφαίρεση του παχέος εντέρου και ειλεο-ορθική αναστόμωση και από την άλλη η πρωκτοκολεκτομή με ειλεο-πρωκτική αναστόμωση και δημιουργία ειλεϊκής ληκύθου. Η πρώτη επέμβαση είναι σαφώς πιο εύκολη από τη δεύτερη, η οποία είναι τεχνικά πολύ πιο απαιτητική. Οι επιπλοκές σπανίζουν και η κινητικότητα του εντέρου μετεγχειρητικά είναι πολύ καλή. Η εκτεταμένη χειρουργική προσπέλαση της δεύτερης επιλογής έχει τον κίνδυνο της αιμορραγίας, της κάκωσης των πυελικών νεύρων και της υπογονιμότητας (7).
Η πρωκτοκολεκτομή πρέπει να επιλέγεται όταν υπάρχει μεγάλος αριθμός (>15-20) αδενωμάτων στο ορθό. Αντίθετα, όταν οι πολύποδες στο ορθό είναι λίγοι ή λείπουν εντελώς τότε και οι δύο επιλογές είναι δυνατές. Το είδος της μεταλλαγής στο γονίδιο APC παίζει καθοριστικό ρόλο στον αριθμό των πολυπόδων του εντέρου. Σε μελέτη ανασκόπησης πάνω στο θέμα αυτό βρέθηκε ότι μεταλλαγές στα κωδικόνια 1250-1464 του APC και ειδικότερα στο κωδικόνιο 1309 σχετίζονται με σοβαρή νόσο, ενώ αντίθετα μεταλλαγές στα ακραία κωδικόνια του γονιδίου και σε θέσης εναλλακτικού ματίσματος του εξωνίου 9 οδηγούν σε ήπιο φαινότυπο (8). Τα παραπάνω οδήγησαν στην πρόταση να γίνεται επιλογή της χειρουργικής επέμβασης με βάση το γενετικό έλεγχο αυτών των ατόμων. Έτσι, ασθενείς με αναμενόμενη σοβαρή νόσο πρέπει να υποβάλλονται σε πρωκτοκολεκτομή ώστε να αποφύγουν συμπληρωματική εκτομή του ορθού αν υποτροπιάσουν μετά από απλή κολεκτομή και ειλεο-ορθική αναστόμωση.
Άλλοι παράγοντες που πρέπει να λαμβάνονται υπόψη είναι η γονιμότητα και η ανάπτυξη δεσμοειδών όγκων. Η πρωκτοκολεκτομή έχει συσχετισθεί με μεγαλύτερα ποσοστά υπογονιμότητας σε γυναίκες με πολυποδίαση και γι΄αυτό πρέπει να αποφεύγεται σε νεαρές γυναίκες αναπαραγωγικής ηλικίας που επιθυμούν να τεκνοποιήσουν. Σε ασθενείς με ιστορικό δεσμοειδών όγκων ή μεταλλαγή στο κωδικόνιο 1444 του APC πρέπει να επιλέγεται εξαρχής η πρωκτοκολεκτομή καθώς έχουν μεγάλη πιθανότητα ανάπτυξης τέτοιων όγκων και η μετατροπή από απλή κολεκτομή και ειλεο-ορθική αναστόμωση σε πρωκτοκολεκτομή μπορεί να είναι δύσκολη λόγω βράχυνσης του μεσεντερίου (9). Παρόλα αυτά, άλλοι ερευνητές πιστεύουν ότι η μεταλλαγή στο 1444 μπορεί να σχετίζεται και με ήπιο φαινότυπο και η πρωκτοκολεκτομή να είναι υπερβολική. Οι ασθενείς με πρωκτοκολεκτομή μπορεί να αναπτύξουν αδενώματα ή ακόμα και καρκίνο στη ειλεϊκή λήκυθο, και γι΄αυτό απαιτείται παρακολούθηση ανά 6-12 μήνες (10).
Αν και τα μη στεροειδή αντιφλεγμονώδη φάρμακα δεν αντικαθιστούν τη χειρουργική αντιμετώπιση του συνδρόμου της οικογενούς αδενωματώδους πολυποδίασης, εντούτοις μπορεί να παίζουν σημαντικό ρόλο στην αναβολή της χειρουργικής επέμβασης ασθενών με ήπια πολυποδίαση του παχέος εντέρου ή ασθενών με πολυποδίαση του ορθού μετά από προηγούμενη κολεκτομή. Μπορούν επίσης να χρησιμοποιηθούν σε ασθενείς που δεν επιθυμούν χειρουργική επέμβαση ή σε εκείνους με εκτεταμένους δεσμοειδείς όγκους. Το πρώτο φάμακο που αποδείχτηκε αποτελεσματικό στους ασθενείς αυτούς ήταν η σουλινδάκη (11). Η μακροχρόνια θεραπεία με σουλινδάκη ελαττώνει τον αριθμό των αδενωμάτων του παχέος εντέρου περισσότερο από 50% καθώς και του υπολειπόμενου τμήματος ορθού στους ασθενείς που έχουν υποβληθεί σε κολεκτομή και ειλεο-ορθική αναστόμωση.
Το 1990 αναπτύχθηκαν οι εκλεκτικοί COX-2 (cyclo-oxygenase-2) αναστολείς που εμφάνιζαν λιγότερες ανεπιθύμητες ενέργειες εκ του γαστρεντερικού από τα κλασσικά μη στερεοειδή αντιφλεγμονώδη φάρμακα. Ένας από αυτούς τους αναστολείς, η σελεκοξίμπη, βρέθηκε να ελαττώνει κατά 28% τον αριθμό των αδενωμάτων του παχέος εντέρου και του ορθού (12). Σε αντίθεση με τη σουλινδάκη, η σελεκοξίμπη μειώνει ακόμα και τον αριθμό των αδενωμάτων του δωδεκαδακτύλου.
Αδενωματώδης πολυποδίαση σχετιζόμενη με το γονίδιο MUTYH
Το 2002 αναφέρθηκε η σημασία της ανεπαρκούς επιδιόρθωσης βάσεων του DNA στον κληρονομικό καρκίνο του παχέος εντέρου και ορθού (5). Oμόζυγες μεταλλαγές του γονιδίου MUTYH έχουν αναδειχθεί στο 26-29% των ασθενών με 10-100 πολύποδες και στο 7-29% των ασθενών με 100-1000 πολύποδες (13). Ασθενείς με περισσότερους από 10 πολύποδες πρέπει να παραπέμπονται για γενετική καθοδήγηση και να πραγματοποιείται έλεγχος μεταλλαγών του γονιδίου MUTYH. Οι μεταλλαγές του συγκεκριμένου γονιδίου συνήθως σχετίζονται με ήπιο φαινότυπο πολυποδίασης. Μέχρι σήμερα, κακοήθεια του εντέρου και εξωτεντερικές αλλοιώσεις σχετιζόμενες με οικογενή αδενωματώδη πολυποδίαση όπως είναι ο δωδεκαδακτυλικός καρκίνος, οστεώματα και συγγενής υπετροφία του χρωστικού επιθηλίου του αμφιβληστροειδούς έχουν μόνο σποραδικά αναφερθεί σε ασθενείς με πολυποδίαση σχετιζόμενη με το MUTYH. Το προτεινόμενο πρωτόκολλο παρακολούθησης ασθενών με σχετιζόμενη με μεταλλαγές του MUTYH πολυποδίαση είναι παρόμοιο με αυτό των ασθενών με την ήπια μορφή του συνδρόμου της οικογενούς πολυποδίασης.
Όσον αφορά την καταλληλότερη χειρουργική αντιμετώπιση της πολυποδίασης σε αυτούς τους ασθενείς πρέπει αν σημειωθεί οτι ο ήπιος φαινότυπος με μικρό αριθμό αδενωμάτων καθιστά δυνατή σε αρκετούς ασθενείς την ενδοσκοπική αφαίρεση των πολυπόδων. Αν απαιτείται μείζονα χειρουργική επέμβαση, στις περισσότερες των περιπτώσεων αυτή είναι η ολική κολεκτομή και ειλεο-ορθική αναστόμωση για να περιοριστεί ο κίνδυνος ανάπτυξης καρκίνου. Στην περίπτωση που υπάρχει σοβαρή πολυποδίαση στο ορθό προτείνεται ολική πρωκτοκολεκτομή και ειλεο-πρωκτική αναστόμωση.
Σύνδρομο Lynch
Οι ασθενείς που φέρουν μεταλλαγή στα γονίδια επιδιόρθωσης του DNA εμφανίζουν υψηλό κίνδυνο ανάπτυξης καρκίνου του παχέος εντέρου, του ενδομητρίου και μιας σειράς άλλων νεοπλασμάτων που συνοψίζονται στον Πίνακα 3 (14, 15). Οι καρκίνοι αυτοί εντοπίζονται σε νεαρή ηλικία και μπορεί να είναι σύγχρονοι.

Πίνακας 3:
Δια βίου κίνδυνος ανάπτυξης διαφόρων τύπων καρκίνου σε ασθενείς με μεταλλαγή στα γονίδια επιδιόρθωσης του DNA
Η βλάβη στα γονίδια επιδιόρθωσης οδηγεί κατά την αντιγραφή σε λάθη σε επαναλαμβανόμενες αλληλουχίες του DNA που καλούνται μικροδορυφορικό DNA. Το φαινόμενο αυτό ονομάζεται μικροδορυφορική αστάθεια και παρατηρείται στο 90% των καρκίνων του παχέος εντέρου που σχετίζονται με το σύνδρομο Lynch και μόλις στο 15% των σποραδικών καρκίνων. Με ανοσοϊστοχημική ανάλυση των πρωτεϊνών που παράγονται από τα γονίδια επιδιόρθωσης μπορεί να αναδειχθεί απώλεια της έκφρασης και να εντοπισθεί το υπεύθυνο γονίδιο.
Το 1989 διατυπώθηκαν στο Άμστερνταμ ορισμένα κριτήρια ένταξης των συγκεκτιμένων οικογενειών στο σύνδρομο Lynch (16). Τα κριτήρια αυτά αναθεωρήθηκαν τo 1999 ώστε να περιλαμβάνουν και τις εξωεντερικές εκδηλώσεις της νόσου (17). Το 1997 προτάθηκαν τα κριτήρια της Bethesda με στόχο να καθορίζονται τα άτομα που πρέπει να υποβάλλονται σε έλεγχο μικροδορυφορικής αστάθειας (18, 19). Τα κριτήρια αυτά αναθεωρήθηκαν το 2004 (20). Με βάση τα κριτήρια αυτά έχει αναγνωρισθεί μια μεγάλη ομάδα οικογενειών που εντάσσονται στο σύνδρομο Lynch. Πρέπει να σημειωθεί ότι η ονομασία κληρονομικός μη πολυποδιακός καρκίνος του παχέος εντέρου (Hereditary Non Polyposis Colorectal Cancer – HNPCC) που προτάθηκε στο Άμστερνταμ το 1989 σταδιακά εγκαταλείφθηκε, καθώς δεν περιελάμβανε τους όγκους σε άλλα όργανα που συχνά παρατηρούνται. Έτσι καθιερώθηκε η ονομασία σύνδομο Lynch.
Σήμερα, για την επιλογή των ασθενών με καρκίνο παχέος εντέρου που θα ελεγχθούν για ύπαρξη μοριακών αλλαγών ή εκείνων με μικροδορυφορική αστάθεια που θα ελεγχθούν για μεταλλαγές στα γονίδια επιδιόρθωσης χρησιμοποιούνται τα κριτήρια του Άμστερνταμ ΙΙ ή τα αναθεωρημένα κριτήρια της Bethesda (Πίνακες 4, 5).

Πίνακας 4:
Κριτήρια του Άμστερνταμ ΙΙ

Πίνακας 5:
Αναθεωρημένα κριτήρια της Bethesda
Ο αριθμός των χρησιμοποιούμενων δεικτών μικροδορυφορικής αστάθειας ποικίλλει από 1 έως άνω των 10. Για την ανοσοϊστοχημεία χρησιμοποιούνται κυρίως δύο αντισώματα (MLH1 και MSH2), αλλά υπάρχουν και μελέτες που χρησιμοποιούν 3 ή 4 αντισώματα (MLH1, MSH2 MSH6 και PMS2). Στις μελέτες όπου εφαρμόστηκαν ταυτόχρονα και προοπτικά τόσο η μικροδορυφορική αστάθεια όσο και η ανοσοϊστοχημεία, η ευαισθησία της πρώτης αποδείχθηκε ελαφρώς μεγαλύτερη από τη δεύτερη. Το πλεονέκτημα της ανοσοϊστοχημείας είναι ότι μπορεί να υποδεικνύει την ακριβή γονιδιακή βλάβη από το είδος της παρατηρούμενης χρώσης. Για αυτό το λόγο οι περισσότεροι ερευνητές προτείνουν τη μέθοδο αυτή ως τη βασική για τον πρωταρχικό έλεγχο οικογενειών με πιθανή μεταλλαγή στα γονίδια επιδιόρθωσης του DNA (π.χ. οικογένειες που καλύπτουν τα κριτήρια του Άμστερνταμ). Λόγω της μεγαλύτερης ευαισθησίας της μικροδορυφορικής αστάθειας, αυτή προτείνεται σε περιπτώσεις με υψηλή πιθανότητα συνδρόμου Lynch αλλά φυσιολογική παρατηρούμνεη έκφραση των πρωτεϊνών επιδιόρθωσης. Στις υπόλοιπες περιπτώσεις έγκειται στην εμπειρία του κάθε κέντρου για το ποιά μέθοδος ανίχνευσης βλαβών στα γονίδια επιδιόρθωσης θα εφαρμοστεί (Σχήμα 1).
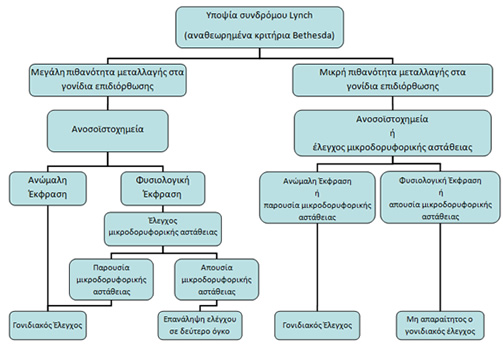
Σχήμα 1.
Στρατηγική αναγνώρισης ασθενών με καρκίνο του παχέος εντέρου και μεταλλαγή στα γονίδια επιδιόρθωσης του DNA
Η παρακολούθηση των ασθενών του συνδρόμου πρέπει να ξεκινά μεταξύ 20 και 25 ετών και να συνεχίζεται δια βίου εάν η κατάσταση της υγείας του ατόμου το επιτρέπει. Όσον αφορά τα μεσοδιαστήματα παρακολούθησης του εντέρου στο σύνδρομο Lynch, έχει αποδειχθεί ότι η εξέταση ανά τριετία είναι σε μεγάλο βαθμό αποτελεσματική. Δεδομένου όμως των προχωρημένων σταδίων του καρκίνου που εντοπίζεται στις συγκεκριμένες οικογένειες προτείνεται η παρακολούθηση να γίνεται ανά 1-2 έτη. Η αξία της παρακολούθησης για τον καρκίνο του ενδομητρίου δεν μπορεί ακόμα με ακρίβεια να προσδιοριστεί. Η γυναικολογική εξέταση, το διακολπικό υπερηχογράφημα και η βιοψία από την ηλικία των 30 ως 35 ετών μπορεί να οδηγήσουν στη διαγνωση προκαρκινικών αλλοιώσεων και πρώιμου σταδίου καρκίνων. Η προφυλακτική υστερεκτομή και σαλπιγγο-ωοθηκεκτομή αποτελούν αξιόλογες επιλογές για τις γυναίκες με σύνδρομο Lynch καθώς ελαττώνουν δραστικά την ανάπτυξη καρκίνου στα συγκεκριμένα όργανα.
Στον Πίνακα 6 συνοψίζονται οι κατευθυντήριες οδηγίες παρακολούθησης των οικογενειών με σύνδρομο Lynch. Οι οδηγίες αυτές έχουν ένδειξη σε οικογένειες με γνωστή μεταλλαγή στα γονίδια επιδιόρθωσης καθώς και σε οικογένειες με συσσώρευση περιστατικών καρκίνου παχέος εντέρου ή άλλων σχετιζόμενων καρκίνων και υποψία βλάβης του συστήματος επιδιόρθωσης (παρουσία μικροδορυφορικής αστάθειας ή απώλεια της έκφρασης των γονιδίων επιδιόρθωσης).
Πίνακας 6:
Πρωτόκολλο παρακολούθησης ασθενών με σύνδρομο Lynch ή οικογενειών με συσσώρευση κρουσμάτων καρκίνου παχέος εντέρου
Πολλαπλές μελέτες έχουν δείξει ότι ασθενείς με σύνδρομο Lynch έχουν αυξημένο κίνδυνο ανάπτυξης σύγχρονων και μετάχρονων καρκίνων του παχέος εντέρου. Γι’ αυτό το λόγο είναι σημαντικός ο έλεγχος ολόκληρου του παχέος εντέρου πριν την εκτομή ενός όγκου καθώς υπάρχει κίνδυνος ύπαρξης σύγχρονου όγκου. Λόγω του αυξημένου κινδύνου ανάπτυξης δεύτερου όγκου πρέπει να εξετάζεται το ενδεχόμενο της υφολικής κολεκτομής και ειλεο-ορθικής αναστόμωσης σε νέους ασθενείς.
Οι μελέτες δείχνουν ότι δεν υπάρχει όφελος σε αυτούς τους ασθενείς από τη θεραπεία με 5-φθοριο-ουρακίλη. Μία μικρή μελέτη σε ασθενείς με καρκίνο παχέος εντέρου σταδίου IV αναφέρει πλήρη ή μερική απάντηση στη θεραπεία με ιρινοτεκάνη.
Ενδεικτική βιβλιογραφία
1. Vasen HF, Moslein G, Alonso A, et al. Guidelines for the clinical management of Lynch syndrome (hereditary non-polyposis cancer). J Med Genet 2007;44:353–62.
2. Bulow S. Results of national registration of familial adenomatous polyposis. Gut 2003;52:742–6.
3. Cruz-Correa M, Giardiello FM. Familial adenomatous polyposis. Gastrointest Endosc 2003;58:885–94.
4. Nielsen M, Hes FJ, Nagengast FM, et al. Germline mutations in APC and MUTYH are responsible for the majority of families with attenuated familial adenomatous polyposis. Clin Genet 2007;71:427–33.
5. Al-Tassan N, Chmiel NH, Maynard J, et al. Inherited variants of MYH associated with somatic G:CRT:A mutations in colorectal tumors. Nat Genet 2002;30:227–32.
6. Aretz S, Uhlhaas S, Caspari R, et al. Frequency and parental origin of de novo APC mutations in familial adenomatous polyposis. Eur J Hum Genet 2004;12:52–8.
7. Aziz O, Athanasiou T, Fazio VW, et al. Meta-analysis of observational studies of ileorectal versus ileal pouch–anal anastomosis for familial adenomatous polyposis. Br J Surg 2006;93:407–17.
8. Nieuwenhuis MH, Vasen HF. Correlations between mutation site in APC and phenotype of familial adenomatous polyposis (FAP): a review of the literature. Crit Rev Oncol Hematol 2007;61:153–61.
9. Olsen KO, Juul S, Bulow S, et al. Female fecundity before and after operation for familial adenomatous polyposis. Br J Surg 2003;90:227–31.
10. Wu JS, McGannon EA, Church JM. Incidence of neoplastic polyps in the ileal pouch of patients with familial adenomatous polyposis after restorative proctocolectomy. Dis Colon Rectum 1998;41:552–6.
11. Cruz-Correa M, Hylind LM, Romans KE, et al. Long-term treatment with sulindac in familial adenomatous polyposis: a prospective cohort study. Gastroenterology 2002;122:641–5.
12. Steinbach G, Lynch PM, Phillips RK, et al. The effect of celecoxib, a cyclooxygenase-2 inhibitor, in familial adenomatous polyposis. N Engl J Med 2000;342:1946–52.
13. Sieber OM, Lipton L, Crabtree M, et al. Multiple colorectal adenomas, classic adenomatous polyposis, and germ-line mutations in MYH. N Engl J Med 2003;348:791–9.
14. Lynch HT, Chapelle de la A. Hereditary colorectal cancer. N Engl J Med 2003;348:919–32.
15. Al Tassan N, Chmiel NH, Maynard J, Fleming N, Livingston AL, Williams GT, Hodges AK, Davies DR, David SS, Sampson JR, Cheadle JP. Inherited variants of MYH associated with somatic G:CRT:A mutations in colorectal tumors. Nat Genet 2002;30:227–32.
16. Vasen HF, Mecklin JP, Khan PM, Lynch HT. The International Collaborative Group on Hereditary Non-Polyposis Colorectal Cancer (ICG-HNPCC). Dis Colon Rectum 1991;34:424–5.
17. Vasen HF, Watson P, Mecklin JP, Lynch HT. New clinical criteria for hereditary nonpolyposis colorectal cancer (HNPCC, Lynch syndrome) proposed by the International Collaborative group on HNPCC. Gastroenterology 1999;116:1453–6.
18. Rodriguez-Bigas MA, Boland CR, Hamilton SR, Henson DE, Jass JR, Khan PM, Lynch H, Perucho M, Smyrk T, Sobin L, Srivastava S. A National Cancer Institute Workshop on Hereditary Nonpolyposis Colorectal Cancer Syndrome: meeting highlights and Bethesda guidelines. J Natl Cancer Inst 1997;89:1758–62.
19. Boland CR, Thibodeau SN, Hamilton SR, Sidransky D, Eshleman JR, Burt RW, Meltzer SJ, Rodriguez-Bigas MA, Fodde R, Ranzani GN, Srivastava S. A National Cancer Institute Workshop on Microsatellite Instability for cancer detection and familial predisposition: development of international criteria for the determination of microsatellite instability in colorectal cancer. Cancer Res 1998;58:5248–57.
20. Umar A, Boland CR, Terdiman JP, Syngal S, de la CA, Ruschoff J, Fishel R, Lindor NM, Burgart LJ, Hamelin R, Hamilton SR, Hiatt RA, Jass J, Lindblom A, Lynch HT, Peltomaki P, Ramsey SD, Rodriguez-Bigas MA, Vasen HF, Hawk ET, Barrett JC, Freedman AN, Srivastava S. Revised Bethesda Guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl Cancer Inst 2004;96:261–8.
Σύγχρονα δεδομένα ενισχύουν την άποψη ότι ο καρκίνος του ορθού, αν και τις περισσότερες φορές μελετάται και αναλύεται στα πλαίσια των κακοηθειών που προσβάλουν ολόκληρο το παχύ έντερο, διαφέρει από τον καρκίνο του κόλου, όσον αφορά την παθογένεια, την επιδημιολογία του, αλλά, κυρίως, τη στρατηγική της θεραπευτικής αντιμετώπισής του. Κεντρικό ρόλο στην τελευταία εξακολουθεί να διαδραματίζει η ριζική χειρουργική αφαίρεση της πρωτοπαθούς εστίας και των περιοχικών λεμφαδένων, καθώς και η επιμελής αποφυγή της διεγχειρητικής απώλειας αποφολιδούμενων καρκινικών κυττάρων από τον αφαιρούμενο όγκο μέσα στο χειρουργικό πεδίο της πυέλου.
Η χειρουργική θεραπεία του ορθικού καρκινώματος έχει εξελιχθεί σημαντικά από το 1908, όταν ο Ernest Miles περιέγραφε την κοιλιοπερινεϊκή εκτομή. Ο Miles, στην αναφορά του από το 1926, κατάφερε να μειώσει το ποσοστό υποτροπής από σχεδόν 100% στο 30%. Έτσι η τεχνική Miles, δηλαδή η κοιλιοπερινεϊκή εκτομή αποτέλεσε το «χρυσό κανόνα» και τη χειρουργική μέθοδο εκλογής του καρκίνου του ορθού για αρκετές δεκαετίες.
Η έκταση της ριζικότητας της επέμαβασης, τα, παρ’όλα αυτά, υψηλά ποσοστά τοπικών υποτροπών και οι σοβαρές διαταραχές της ουρογεννητικής και γαστρεντερικής λειτουργίας οδήγησαν στην επινόηση και την καθιέρωση των σφιγκτηροδιασωστικών επεμβάσεων ως μεθόδων αντιμετώπισης της πλειονότητας των καρκίνων του ορθού. Σε αυτή την τάση, που άρχισε να επικρατεί και να καθιερώνεται από τη δεκαετία του 1950, βοήθησαν σημαντικά η καλύτερη ποιότητα του υλικού των ραμμάτων, αλλά, κυρίως, η ανάπτυξη και η τελειοποίηση, αργότερα, των ειδικών συρραπτικών μηχανημάτων, τα οποία, με τη σειρά τους, επέτρεψαν τη διενέργεια «χαμηλών» κολο-ορθικών και κολο-πρωκτικών αναστομώσεων, προκειμένου την αποκατάσταση της εντερικής συνέχειας και τη διάσωση του σφιγκτηριακού μηχανισμού.
Η διατήρηση του σφιγκτήρα και, κατ’επέκτασιν του πρωκτικού αυλού δημιούργησε ανησυχία όσον αφορά την ογκολογική επάρκεια τέτοιων προσεγγίσεων, κυρίως στα καρκινώματα του μέσου και κατώτερου ορθού και την πιθανότητα αύξησης των τοπικών υποτροπωνν στην πύελο. Σε ασθενείς, ωστόσο, που υποβλήθηκαν σε χαμηλή πρόσθια εκτομή κατά τη δεκαετία του 1960 αναφέρθηκαν χαμηλά ποσοστά υποτροπής της τάξεως του 8%.
Αντί της αφαίρεσης του πρωκτού και των περιβαλλόντων σφιγκτήρων και ισχιοορθικού λίπους για τη βελτίωση της ογκολογικής ριζικότητας, όπως υποστηρίχθηκε από τον Miles, δύο άλλες παράμετρες επικράτησαν ως σημαντικότερτες στην εκτέλεση μιας ογκολογικά ορθής εκτομής: η εξασφάλιση επαρκώς υγειών περιφερικών (distal) και πλευρικών- περιμετρικών (lateral- circumferential) ορίων εκτομής. Όσον αφορά το άπω όριο εκτομής, ο γνωστός κανόνας των τουλάχιστoν 5 εκατοστών περιφερικά του όγκου, ο οποίος και επικράτησε ως αρχή κατά τις δεκαετίες του 1960-70, αντικαταστάθηκε από την ιστοπαθολογική γνώση ότι η ενδοτοιχωματική περιφερική επέκταση, μικροσκοπικά, σπάνια, ξεπερνά τα 1-2 εκατοστά, ενώ η τοπικο-περιοχική υποτροπή και η επιβίωση δεν βελτιώνονται με την αύξηση του περιφερικού ορίου εκτομής πέραν των 2 εκατοστών. Από την άλλη πλευρά, ήδη από το 1943 ο Dukes τόνισε ότι τα καρκινώματα του ορθού επεκτείνονται περισσότερο προς τα πλάγια με άμεση διήθηση του περιβάλλοντος μεσοορθικού λίπους και λιγότερο περιφερικότερα εντός του αυλού του εντέρου. Η επίτευξη επαρκούς περιμετρικού ορίου εκτομής με την αφαίρεση του πλαγίως ευρισκομένου μεσοορθού καθίσταται αυτομάτως πρωτεύουσας σημασίας στη σωστή ογκολογική θεραπεία του καρκίνου του ορθού. Η λεμφαγγειακή διασπορά ακολουθεί επίσης πορεία ουραιο-κρανιακή, δηλαδή ανάστροφα και κεντρικά και όχι προς τους περιπρωκτικούς χώρους, ενώ τα λεμφαγγεία βρίσκονται μέσα στο μεσοορθό με αποροή στους λεμφαδένες της άνω αιμορροϊδικής και της έσω λαγονίου. Οι αρχικές παρατηρήσεις έγιναν από τον Moynihan το 1908, αλλά και έχουν επιβεβαιωθεί από σύχρονες λεμφοσπινθηρογραφικές μελέτες.
Προκείμενου να αντιμετωπιστεί το φαινόμενο του καθόλου ευκαταφρόνητου ποσοστού τοπικών υποτροπών μετά τη χειρουργική θεραπεία, το 1990 το Εθνικό Ινστιτούτο Υγείας των ΗΠΑ συνέστησε την εφαρμογή συμπληρωματικής χημειο- και ακτινο-θεραπείας σε καρκινώματα σταδίου Τ3 και Ν1, δηλαδή σταδίου ΙΙ και ΙΙΙ. Όπως ήταν φυσικό, δημιουργήθηκε το ερώτημα αν οι χειρουργικές τεχνικές και ο τρόπος παρασκευής του και εκτομής του ορθού ήταν ανεπαρκείς και η χορήγηση της επικουρικής θεραπείας ερχόταν να καλύψει τις ογκολογικές ατέλειες που προέκυπταν από τη μη τεχνικά άρτια χειρουργική θεραπεία.
Στο γνωσιολογικό υπόβαθρο των παρατηρήσεων που έγιναν μέσα στον 20ο αιώνα και στο κλινικό υπόστρωμα των κατ’εξακολούθηση αξιόλογων ποσοστών υποτροπής στον καρκίνο του ορθού, ο Willam Heald από το Basingstoke της Μεγάλης Βρεττανίας υιοθέτησε, περιέγραψε με ακρίβεια και θεμελίωσε την «Ολική Μεσοορθική Εκτομή» (Total Mesorectal Excision, TME), ως τη σύγχρονη μέθοδο εκλογής στη χειρουργική θεραπεία του ορθού. Η αρχική εμπειρία του Heald με την προσεκτική εφαρμογή της ολικής μεσοορθικής εκτομής σε 100 ασθενείς ανέδειξε μηδενικά ποσοστά τοπικών υποτροπών, χωρίς μάλιστα την παροχή δυνητικού οφέλους από τη χορήγηση μετεγχειρητικής ακτινοθεραπείας. Περαιτέρω ανεξάρτητη ανάλυση από αυτή την προοπτικά μελετηθείσα σειρά ασθενών επιβεβαίωσε το μικρό για τον καρκίνο του ορθού ποσοστό 5ετούς τοπικής υποτροπής του 4%.
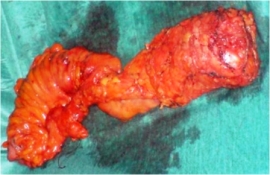
Παρά την αναπαραγωγή συγκρίσιμων κλινικών αποτελεσμάτων σε άλλες κλινικές σειρές, η χρήση της αρχικά και για αρκετά χρόνια παρέμεινε μάλλον αντιφατική. Δεν προκαλεί μάλιστα έκπληξη το γεγονός ότι, για την περιγραφή της ίδιας τεχνικής, χρησιμοποιήθηκαν και άλλες επωνυμίες, όπως περιμετρική (circumferential), οξεία μεσοορθική, εξωπεριτονιϊκή (extrafascial) εκτομή του ορθού, ολική ανατομική παρασκευή (total anatomic dissection), κλπ. Σε σύσκεψη ομοφωνίας που έλαβε χώρα to 1999 στη Washington των ΗΠΑ (Tripartite Consensus Meeting) διευκρινίστηκε σημασιολογικά, ότι η ολική μεσοορθική εκτομή αποκαλείται η πλήρης αφαίρεση του σπλαγχνικού μεσοορθικού ιστού έως το επίπρδο των ανελκτήρων στην ελάσσονα πύελο. Με μια σειρά κατευθυντήριων οδηγιών, η ολική μεσοορθική εκτομή αποτελεί σήμερα τη μέθοδο εκλογής για τη χειρουργική θεραπεία των καρκινωμάτων του μέσου και κατώτερου τριτημορίου του ορθού σε πολλές Ευρωπαϊκές χώρες και στις ΗΠΑ.
Ανατομική βάση του μεσοορθού
Η έννοια της ολικής μεσοορθικής εκτομής βασίστηκε στην προτίμηση του καρκίνου του ορθού για τις τοπικο-περιοχικές υποτροπές. Η “en block” κάθαρση του ορθικού «μεσεντερίου» με την αιμάτωσή του και τη λεμφική αποχέτευσή του θα ελαχιστοποιούσε την πιθανότητα υποτροπών. Στην πραγματικότητα ο όρος «μεσοορθό» δεν είναι ανατομικά σωστός, αφού στην κλασσική νομενκλατούρα της μακροσκοπικής ανατομικής η πρόθεση «μέσο-» αναφέρεται σε διπέταλη περιτοναϊκή πτυχή που συνδέει σπλάγχνο με σωματικό τοίχωμα. Το ορθό δεν περιβάλλεται από πραγματικό «μεσεντέριο», όπως το υπόλοιπο παχύ έντερο, αλλά από λιπώδες περίβλημα, το οποίο σχετίζεται με το ορθό μέχρι το επίπεδο του ανελκτήρα και περιέχει την άνω ορθική αρτηρία και τους κλάδους της, λεμφαγγεία και λεμφαδένες κατά μήκος της άνω ορθικής αρτηρίας, κλάδους του κάτω μεσεντερίου πλέγματος που νευρώνουν το ορθό και χαλαρό συνδετικό ιστό. Αυτό ακριβώς το «περιορθικό διάστημα» ορίζεται ως «μεσοορθό». Οι εμβρυολόγοι, μάλιστα, περιγράφουν με τον όρο «ραχιαίο μεσοορθό» το τμήμα του περιορθικού μεσεγχύματος οπισθίως του ορθού. Το μεσοορθό είναι ένα διακριτό διαμέρισμα προερχόμενο από το μεσέγχυμα του εμβρυολογικού οπισθίου εντέρου. Από το τελευταίο προκύπτει η κλοάκα, κατά την εμβρυολογική ανάπτυξη. Το μέσο και κάτω τριτημόριο του ορθού και η ουροδόχος κύστη έχουν κοινή καταγωγή από την εμβρυολογική κλοάκα.
Το μεσοορθό περιβάλλεται από την ιδίως μεσοορθική περιτονία, που αποτελεί συνέχεια της σπλαγχνικής ενδοπυελικής περιτονίας. Είναι διακριτό πέταλο, η adventitia του ορθού, όπως συμβαίνει στα οπισθοπεριτοναϊκά όργανα. Περιβάλλει το μεσοορθό οπισθίως και, συνεπώς βρίσκεται μπροστά από τον οπισθοορθικό χώρο και την προϊερά περιτονία. Η τελευταία αποτελεί τη συνέχεια της τοιχωματικής ενδοπυελικής περιτονίας. Ανάμεσα στη μεσοορθική και την πποϊερά περιτονία, δηλαδή ανάμεσα στα δύο πέταλα της ενδοπυελικής περιτονίας, δεν ανευρίσκεται τίποτα εκτός από χαλαρό, ανάγγειο συνδετικό ιστό.
Πλαγίως η μεσοορθική περιτονία περιβάλλει το ορθό και τους «πλαγίους συνδέσμους». Οι τελευταίοι δεν είναι σύνδεσμοι, αλλά ο πλάγιος μεσοορθικός ιστός, ο οποίος αντιστοιχεί στην περιοχή ταυτόσημης εμβρυολογικής αρχής του προσθιοπλάγιου τοιχώματος του ορθού και του οπισθίου τοιχώματος της κύστης ή, με άλλα λόγια, στη θέση ύπαρξης των ορθικών κλάδων από το κάτω υπογάστριο πλέγμα και των σπανίως διακριτών και ασταθώς υπαρχόντων (σε πολύ μικρότερο ποσοστό από τη γενικότερη πεποίθηση πολλών χειρουργών) μέσων αιμορροϊδικών αγγείων.
Η προς τα κάτω πάχυνση των πετάλων της ενδοπυελικής περιτονίας αποτελεί την ορθοϊερά περιτονία Waldayer. Προσθίως, μπροστά από την πρόσθια προέκταση της μεσοορθικής περιτονίας, ξεκινώντας από το ύψος του μέσου τριτημορίου του ορθού, υπάρχει η περιτονία του Denonvilliers, η οποία αποτελεί την προς τα κάτω προέκταση της προσθίας περιτοναϊκής ανάκαμψης που εξαλείφεται με την επικόλληση των δύο τοιχωμάτων του εμβρυολογικού cul-de-sac και συνεχίζεται ως ορθοκυστικό διάφραγμα (Εικόνα 1).
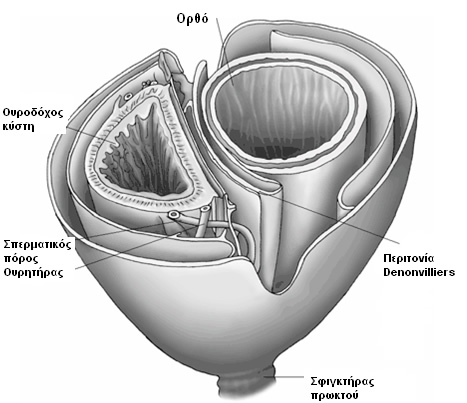
Εικόνα 1
Ανατομικές και τεχνικές αρχές της ολικής μεσοορθικής εκτομής
Η υπόθεση στην οποία βασίστηκε ο Heald ήταν ότι το μεσοορθό αποτελεί αναπόσπαστο τμήμα του ορθού μέσα στον εμβρυολογικό «φάκελο» του οπισθίου εντέρου και, έτσι, το «εμβρυολογικό» του πλεονέκτημα είναι το ότι προσφέρει προστασία ενάντια στη διασπορά κακρινικών κυττάρων εκτός του ορθού έως και τα προχωρημένα στάδια της νόσου. Σημαντική προϋπόθεση για την επιτυχία της τεχνικής είναι η σχολαστική, οξεία παρασκευή ολόκληρου του μεσοορθού οπισθίως και πλαγίως κατά μήκος του ανάγγειου πλάνου που βρίσκεται μεταξύ της μεσοορθικής και της προϊεράς περιτονίας. Ο Heald αποκαλεί αυτό το εμβρυολογικό πλάνο “holy plane” (Εικόνα 2).
Οι αμβλείες κινήσεις με σχηματισμό κώνου προς τα κάτω πρέπει να αποφεύγονται. Ο λόγος είναιι ότι τέτοιες «τυφλές» κινήσεις με τα δάκτυλα ή το χέρι μπορεί να διασπάσουν τη μεσοορθική περιτονία και να αυξήσουν την πιθανότητα ιατρογενούς εξωορθικής διασποράς καρκινικών κυττάρων. Η οξεία οπίσθια παρασκευή ολοκληρώνεται προς τα κάτω στο επίπεδο του ορθοπρωκτικού δακτυλίου, στο σημείο όπυ το κατώτερο τμήμα του μεσοορθού απελευθερώνεται με την αφαίρεση της λεγόμενης «άπω μεσοορθικής γλωσσοειδούς προσεκβολής» (“distal mesorectal tongue”). Όπως αναφέρεται και στην αρχική δημοσίευση του Heald από το 1982, η αφαίρεση ολόκληρου του μεσοορθού, συμπεριλαμβανομένης και της προεκτασής του προς το κατώτερο σημείο της πυέλου, είναι σημαντική γιατί μεταστατικές μικροεναποθέσεις ή αλλοιώς καρκινικές εμφυτεύσεις (metastatic deposits) ανευρίσκονται μέσα στο μεσοορθό σε θέσεις άπω της πρωτοπαθούς ενδοαυλικής εστίας. Μεταγενέστερες παθολογοανατομικές μελέτες από τους Scott (1995) και Reynolds (1996) έδειξαν ότι το ποσοστό τέτοιων εμφυτεύσεων ανέρχεται στο 20% και ότι βρίσκονται σε απόσταση έως 3 και έως 5 εκατοστών, αντίστοιχα για τις δύο αυτές ανεξάρτητες μελέτες, προς τα κάτω του πρωτοπαθούς όγκου (Εικόνα 3).
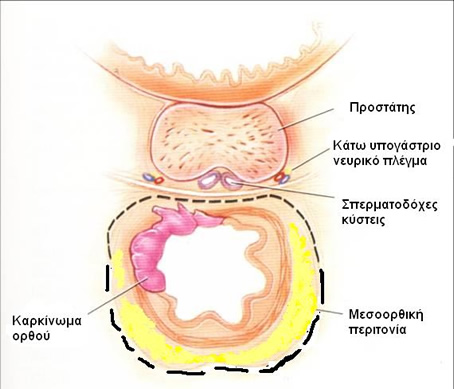
Εικόνα 2
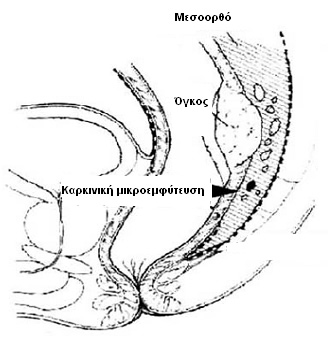
Εικόνα 3
Τέτοιες πολύ χαμηλές πρόσθιες εκτομές (ultra-low anterior resections) μπορεί να αυξήσουν τα ποσοστά διαφυγών και των διαταραχών των κενώσεων και θα ήταν υπερβολή να χρησιμοποιούνται για όλους ανεξαιρέτως τους καρκίνους του ορθού, συμπεριλαμβανομένων και αυτών του άνω τριτημορίου. Μια λογική προσέγγιση είναι η κινητοποίηση του μεσοορθού σε απόσταση περίπου 5 εκατοστών περιφερικά του όγκου, εκτομή του μεσοορθού και του ορθού στο επίπεδο αυτό και, ακολούθως η διενέργεια της αναστόμωσης. Η ομάδα από τη Mayo Clinic ορίζει την προσέγγιση αυτή ως «ειδική του όγκου» (“tumor-specific”) και αναφέρει παρόμοια ποσοστά υποτροπής, με χαμηλότερη νοσηρότητα. Η ομάδα του Heald έχει υιοθετήσει την ίδια προσέγγιση για τους όγκους του ανώτερου ορθού. Πάντως, για τους καρκίνους που εντοπίζονται στο μέσο και άπω ορθό, συστήνεται η πλήρης αφαίρεση του μεσοορθού έως το επίπεδο των ανελκτήρων.
Η ολική μεσοορθική εκτομή χαρακτηρίζεται ως χειρουργική επέμβαση «προσανατολισμένη στο ιστολογικό παρασκεύσμα» (“specimen-oriented surgery”). Αναμφίβολα η πλήρης αφαίρεση του μεσοορθού ελαττώνει σημαντικά την τοπική υποτροπή. Ο Philip Quirke, παθολογοανατομός από το Πανεπιστήμιο του Leeds, ο οποίος ηγείται της μελέτης MRC-CR07 επισήμανε πόσο σημαντική είναι η κυκλοτερώς πλήρης αφαίρεση του μεσοορθού. Όρισε τρία επίπεδα εκτομής του μεσοορθού: Το επίπεδο 3 (Grade 3), που σημαίνει ότι η επιφάνεια του μεσοορθού είναι λεία, έχει παρασκευασθεί και αφαιρεθεί πλήρως χωρίς ελλείψεις και ανωμαλίεςστην επιφάνειά του και χωρίς το παρασκεύασμα να έχει το σχήμα κώνου. Το επίπεδο 2 (Grade 2), που υποδηλώνει ότι υπάρχουν ελλείψεις και ανωμαλίες στην επιφάνεια του παρασκευάσματος ή έχει σχήμα κωνικό στο περιφερικό άκρο του. Το επίπεδο 1 (Grade 1), που σημαίνει ότι δεν έχει αφαιρεθεί πλήρως το μεσοορθό και υπάρχουν κυκλοτερείς ελλείψεις στην εκτομή. Η δημιουργία του κώνου οφείλεται στο γεγονός ότι ο χειρουργός παρασκευάζει περικά πλησιάζοντας το ορθό και όχι προς τα εκτός, επί του μεσοορθικού πλάνου.
Στην Ολλανδική μελέτη του Nagtegaal και συν, από το 2002, η παθολογοανατομική εξέταση των παρασκευασμάτων ολικής εκτομής του μεσοορθού έδειξε ότι ο κίνδυνος τοπικής ή απομακρυσμένης υποτροπής ήταν 36% σε ασθενείς με grade 1 έναντι 20% σε εκτομές grade 1. Επίσης είναι σημαντικό το γεγονός ότι σε 25% των περιπτώσεων το περιμετρικό, πλάγιο μεσοορθικό όριο είναι μικροσκοπικά διηθημένο ή ότι ο όγκος πλησιάζει ιδιαίτερα εγγύς της μεσοορθικής περιτονίας μετά τη διήθηση του μεσοορθικού λίπους (προχωρημένο στάδιο Τ3) ή υπάρχει μεσοορθική μικροεμφύτευση πολύ κοντά στην μεσοορθική περιτονία. Η τοπική υποτροπή είναι αναπόφευκτη σε μια τέτοια περίπτωση και, μάλιστα η χειρουργική όραση και αφή δεν είναι επαρκείς στο να αυξήσουν το δείκτη υποψίας για ένα τέτοιο σενάριο. Οπωσδήποτε η διενέργεια μιας καλής ποιότητας προεγχειρητικής μαγνητικής τομογραφίας πυέλου προκειμένου την εκτίμηση της μεσοορθικής διήθησης και της κατάστασης της μεσοορθικής περιτονίας βοηθά σημαντικά. Έτσι, όπως τονίζει και ο Heald, εκτός από την άπω, περιφερική παρασκευή και η πλάγια, περιμετρική παρασκευή είναι εξέχουσας σημασίας για την ακέραια αφαίρεση του περιτονιϊκού (fascial) φακέλου που περικλείει το μεσοορθό και το ορθό.
Η λεπτή ανατομική παρασκευή που χαρακτηρίζει όλους τους χρόνους της μεσοορθικής εκτομής είναι, επίσης, σημαντική για την αποφυγή τραυματισμών στα κινητικά αυτόνομα νεύρα, που είναι υπεύθυνα για την ουρογεννητική λειτουργία. Κλάδοι του συμπαθητικού πλέγματος που διατρέχουν πλαγίως της αορτής σχηματίζουν το κάτω μεσεντέριο πλέγμα κατά την πρόσθια επιφάνεια της κοιλιακής αορτής, στο ύψος της έκφυσης της κάτω μεσεντερίου αρτηρίας. Συστήνεται, λοιπόν, η απολίνωση της κάτω μεσεντερίου αρτηρίας να γίνεται περί τα 1-2 εκατοστά από την έκφυσή της από την αορτή, προς αποφυγην του τραυματισμού του κάτω μεσεντερίου πλέγματος. Το τελευταίο έχει καθαρά συμπαθητική λειτουργία και, τραυματισμός του, οδηγοεί σε δυσλειτουργία της εκσπερμάτωσης. Κάτω από το διχασμό της αορτής στις λαγόνιες αρτηρίες και στο ύψος του ακρωτηρίου των μαιευτήρων, οι προϊεροί κλάδοι του συμπαθητικού πλέγματος σχηματίζουν το άνω υπογάστριο πλέγμα. Αυτό διαιρείται σε δεξιό και αριστερό υπογάστριο ωεύρο. Τα υπογάστρια νεύρα δημιουργούν το συμπαθητικό τμήμα του κάτω υπογαστρίου πλέγματος. Οι παρασυμπαθητικοί κλάδοι του πλέγματος προέρχονται από τις 2ες-3ες ιερές νευρικές ρίζες. Το κάτω υπογάστριο πλέγμα βρίσκεται οπισθοπλαγίως των σπερματοδόχων κύστεων, χωρίζεται από το μεσοορθό από ελάχιστο ινω-λιπώδη ιστό, ενώ ελάχιστοι κλάδοι του εκτείνονται προσθιοπλάγια επιφάνεια του ορθού και χρησιμεύουν για τη νεύρωσή του. Η πλειονότητα των νεύρων του πλέγματος νευρώνουν την ουροδόχο κύστη και τα γεννητικά όργανα και διατομή τους σε αυτό το επίπεδο προκαλεί ανικανότητα στύσεως και επίσχεση ούρων. Έτσι ιδιαίτερη προσοχή πρέπει να καταβάλεται για την αποφυγή τρώσεως του πλέγματος κατά την προσθιοπλάγια κινητοποίηση του μεσοορθού, η οποία και θεωρείται και αυτή που είναι τεχνικά πλέον απαιτητική. Η παρασκευή αυτή γίνεται μετξύ της περιτονίας του Denonvilliers και του προστάτη και των σπερματοδόχων κύστεων, καταλείποντας την περιτονία επί του παρασκευάσματος. Ο λόγος είναι ότι μεσοορθικός ιστός, αν και λιγότερος, βρίσκεται και προσθίως του ορθού και, για λόγους ογκολογικής αρχής, πρέπει να αφαιρείται.
Ογκολογικά αποτελέσματα της ολικής μεσοορθικής εκτομής
Προκαλεί έκπληξη το γεγονός ότι, παρά την ευρεία αποδοχή της ολικής μεσοορθικής εκτομής ως μεθόδου εκλογής για τη χειρουργική αντιμετώπιση του ορθικού καρκίνου, καμιά τυχαιοποιημένη κλινική μελέτη δεν έχει διενεργηθεί προκειμένου τη θεμελίωση των ωφελειών που προσφέρει έναντι των συμβατικών ριζικών επεμβάσεων. Τα ποσοστά υποτροπών και τα λοιπά ογκολογικά αποτελέσματα της τεχνικής προέρχονται κυρίως από αναδρομικές μελέτες και, γενικά από μελέτες που δεν ήταν σχεδιασμένες με ελεγχόμενο τρόπο, με τα γνωστά μεθοδολογικά προβλήματα της επακόλουθης ανάλυσης.
Πάντως οι υποτροπές κυμαίνονται σε ποσοστά που δεν ξεπερνούν το 10% στις περισσότερες από τις άξιες λόγου κλινικές σειρές. Τα ποσοστά αυτά, σίγουρα, είναι σημαντικά μικρότερα από το 18,5%, το οποίο είναι το ποσοστό υποτροπών γενικά των καρκίνων του ορθού και το οποίο προέρχεται από μια ανασκόπηση 10000 δημοσιευμένων κλινικών σειρών από τους McCall και συν (σε 10% μόνο των σειρών αυτών χρησιμοποιήθηκε η ολική μεσοορθική εκτομή). Σήμερα, τυχαιοποιημένη προοοπτική μελέτη για την επάρκεια και την ασφάλεια της μεσοορθικής εκτομής είναι μη αναγκαία και ίσως και θα μπορούσε να χαρακτηριστεί και ως μη δεοντολογική στα πλαίσια μιας κλινικής ηθικής, αφού τα πολύ καλά αποτελέσματα έχουν ήδη αναπαραχθεί από πολλές κλινικές ομάδες από διάφορες χώρες.
Λειτουργικά αποτελέσματα
Οι χειρουργικές επεμβάσεις για τον καρκίνο του ορθού μπορεί να ελαττώσουν τη σεξουαλική λειτουργία, αλλά η εισαγωγή της ολικής μεσοορθικής εκτομής με τη διατήρηση των αυτόνομων νεύρων ελάττωσε σημαντικά το ποσοστό των ανδρών που βασανίζονται από σεξουαλική δυσλειτουργία μετεγχειρητικά. Στην προοπτική μελέτη του Mauer (2001), η ολική μεσοορθική εκτομή υπερτέρησε στη διατήρηση ανέπαφης της σεξουαλικής λειτουργίας σε στατιστικά σημαντικό βαθμό. Κατά την αναδρομική εκτίμηση της σεξουαλικής λειτουργίας μετά από ολική μεσοορθική εκτομή από τους Nesbakken και συν (2000), το 86% των ανδρών ηλικίας μικρότερης των 60 ετών και 67% αυτών που ήταν μεγαλύτεροι από 60 έτη διατήρησαν την ικανότητά τους να έρθουν σε σεξουαλική επαφή, ενώ το 87% δεν είχαν προβλήματα στύσης.
Στη μελέτη του Μauer δυσουρικά ενοχλήματα παρουσίασαν κυρίως οι ασθενείς που είχαν επηρεασμένη κυστική λειτουργία προεγχειρητικά, ενώ δεν υπήρχαν διαφορές με τις αμβλείες παρασκευές του μεσοορθού, όσον αφορά τις κλινικές παραμέτρους που χαρακτηρίζουν την ουροδυναμική λειτουργία. Επίσης, οι περισσότερες αναδρομικές μελέτες δεν αναφέρουν σημαντικά προβλήματα στη λειτουργία της ουροδόχου κύστεως μετά από την ολική μεσοορθική εκτομή
Βιβλιογραφικές πηγές
1. Heald RJ, Husband EM, Ryall RD.The mesorectum in rectal cancer surgery--the clue to pelvic recurrence? Br J Surg. 1982 Oct;69(10):613-6.
2. Ridgway PF, Darzi AW. The role of total mesorectal excision in the management of rectal cancer.Cancer Control. 2003 May-Jun;10(3):205-11.
3. Havenga K, Enker WE. Autonomic nerve preserving total mesorectal excision. Surg Clin North Am. 2002 Oct;82(5):1009-18.
4. Murty M, Enker WE, Martz J. Current status of total mesorectal excision and autonomic nerve preservation in rectal cancer. Semin Surg Oncol. 2000;19(4):321-8.
5. Merchant NB, Guillem JG, Paty PB, Enker WE, Minsky BD, Quan SH, Wong D, Cohen AM. T3N0 rectal cancer: results following sharp mesorectal excision and no adjuvant therapy. J Gastrointest Surg. 1999 Nov-Dec;3(6):642-7.
6. Havenga K, Enker WE, Norstein J, Moriya Y, Heald RJ, van Houwelingen HC, van de Velde CJ. Improved survival and local control after total mesorectal excision or D3 lymphadenectomy in the treatment of primary rectal cancer: an international analysis of 1411 patients. Eur J Surg Oncol. 1999 Aug;25(4):368-74.
7. Enker WE, Havenga K, Polyak T, Thaler H, Cranor M. Abdominoperineal resection via total mesorectal excision and autonomic nerve preservation for low rectal cancer. World J Surg. 1997 Sep;21(7):715-20.
8. Enker WE. Total mesorectal excision--the new golden standard of surgery for rectal cancer. Ann Med. 1997 Apr;29(2):127-33.
9. Havenga K, Enker WE, McDermott K, Cohen AM, Minsky BD, Guillem J. Male and female sexual and urinary function after total mesorectal excision with autonomic nerve preservation for carcinoma of the rectum. J Am Coll Surg. 1996;182(6):495-502.
Κακοήθης πολύποδας παχέος εντέρου- Θεραπευτική στρατηγική
Κακοήθης ορίζεται ο αδενωματώδης πολύποδας ο οποίος περιέχει καρκινικά κύτταρα που διηθούν την υποβλεννογόνια μυϊκή στιβάδα, με την καρκινική διήθηση να περιορίζεται στον υποβλεννογόνιο χιτώνα (pT1 ή Τ1ΝxMx σύμφωνα με το σύστημα ΤΝΜ). Αποτελούν το 2-12% των κολονοσκοπικά αφαιρεθέντων πολυπόδων (1). Ο κίνδυνος παρουσίας κακοήθειας σε ένα αδενωματώδη πολύποδα σχετίζεται με το μέγεθος του πολύποδα και συγκεκριμένα για μέγεθος 0,6-1,5 εκ είναι 2%, 1,6-2,5 εκ 19%, 2,6-3,5 εκ 43% και >3,5 εκ 76% (2, 3). Η κλινική απόφαση για την αναγκαιότητα διενέργειας κολεκτομής και η ογκολογική επάρκεια και ασφάλεια της της ενδοσκοπικής πολυποδεκτομής καθορίζονται από τα χαρακτηριστικά, τη βιολογική συμπεριφορά του κακοήθους πολύποδα, τον κίνδυνο ύπαρξης συνοδών λεμφαδενικών μεταστάσεων και από τη γενική κατάσταση του ασθενούς (2, 3). Ο κύριος παράγοντας παρουσίας λεμφαγγειακής διασποράς αποτελεί το βάθος διήθησης των καρκινικών κυττάρων εντός του πολύποδα. Η ταξινόμηση κατά Haggitt (Εικόνα 1) βασίζεται στο επίπεδο διήθησης (4):
• Επίπεδο 0: Χωρίς διήθηση, βαρειά δυσπλασία
• Επίπεδο 1: Το καρκίνωμα διηθεί διά της υποβλεννογονίου μυϊκής στιβάδας, αλλά περιορίζεται στην κεφαλή του έμμισχου πολύποδα
• Επίπεδο 2: Το καρκίνωμα διηθεί έως τον αυχένα, το όριο μεταξύ της κεφαλής και του μίσχου του έμμισχου πολύποδα
• Επίπεδο 3: Το καρκίνωμα διηθεί το μίσχο του έμμισχου πολύποδα
• Επίπεδο 4: Το καρκίνωμα διηθεί τον υποβλεννογόνιο χιτώνα του εντέρου κάτω από το μίσχο του έμμισχου πολύποδα. Όλοι οι κακοήθεις άμισχοι αδενωματώδεις πολύποδες είναι επιπέδου 4 κατά Haggitt.
O Κudo ταξινόμησε περαιτέρω το βάθος της υποβλεννογόνιας διήθησης ως ακολούθως(5):
• SM1: Διήθηση έως το ανώτερο 1/3 του υποβλεννογονίου χιτώνα
• SM2: Διήθηση έως και το μέσο 1/3 του υποβλεννογονίου χιτώνα
• SM3: Διήθηση έως και το κατώτερο 1/3 του υποβλεννογονίου χιτώνα
Τα επίπεδα 1, 2 και 3 κατά Haggitt είναι SM1, ενώ το επίπεδο 4 κατά Haggitt μπορεί να είναι SM1, SM2 ή SM3.
Ο κίνδυνος λεμφαδενικών μεταστάσεων είναι <1% για έμμισχους κακοήθεις πολύποδες με επίπεδο διήθησης κατά Haggitt 1, 2 και 3, ενώ για τα αδενώματα με επίπεδο 4 κατά Haggitt, έμμισχα ή άμισχα, ο κίνδυνος αυτός κυμαίνεται σε 12 έως 25% (6, 7). Παράγοντες που σχετίζονται με αυξημένο κίνδυνο λεμφαγγειακής διασποράς περιλαμβάνουν την παρουσία λεμφαγγειακής διήθησης εντός του νεοπλάσματος, η χαμηλή διαφοροποίηση, η μικροκυψελιδική αρχιτεκτονική, οι επίπεδοι (flat) και υπεσκαμμένοι (depressed) πολύποδες και το επίπεδο διήθησης SM3 (8, 9, 10).
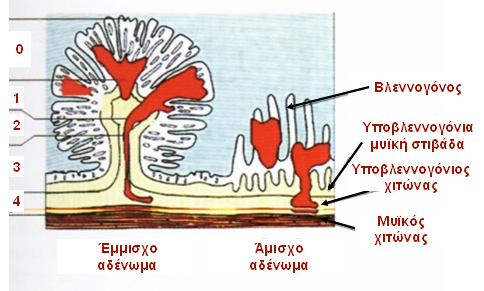
Εικόνα 1. Ταξινόμηση κατά Haggitt
Κατά την ενδοσκοπική αφαίρεση ευμεγέθων, άμισχων ή πολυπόδων με ύποπτα για εξαλλαγή μακροσκοπικά χαρακτηριστικά, ειδικά δε αν θεωρείται πιθανά ατελής η ενδοσκοπική εκτομή τους, συστήνεται η υποβλεννογόνια χορήγηση χρωστικής ουσίας, όπως η ινδική μελάνη, η οποία προσδίδει μόνιμη χρώση που αναγνωρίζεται εύκολα από την ορογονική πλευρά του εντερικού τοιχώματος κατά τη διάρκεια της χειρουργικής διερεύνησης, εφόσον αυτή απαιτηθεί. Σε περίπτωση ανεύρεσης κακοήθους πολύποδα που απαιτεί περαιτέρω χειρουργική εκτομή, σύμφωνα με τα κριτήρια που αναλύονται παρακάτω, η σήμανση της θέσης της ενδοσκοπικής πολυποδεκτομής με σινική μελάνη πρέπει να διενεργείται εντός 2 εβδομάδων από το χρόνο της κολονοσκοπικής αφαίρεσης, εφόσον, βέβαια, τούτο δεν είχε λάβει χώρα τη στιγμή της αρχικής ενδοσκοπικής αφαίρεσης.
Σύμφωνα με τις συστάσεις του Nivatvongs (Surg Clin North Am, 2000) και τις κατευθητήριες οδηγίες του National Comprehensive Cancer Network (NCCN) του 2009, οι οποίες και συνιστούν συστάσεις κατηγορίας 2Α, η ενδοσκοπική αφαίρεση ενός κακοήθους πολύποδα ως ολόκληρο, αδιάσπαστο παρασκεύασμα, με υγιή όρια εκτομής και με «ευνοϊκά» ιστολογικά χαρακτηριστικά, επαρκεί ογκολογικά και δεν χρήζει περαιτέρω χειρουργικής αφαίρεσης (3, 11). Η ενδοσκοπική επιτήρηση της θέσης της πολυποδεκτομής περιλαμβάνει της ενδοσκοπική παρακολούθησή της σε 2-3 μήνες και ακολούθως κάθε 6 μήνες για τα 2 πρώτα χρόνια. Πλήρης κολονοσκόπηση γίνεται στο 3ο έτος και, έπειτα, ανά 3ετία.
Εάν το παρασκεύασμα της ενδοσκοπικής πολυποδεκτομής είναι τεμαχισμένο ή η αφαίρεση έγινε κατά τμήματα (piecemeal) ιδιαίτερα σε ευμεγέθη άμισχο πολύποδα ή εάν τα όρια είναι αδύνατο να εκτιμηθούν ιστοπαθολογικά επαρκώς ή εάν είναι διηθημένα ή εάν το αδενοκαρκίνωμα που περιέχεται στον πολύποδα έχει «δυσμενή» ιστολογικά χαρακτηριστικά ή η διήθηση είναι επιπέδου 4 κατά Haggitt, τότε η διενέργεια κολεκτομής με την en block συναφαίρεση των επιχωρίων λεμφαδένων αποτελούν την ενδεδειγμένη θεραπεία (11). «Ευνοϊκά» ιστολογικά χαρακτηριστικά αποτελούν η καλή (Grade 1) και μέση (Grade 2) διαφοροποίηση του νεοπλάσματος, η απουσία λεμφαγγειακής διήθησης και το «αρνητικό» όριο εκτομής, ενώ «δυσμενή» χαρακτηριστικά είναι η χαμηλή (Grade 3) διαφοροποίηση, η παρουσία λεμφαγγειακής διήθησης και το «θετικό» όριο εκτομής (11). Δεν υπάρχει απόλυτη συμφωνία για το πως ορίζεται η διήθηση του ορίου εκτομής. Αποδεκτοί ορισμοί είναι η παρουσία κακοήθων κυττάρων σε απόσταση <1 χιλ από το όριο εκτομής, σε απόσταση <2 χιλ από το όριο ή η παρουσία τους εντός της ζώνης της διαθερμίας του ενδοσκοπικού βρόγχου.
Υπάρχει σχετική αμφισβήτηση για το εάν η ενδοσκοπική αφαίρεση ενός άμισχου πολύποδα μπορεί να θεωρηθεί επαρκής ογκολογικά ή εάν οι άμισχοι πολύποδες πρέπει να υποβάλλονται σε μια ογκολογικά ριζική εκτομή του αντίστοιχου τμήματος του παχέος εντέρου. Τα βιβλιογραφικά δεδομένα υποδεικνύουν ότι η επίπτωση ανεπιθύμητων συμβαμάτων, όπως υπολειπόμενη νόσος, υποτροπή, θνητότητα και αιματογενείς μεταστάσεις, αλλά όχι και λεμφαδενικές μεταστάσεις, είναι υψηλότερη μετά την ενδοσκοπική αφαίρεση άμισχων πολυπόδων συγκριτικά με τα έμμισχα αδενώματα. Πάντως η προσεκτική ανάλυση των δεδομένων αποδεικνύει ότι η μακροσκοπική εμφάνιση του αδενωματώδους πολύποδα αφ’εαυτής δεν είναι ο σημαντικός παράγοντας για την ανεπιθύμητη ογκολογική έκβαση και ότι ενδοσκοπική αφαίρεση αποτελεί επαρκή θεραπεία για την αντιμετώππιση ενός πλήρως εκταμέντα, με αρνητικά ιστολογικά όρια άμισχου πολύποδα που φέρει αδενοκαρκίνωμα καλής ή μέσης διαφοροποίησης και δεν παρουσιάζει σημεία λεμφαγγειακής διήθησης εντός του παρασκευάσματος.
Προεγχειρητική εκτίμηση και αξιολόγηση
Κατά το σχεδιασμό της χειρουργικής στρατηγικής για την αντιμετώπιση ενός καρκίνου στο παχύ έντερο η κατά το δυνατόν πλήρης αντίληψη της ακριβούς εντόπισης του όγκου, του σταδίου της νόσου και της γενικής κατάστασης του ασθενούς αποτελούν απαραίτητα στοιχεία (12). Διαθέσιμα συστήματα βαθμολόγησης αναλύουν τον αναισθησιολογικό κίνδυνο, όπως το ASA (American Society of Anesthesia) score, αλλά και τους πρόσθετους κνδύνους από τη συνεκτίμηση της θρεπτικής κατάστασης του ασθενούς και τη διενέργεια της κολεκτομής, όπως το POSSUM. H εντόπιση της πρωτοπαθούς βλάβης και η ιστολογική διάγνωση της βιοψίας μπορούν να καθοδηγήσουν την επιλογή της ογκολογικής επέμβασης, καθώς και τα ιδεώδη όρια εκτομής (12, 13, 14). Η παρουσία του όγκου σε διαχωριστικές ζώνες αιμάτωσης, όπως η ηπατική και η σπληνική καμπή οδηγεί σε αναγκαστικά περισσότερο εκτεταμένες εκτομές (εκτεταμένη δεξιά ή εκτεταμένη αριστερή κολεκτομή) του παχέος εντέρου προκειμένου την ογκολογική επάρκεια, αλλά και την ασφάλεια της επικείμενης αναστόμωσης των κολονικών κολοβωμάτων. Ενδείξεις που συνηγορούν με την παρουσία κληρονομικού μη πολυποδισιακού καρκίνου του παχέος εντέρου (Hereditary Nonpolyposis Colon Cnacer, HNPCC), όπως δεξιά εντόπιση της κακοήθους εστίας, νεαρή ηλικία, φλεγμονώδης αντίδραση που μοιάζει με αυτή που απαντάται στη νόσο Crohn, θετικό οικογενειακό ιστορικό, ιδιαίτερα δε εάν τα παραπάνω συνοδεύονται από την παρουσία μικροδορυφορικής αστάθειας στα δείγματα της βιοψίας, κατευθύνουν στην ανάγκη διενέργεια υφολικής, αντί τμηματικής κολεκτομής (12).
Η κολονοσκόπηση αποτελεί το καταλληλότερο μέσο διάγνωσης και εντόπισης του καρκινώματος, ενώ προσφέρει τη δυνατότητα λήψης βιοψιών και σήμανσης της βλάβης με μόνιμη χρωστική για το διεγχειρητικό εντοπισμό της εφόσον τούτο θεωρηθεί αναγκαίο(12, 13, 14). Η αξονική τομογραφία κοιλίας (Computed Tomography, CT) αποτελεί το απεικονιστικό μέσο εκλογής για την προεγχειρητική αξιολόγηση του ενδοκοιλιακά μεταστατικού ορθοκολικού καρκίνου(12, 13, 14, 15). Πληροφορίες για την τοπική επέκταση του όγκου (ειδικά με την παρουσία ψηλαφητής μάζας, ασυνήθους κοιλιακού άλγους και ανεξήγητων μη φυσιολογικών τιμών στο βιοχημικό έλεγχο), την ύπαρξη περιοχικής λεμφαδενοπάθειας (ευαισθησία που κυμαίνεται από 19 έως 67%) και την παρουσία ηπατικών μεταστάσεων (ευαισθησία και ειδικότητα για την ανίχνευση μεταστατικών εστιών >1 εκ 90% και 95%, αντίστοιχα) μπορούν να ληφθούν από τη CT κοιλίας (16). Πολλές φορές, ωσόσο, οι πληροφορίες αυτές δεν επηρεάζουν την απόφαση για χειρουργική επέμβαση, λαμβανομέμου δε υπ’όψιν του γεγονότος ότι τα στοιχεία που παρέχει η προεγχειρητική CT είναι εύκολα αναγνωρίσιμα κατά τη διάρκεια της χειρουργικής επέμβασης. Έτσι, αντί της προεγχειρητικής, η CT κοιλίας που λαμβάνεται μετεγχειρητικά αποτελεί τη βάση απεικονιστικής εκτίμησης (baseline) πριν την εφαρμογή επικουρικής θεραπείας. Σύμφωνα με τις συνιστώμενες πρακτικές αντιμετώπισης που συντάχθηκαν το 2004 από την Αμερικανική Εταιρεία Χειρουργών Παχέος Εντέρου & Ορθού (Αmerican Society of Colon & Rectal Surgeons (ΑSCRS) Standards Practice Task Force, Practice Parameters for Colon Cancer, 2004), «ενδείκνυται η προεγχειρητική CT κοιλίας σε επιλεγμένους ασθενείς, ενώ η χρήση της σαν εξέταση ρουτίνας είναι προαιρετική» (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Β) (13). Ωστόσο με τη σύγχρονη τάση ταυτόχρονης χειρουργικής αφαίρεσης της πρωτοπαθούς και των τυχόν ανευρυσκομένων σύγχρονων ηπατικών μεταστάσεων, καθώς και με την καθιέρωση πρωτοκόλλων χορήγησης νεοεπικουρικής χημειοθεραπείας σε ομάδες ασυμπτωματικών καρκίνων σταδίου IV, η προεγχειρητική CΤ κοιλίας μπορεί να τροποποιήσει χειρουργική στρατηγική αντιμετώποσης του καρκίνου και, έτσι, σήμερα αποτελεί αναπόσπαστη εξέταση στην προεγχειρητική σταδιοποίηση του αδενοκαρκινώματος του παχέος εντέρου.
Η αναγνωρισμένη προγνωστική αξία των ορολογικών επιπέδων του καρκινοεμβρυϊκού αντιγόνου (CEA), ως δείκτη πληρότητας εξαίρεσης της καρκινικής μάζας, αλλά και πιθανής υποτροπής, σε περίπτωση ανόδου της τιμής του, έχει καθιερώσει την προεγχειρητική μέτρηση του εν λόγω καρκινικού δείκτη απαραίτητη (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Α), ενώ μετεγχειρητικά η τακτική παρακολούθηση των επιπέδων του πρέπει να ξεκινά μετά από 3 μήνες (13, 17, 18). Η καθιερωμένη χρήση προεγχειρητικής ακτινογραφίας θώρακα για τον έλεγχο μεταστατικής νόσου στους πνεύμονες είναι αποδεκτή (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης ΙΙΙ, Βαθμός σύστασης C) (13). Πάντως, σύμφωνα με τις οδηγίες του NCCN, 2009 η προεγχειρητική αξιολόγηση του ασθενούς με μη μεταστατικό καρκίνο του παχέος εντέρου περιλαμβάνει ανασκόπηση των κολονοσκοπικών βιοψιών, πλήρη αιματολογικό έλεγχο, πλήρη κολονοσκόπηση, μέτρηση του CEA, αξονική τομογραφία θώρακα, κοιλίας και πυέλου (11). Η ποζιτρονική τομογραφία (Positron Emission Tomography, PET scan) δεν περιλαμβάνεται στην αρχική σταδιοποίηση της νόσου και δεν πρέπει να αποτελεί εξέταση ρουτίνας (11). Το PET scan μπορεί να προσφέρει πολύτιμη βοήθεια στη διευκρίνηση ύποπτων εστιών από τη CT ή τη μαγνητική τομογραφία, εφόσον αυτές ξεπερνούν σε μέγεθος το 1 εκ, καθώς επίσης και στον αποκλεισμό μεταστατικής νόσου σε δυνητικά χειρουργικά αφαιρέσιμη υποτροπή της νόσου, προκειμένου την αποφυγή μιας ριζικής επανεπέμβασης με μεγάλη νοσηρότητα.
Προετοιμασία του ασθενούς
Μηχανικός καθαρισμός του παχέος εντέρου
Παρά την καθιερωμένη χρήση του προεγχειρητικού μηχανικού καθαρισμού του πεχέος εντέρου με διαλύμματα, 5 προοπτικές τυχαιοποιημένες μελέτες (δεν έχουν τη στατιστική ισχύ για τον αποκλεισμό λάθους τύπου ΙΙ), μία μετα-ανάλυση και μία συστηματική ανασκόπηση δεν απέδειξαν κάποιο όφελος από το μηχανικό καθαρισμό σε προγραμματισμένες κολεκτομές συγκριτικά με την απουσία του και την απλή χορήγηση ενδοφλέβιων αντιβιοτικών (19, 20, 21). Μάλιστα στη μετα-ανάλυση των Bucher και συν, όπου συγκρίθηκαν 565 ασθενείς που υποβλήθηκαν σε προεγχειρητικό μηχανικό καθαρισμό με 579 που δεν έλαβαν διαλύμματα καθαρισμού του εντέρου, υπήρξε μεγαλύτερο ποσοστό αναστομωτικών διαφυγών στην ομάδα του μηχανικού καθαρισμού (Odds Ratio, OR: 1,8) (21). Επίσης οι επιπλοκές που αφορούσαν σε εν τω βάθει χειρουργικές λοιμώξεις και λοιμώξεις του τραύματος ήταν περισσότερες στους ασθενείς που είχαν υποβληθεί σε μηχανικό καθαρισμό. Πάντως, στις περισσότερες από τις μελέτες χρησιμοποιήθηκαν τα υψηλού όγκου διαλύματα πολυαιθυλενογλυκόλης, ενώ τα παραπάνω δεδομένα μπορεί να μην ισχύουν με τα χαμηλότερου όγκου διαλύματα φωσφορούχου νατρίου, που χρησιμοποιούνται περισσότερο σήμερα. Η επιλεγμένη χρήση του μηχανικού καθαρισμού με τη χορήγηση συστηματικών αντιβιοτικών συνεχίζει να δικαιολογείται στην προετοιμασία του ασθενούς για κολεκτομή (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Α) (13).
Χημειοπροφύλαξη
Η προφυλακτική χορήγηση αντιβιοτικών έχει αποδεδειγμένη αποτελεσματικότητα στο να ελαττώνει τη συχνότητα των λοιμώξεων, τη θνητότητα και το κόστος της νοσηλείας μετά από κολεκτομές. Ανεξάρτητα από το/α παρεντερικό/ά αντιβιοτικό/ά που θα χρησιμοποιηθεί/ούν, η χορήγηση του/τους πρέπει να γίνεται πριν από την έναρξη της χειρουργικής επέμβασης (22-25). Στις προγραμματισμένες κολεκτομές για καρκίνο η χρήση των ενδοφλέβιων αντιβιωτικών δεν είναι αναγκαίο να επεκτείνεται πέραν των 24 ωρών προεγχειρητικά. Συμπερασματικά, τα προφυλακτικά αντιβιωτικά ενδείκνυνται στις εκλεκτικές κολεκτομές (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης Ι, Βαθμός σύστασης Α) (13).
Μεταγγίσεις
Η προεγχειρητική μετάγγιση αίματος μπορεί να απαιτηθεί για ασθενείς που υποβάλλονται σε κολεκτομή για καρκίνο. Γενικά, η ανάγκη για μετάγγιση καθορίζεται από το επίπεδο της αιμοσφαιρίνης πριν από το χειρουργείο, τη φυσιολογική κατάσταση του ασθενούς και τις διεγχειρητικές απώλειες αίματος. Είναι, ωστόσο, αποδεδειγμένες οι ανοσοκατασταλτικές επιδράσεις των μεταγγίσεων. Ασθενείς που λαμβάνουν αίμα περιεγχειρητικά διατρέχουν μεγαλύτερο κίνδυνο λοιμώξεων. Επίσης, αν και αρκετές μελέτες υποστηρίζουν το μεγαλύτερο κίνδυνο για κακοήθη υποτροπή και ελαττωμένη επιβίωση, οι μεταναλύσεις επί του θέματος αμφισβητούν την ύπαρξη πραγματικής αιτιώδους σχέσης (26-38). Συμπερασματικά, οι μεταγγίσεις αίματος πρέπει να βασίζονται στις φυσιολογικές ανάγκες του ασθενούς (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης ΙΙΙ, Βαθμός σύστασης C) (13).
Θρομβοπροφύλαξη
Οι ασθενείς που υποβάλλονται σε κολεκτομή για καρκίνο έχουν υψηλή συχνότητα εν τω βάθει φλεβοθρόμβωσης και πνευμονικής εμβολής. Πολλαπλές μελέτες έχουν αποδείξει την αποτελεσματικότητα της χορήγησης ηπαρίνης χαμηλού μοριακού βάρους γι’ αυτό το σκοπό (39-44). Στην προοπτική τυχαιοποιημένη μελέτη των Mc Leod και συν (Ann Surg, 2001) που αφορούσε χειρουργικούς ασθενείς παχέος εντέρου, οι θροβοπροφυλακτικές δράσεις της ηπαρίνης χαμηλού μοριακού βάρους και της υποδόριας κοινής ηπαρίνης ήταν ισοδύναμες (43). Πέραν της ηπαρίνης, η αναγκαιότητα πρόσθετης χρήσης άλλων μέσων, όπως συσκευών διακεκομμένης αεροσυμπίεσης των κάτω άκρων, δεν έχει ακόμα διευκρινιστεί. Παρ’ όλ’ αυτά, όλοι οι ασθενείς που υποβάλλονται σε κολεκτομή για καρκίνο πρέπει να λαμβάνουν θρομβοπροφύλαξη (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης Ι, Βαθμός σύστασης Α) (13).
Αρχές χειρουργικής τεχνικής
Ιδανικό μήκος και όρια εκτομής
Το μήκος εκτομής του παχέος εντέρου πρέπει να αντιστοιχεί στη λεμφαγγειακή αποχέτευση του φέροντος τον όγκο τμήματτος του παχέος εντέρου (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Β) (13).
Το καθοριστικό κριτήριο της ογκολογικά επαρκούς εκτομής του ιδανικού μήκους τμήματος του εντέρου είναι η αφαίρεση του τροφοδοτούντος αγγειακού μίσχου στην έκφυσή του και του αντίστοιχου λεμφαδενικού ιστού (Εικόνα 2). Όταν ο πρωτοπαθής όγκος είναι σε ίση απόσταση ανάμεσα σε δύο τροφοδοτούντα αγγεία, τότε και τα δύο αγγεία πρέπει να απολινώνονται κοντά στην έκφυσή τους. Έτσι, οι όγκοι που εντοπίζονται σε ζώνες μετάβασης πρέπει να εκτέμνονται μαζί με τις γειτονικές λεμφαδενικές περιοχές προκειμένου να συμπεριληφθούν και οι δύο πιθανές κατευθύνσεις λεμφαδενικής διασποράς. Στη μελέτη των Rouffett και συν. (Dis Colon Rectum, 1994), στην οποία 260 ασθενείς τυχαιοποιήθηκαν σε αριστερή ημικολεκτομή ή σε τμηματική εκτομή του αριστερού κόλου, ο διάμεσος χρόνος επιβίωσης, η νοσηρότητα και η θνητότητα ανάμεσα στις δύο ομάδες ήταν παρόμοια (45).
Εικόνα 2. Είδη κολεκτομών αναλόγως της θέσης του όγκου.
Α. Δεξιά κολεκτομή
Β. Δεξιά εκτεταμένη κολεκτομή
Γ. Αριστερή κολεκτομή
Δ. Σιγμοειδεκτομή
Η αφαίρεση της αγγείωσης του προσβεβλημένου τμήματος του παχέος εντέρου η οποία και είναι παράλληλη με τη λεμφαγγειακή του αποχέτευση υπαγορεύει το μήκος του παχέος εντέρου που εκτέμνεται. Τουλάχιστον 5εκ φυσιολογικού εντέρου και από τις δύο πλευρές της πρωτοπαθούς κακοήθους εστίας είναι το ελάχιστο μήκος που απαιτείται προκειμένου την αφαίρεση των επικολικών και παρακολικών (κατά μήκος της επιχειλίου αρτηρίας) λεμφαδένων καθώς και την ελαχιστοποίηση της αναστομωτικής διαφυγής. Το μήκος του ειλεού που εκτέμνεται δεν επηρεάζει την τοπική υποτροπή. Το ελάχιστο μήκος του ειλεού χρειάζεται να αφαιρείται σε ογκολογικές επεμβάσεις του παχέος εντέρου για την πρόληψη της απορρόφησης. Πάντως, δεν είναι δυνατό να εκτιμηθεί με ακρίβεια η ανεξάρτητη επίδραση ειδικά των ορίων εκτομής του παχέος εντέρου στην επιβίωση και στις ογκολογικές υποτροπές διότι το μήκος εκτομής και η έκταση της λεμφαδενεκτομής είναι δύο άρρηκτα συνδεδεμένες παράμετροι που βρίσκονται σε άμεση συνάρτηση.
Έκταση λεμφαδενεκτομής
Η αφαίρεση των σύστοιχων λεμφαδενικών ομάδων έχει ιδιαίτερη προγνωστική και θεραπευτική αξία. Η σωστή λεμφαδενεκτομή πρέπει να εκτείνεται στην έκφυση του πρωτογενώς τροφοδοτούντος αγγειακού κλάδου. Σε όλες τις δυνητικά θεραπευτικές κολεκτομές η αφαίρεση των λεμφαδένων πρέπει να γίνεται en block με το εκταμέν τμήμα του εντέρου. Οι κορυφαίοι λεμφαδένες στην αρχή, δηλαδή στην περιοχή της έκφυσης των τροφοφόρων αγγείων, πρέπει να συναφαιρούνατι όταν αυτό είναι εφικτό και να σημαίνονται για ιστιπαθαλογική εκτίμηση. Στη μελέτη των Malassagne και συν. (Dis Colon Rectum, 1993) η διήθηση των κορυφαίων λεμφαδένων αύξησε κατα 2,5 φορές την ογκολογική θνητότητα των ασθενών (46). Αυτό το εύρημα υπαστηρίχθηκε από την τυχαιοποιημένη μελέτη 1,117 ασθενών από την Αυστραλία όπου αναδείχθηκε ελαττωμένη 5ετής επιβίωση από 54% σε 26% στους ασθενείς με μεταστατική διήθηση των κορυφαίων λεμφαδένων (47).
Εκτεταμένες ριζικές λεμφαδενεκτομές δεν έχουν αποδείξει ότι οδηγούν σε βελτίωση της επιβίωσης και για αυτό η διενέργεια τέτοιου είδους επεμβάσεων δεν υποστηρίζεται γενικά, αφού οι σχετιζόμενες με αυτές επιπλοκές υπερβαίνουν κάθε θεωρητικό πλεονέκτημά τους. Πάντως, αν υπάρχει κάποιο όφελος, αυτό βρίσκεται στην ομάδα των ασθενών με καρκίνο σταδίου C κατά Dukes. Η αυξημένη νοσηρότητα μιας εκτεταμένης λεμφαδενεκτομής μπορεί να μην αποτελεί απαγορευτικό στοιχείο όταν η επέμβαση γίνεται από ειδικούς, αν και η δυνητική αξία μιας τέτοιας επιθετικής χειρουργικής τεχνικής φαίνεται να βρίσκεται στην καλύτερη σταδιοποίηση (48).
Εάν κατά τη διάρκεια της χειρουργικής επέμβασης υπάρξει υποψία ότι λεμφαδένες που βρίσκονται εκτός του πεδίου εκτομής είναι διηθημένοι, τότε αυτοί πρέπει να αφαιρεθούν και να σταλούν για βιοψία. Εάν τα αποτελέσματα της βιοψίας των ύποπτων λεμφαδένων είναι θετικά και αυτοί οι λεμφαδένες έχουν αφαιρεθεί μαζί με τους κορυφαίους λεμφαδένες, τότε η εκτομή θεωρείται πλήρης (R0). Εάν η βιοψία είναι θετική και οι λεμφαδένες δεν έχουν αφαιρεθεί με τους κορυφαίους λεμφαδένες, η εκτομή θεωρείται ατελής. Εάν λεμφαδένες που έχουν αποδειχθεί θετικοί στη βιοψία δε συμπεριληφθούν στα όρια της λεμφαδενεκτομής και αφεθούν στο χειρουργικό πεδίο, τότε η εκτομή είναι ατελής (R2).
Η ακρίβεια της σταδιοποίησης του καρκίνου του παχέος εντέρου αυξάνεται με την αύξηση του αριθμού των λεμφαδένων που εκτιμώνται μικροσκοπικά. O αριθμός των ανευρεθέντων λεμφαδένων κυμαίνεται ανάλογα με τον ασθενή, την ηλικία του, τη θέση και τη διαφοροποίηση του όγκου. Δέκα ή περισότεροι λεμφαδένες ανευρίσκονται στο 98% των παρασκευασμάτων και 13 ή περισσότεροι στο 91% χωρίς να χρησιμοποιηθούν τεχνικές καθαρισμού του λίπους. Χρησιμοποιώντας όμως τέτοιες τεχνικές, ο μέσος αριθμός των διαθέσιμων λεμφαδένων για ιστολογική εξέταση μπορεί να αυξηθεί έως και 58% (49-54).
Με βάση παλαιότερες μελέτες που πιστοποίησαν ότι 15 έως 21 λεμφαδένες χρειάζεται να εκτιμηθούν προκειμένου να ανιχνευθεί λεμφαδενική μετάσταση στο 95% των ασθενών στους οποίους λεμφαδενική διήθηση είναι πραγματικά παρούσα, οι οδηγίες ASCRS 2004 καθόρισαν τον αριθμό 15 ως τον ελάχιστο αναγκαίο αριθμό λεμφαδένων που πρέπει να έχουν μικροσκοπικά αξιολογηθεί (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Β) (13). Οι σύγχρονες οδηγίες του NCCN, 2009 ορίζουν το ελάχιστο αριθμό λεμφαδένων στους 12 (11). Αυτή η οδηγία βασίζεται στη σύσταση από την American Joint Committee on Cancer (AJCC) και το Αμερικανικό Κολλέγιο των Παθολογοανατόμων (College of American Pathologists, CAP), σύμφωνα με την οποία η ακριβής ταυτοποίηση ενός καρκίνου σταδίου ΙΙ (pN0), δηλαδή η απουσία λεμφαδενικής διήθησης απαιτεί την εξέταση τουλάχιστον 12 λεμφαδένων, ειδάλλως υφίσταται κίνδυνος υποσταδιοποίησης της νόσου.
Εάν πρόκειται για καρκίνωμα σταδίου ΙΙ και οι ανευρεθέντες λεμφαδένες είναι λιγότεροι από 12, ο παθολογοανατόμος πρέπει να κάνει περαιτέρω προσπάθειες επαναπροσδιορισμού με επανεξέταση του αποσταλλέντος υλικού, και, εάν, πρ’όλα αυτά, ο αριθμός των ανευρεθέντων λεμφαδένων δεν αποδειχθεί επαρκής, να καταγραφεί στην τελική ιστολογική εξέταση. Ειδικά για τα στάδια ΙΙΙΒ και ΙΙΙC, ο αριθμός των ανευρεθέντων λεμφαδένων αποτελεί ανεξάρτητο προγνωστικό δείκτη (55).
Tεχνική απομονώσεως του όγκου (No-Touch Technique)
Η ανησυχία για για την αποκόλληση καρκινικών κυττάρων και εμβόλων κατά τη διάρκεια των χειρουργικών χεισρισμών αποτελέσε το κίνητρο για την εισαγωγή και εφαρμογή από τους θιασώτες της, της τεχνικής απομόνωσης του όγκου (no-touch technique) (56-58). Αυτή περιλαμβάνει την απολίνωση της αγγειακής κοίτης στην περιοχή της βλάβης, τους απαραίτητους χειρουργικούς χειρισμούς και, τελευταία, την κινητοποίηση του πέριξ του όγκου τμήματος του παχέος εντέρου. Στην αναδρομική μελέτη του Turnbull από το 1967 φάνηκε ότι η 5ετής επιβίωση των ασθενών στους οποίους ακολουθήθηκε αυτή η τεχνική ήταν καλύτερη (56). Η μελέτη όμως αυτή είχε σοβαρά μεθοδολογικά προβλήματα.
Στη μοναδική προοπτική τυχαιοποιημένη μελέτη που υπάρχει, αυτή των Wiggers και συν (Br J Surg, 1988) η διαφορά στην 5ετή επιβίωση μεταξύ της «συμβατικής» και της τεχνικής απομόνωσης δεν ήταν σημαντικές (56,3% vs 59,8%), αν και περισσότεροι ασθενείς εμφάνισαν ηπατικές μεταστάσεις και το ελεύθερο νόσου χρονικό διάστημα ήταν μικρότερο στην ομάδα των ασθενών μετά τη «συμβατική» τεχνική (57). Σε μία μικρή μελέτη 27 ασθενών των Hayashi και συν βρέθηκαν καρκινικά κύτταρα στην πυλαία φλέβα του 73% των ασθενών που χειρουργήθηκαν με τη «συμβατική» τεχνική έναντι 14% αυτών που υποβλήθηκαν σε τεχνική απομόνωσης του όγκου (59). Άλλα πειραματικά δεδομένα δεν υποστηρίζουν την παρουσία αποκολλήσεως σημαντικού αριθμού κυττάρων από τον όγκο κατά τη διάρκεια των χειρουργικών χειρισμών (58). Συμπερασματικά, η αξία της τεχνικής απομόνωσης του όγκου αμφισβητείται σημαντικά και με βάση τα δεδομένα της μίας τυχαιοποιημένης που υπάρχει για το θέμα αυτό, η καθιερωμένη χρήση της δεν προσφέρει ογκολογικά πλεονεκτήματα (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης C) (13).
Σύγχρονος καρκίνος παχέος εντέρου
Η επίπτωση σύγχρονου καρκινώματος παχέος εντέρου κυμαίνεται 2-9%. Η θέση των όγκων και μία ποικιλία παραγόντων που σχετίζονται με τον ασθενή θα καθορίσουν το εάν οι δύο βλάβες θα εκταμούν χωριστά ή εάν θα διενεργηθεί υφολική κολεκτομή. Έχει φανεί ότι και οι δύο προσεγγίσεις έχουν παρόμοια αποτελέσματα, συχνότητα επιπλοκών και αναστομωτικών διαφυγών και θνητότητας (60, 61). Έτσι, οι σύγχρονοι καρκίνοι του παχέος εντέρου μπορούν να αντιμετωπιστούν με δύο χωριστές εκτομές ή με υφολική κολεκτομή (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Β) (13).
Διήθηση οργάνων κατά συνέχεια ιστού
Το 15% των ασθενών με καρκίνο του παχέος εντέρου φέρουν όγκους που διηθούν παρακείμενα όργανα. Πολλές φορές είναι αδύνατον να επιτευχθεί διεγχειρητική διάτρηση των κακοήθων από τις φλεγμονώδεις συμφύσεις. Λόγω του ότι 40% των συμφύσεων και των ιστών προσκόλλησης του όγκου προς τα παρακείμενα όργανα περιέχουν κακοήθη κύτταρα, η en block εκτομή είναι απαραίτητη για να επιτευχθεί ογκολογικά επαρκής αφαίρεση (62, 63). Στη σειρά των Gall και συν ( Dis Colon Rectum, 1987) που περιείχε 121 ασθενείς με διήθηση άλλων οργάνων από όγκους παχέος εντέρου, η 5ετής επιβίωση ήταν παρόμοια στις en block εκτομές, ανεξάρτητα από το εάν οι συμφύσεις ήταν φλεγμονώδεις ή κακοήθεις (54% έναντι 49%) (64). Το ποσοστό επιβίωσης, όμως, ελαττώθηκε στο 17% εάν ο χειρουργός είχε διατάμνει κακοήθεις διηθήσεις. Στη μελέτη του Hunter και συν (Αm J Surg 1987) με 43 ασθενείς, η 5ετής επιβίωση ήταν 61% όταν διενεργήθηκε en block εκτομή ενώ μόνο 23% όταν οι προσφύσεις διαχωρίστηκαν κατά τη διάρκεια του χειρουργείου (65). Έτσι, καρκίνοι παχέος εντέρου που διηθούν κατά συνέχεια ιστού παρακείμενα όργανα πρέπει να αφαιρούνται en block με τις παρακείμενες ανατομικές δομές ((Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Α) (13). Ακόμα και σε ασθενείς με περιοχικές λεμφαδενικές μεταστάσεις (ο πιο σημαντικός προγνωστικός παράγοντας) η en block εκτομή με τα διηθούμενα από τον όγκο όργανα είναι απαραίτητη διότι 25% των ασθενών αυτών θα επιβιώσουν για τουλάχιστον 5 έτη. Τέλος, τα αποτελέσματα των Talamonti και συν. (Surg Gynecol Obstet, 1993) που αφορούσαν διήθηση της ουροδόχου κύστεως, η οποία αποτελεί και το όργανο που πιο συχνά ενέχεται σε έναν τοπικά προχωρημένο ορθοκολικό καρκίνο, επιβεβαίωσαν ότι η en block αφαίρεση τμήματος ή ολόκληρης της ουροδόχου κύστεως επιμηκύνει την επιβίωση εφόσον τα όρια εκτομής είναι αρνητικά (66).
Ο ρόλος του λεμφαδένα – φρουρού
Η αναζήτηση του λεμφαδένα-φρουρού, δηλαδή του λεμφαδένα που αποτελεί την πρώτη θέση συλλογής της λέμφου στη λεμφαδενική άλυσο απορροής της περιοχής του όγκου, έχει κλινική σημασία ιδιαίτερα στους ασθενείς με καρκίνο χαμηλού σταδίου. Η διενέργεια μικρού πάχους τομών και η χρήση ανασοϊστοχημικών μεθόδων βελτιώνει τη δυνατότητα αναδείξεως μικρομεταστάσεων (< 2χιλ.) με αποτέλεσμα την καλύτερη σταδιοποπίηση της νόσου και την εφαρμογή επιθετικότερης επικουρικής θεραπείας. Διενεργείται διεγχειρητικά με την υποορογόνια έγχυση μπλε χρωστικής ισοσουλφάνης η οποία οδηγεί στην αναγνώριση του λεμφαδένα-φρουρού σε 1 λεπτό. Μπορεί επίσης, να γίνει ενδοσκοπική έγχυση ραδιοσεσημασμένου υλικού στον υποβλεννογόνιο υμένα και να χρησιμοποιηθεί διεγχειρητικά ραδιοανιχνευτής για την ανίχνευση του λεμφαδένα–φρουρού. Η χαρτογράφηση του λεμφαγγειακού δικτύου είναι δυνατόν να επιτευχθεί και μετά την κολεκτομή ex fivo, με ένεση της μπλε χρωστικής εντός του όγκου και μάλαξή του.
Η αποτελεσματικότητα της μεθόδου στον καρκίνο του παχέος εντέρου αποτελεί αντικείμενο διχογνωμίας διότι η προγνωστική σημασία των λεμφαδενικών μικρομεταστάσεων αμφισβητείται, το πσοστό των ψευδώς αρνητικών αποτελεσμάτων φαίνεται να είναι μεγάλο (60%) σύμφωνα με τους Joosten και συν, Br Surg, 1999), αν και η διαγνωστική ακρίβεια μπορεί να αυξηθεί με χρήση ραδιοσεσημασμένου υλικού (έως και 92% σύμφωνα με Kitagawa και συν, Dis Colon Rectum, 2002) και τέλος, από τα αποτελέσματα της πολυκεντρικής μελέτης των Bertagnoli και συν (Αnn Surg, 2004) η μέθοδος δεν μετατρέπει την έκταση της χειρουργικής εκτομής (68-70).
Ο ρόλος της ωοθηκεκτομής
Η συχνότητα σύγχρονων μεταστάσεων στις ωοθήκες κυμαίνεται από 2 έως 8%. Διεγχειρητικά οι ωοθήκες πρέπει να ελέγχονται λεπτομερώς. Εάν οι ωοθήκες είναι μακροσκοπικά παθολογικές ή φαίνεται να διηθούνται κατά συνέχεια ιστού, τότε πρέπει να αφαιρούνται en block με τον πρωτοπαθή όγκο. Δεν υπάρχει αποδεδειγμένο πλεονέκτημα στην επιβίωση των ασθενών που να σχετίζεται με τη διενέργεια ωοθηκεκτομής στις ασθενείς με καρκίνο του παχέος εντέρου (τυχαιοποιημένη μελέτη των Young-Fadok και συν, Dis Colon Rectum, 1998), αλλά εάν η μία ωοθήκη φαίνεται να είναι διηθημένη, η διενέ ργεια αμφοτερόπλευρης ωοθηκεκτομής είναι απολύτως ενδεδειγμένη λόγω του κινδύνου μεταστατικής νόσου στην ετερόπλευρη ωοθήκη (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Β) (13, 71, 72).
Αντιμετώπιση ειδικών καταστάσεων
Απόφραξη παχέος εντέρου
Πολλαπλές μη τυχαιοποιημένες μελέτες με σειρές ασθενών που αντιμετωπίστηκαν για κακοήθη απόφραξη του δεξιού κόλου έχουν επιβεβαιώσει ότι η δεξιά κολεκτομή με άμεση ειλεο-εγκαρσία αναστόμωση, χωρίς κολονική έκπλυση (Lavage) είναι ασφαλής και αποτελεσματική χειρουργική τεχνική (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης C) (13). Αν και δεν υπάρχουν μελέτες που αναλύουν ειδικά τη συγκεκριμένη περίπτωση, η ύπαρξη νεοπλασματικής απόφραξης στο εγκάριο κόλο απαιτεί διενέργεια εκτεταμένης δεξιάς κολεκτομής και ειλεο-κατιούσας αναστόμωσης.
Στις περιπτώσεις αποφράξεως του παχέος εντέρου από καρκίνο που εντοπίζεται στο αριστερό κόλο η χειρουργική αντιμετώπιση πρέπει να εξατομικεύεται με την επιλογή της καταλληλότερης από μία σειρά ενδεδειγμένων χειρουργικων προσεγγίσεων (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης C) (13). Κάθε μία από τις παρακάτω επιλογές έχει τους υποστηρικτές της: εκτομή του φέροντος τον όγκο τμήματος του παχέος εντέρου και τελική κολοστομία (επέμβαση κατά Hartmann), εκτομή ακολουθούμενη από διεγχειρητική κολονική έκπλυση (on table colonic lavage) και αναστόμωση κατά πρώτο σκοπό, και υφολική κολεκτομή με ειλεο-ορθική αναστόμωση (Εικόνα 3) (73-76).
Υπάρχει μόνο μία τυχαιοποιημένη μελέτη η οποία συγκρίνει την υφολική κολεκτομή έναντι της τμηματικής εκτομής ακολουθούμενης από διεγχειρητική κολονική έκπλυση και πρωτογενή αναστόμωση. Η μελέτη δημοσιεύτηκε το 1995 από την ομάδα SCOTTIA και η θνητότητα και η επίπτωση των επιπλοκών ήταν παρόμοια ανάμεσα στις 2 προσεγγίσεις (77). Βασιζόμενοι, όμως, στην καλύτερη γαστρεντερική λειτουργία μετά από 4 μήνες από την επέμβαση, στους ασθενείς που είχαν υποβληθεί σε τμηματική εκτομή και κολονικό lavage, πρότειναν αυτήν τη χειρουργική πρακτική για τις περισσότερες αποφράξεις του αριστερού κόλου αν και η παρουσία σύγχρονης ή επαπειλούμενης διάτρησης του τυφλού από την εξεσημασμένη διάταση του παχέος εντέρου καθώς και η παρουσία ή η υποψία σύγχρονης νεοπλασματικής βλάβης κεντρικότερα (λόγω της αδυναμίας του κεντρικώς του όγκου τμήματος του εντέρου προεγχειρητικά) καθιστούν την υφολική κολεκτομή ως την προτιμητέα επέμβαση. Η ύπαρξη ενδοκοιλιακής σήψης ή σοβαρών τεχνικών δυσκολιών για την κατασκεύη της αναστόμωσης επιβάλλουν τη διενέργεια επέμβασης κατά Hartmann (78-80).
Η σύγχρονη βιβλιογραφία υποστηρίζει, επίσης, την επιλογή της ενδοσκοπικής τοποθέτησης κολονικής ενδοπρόθεσης (stent) (81-84). Εάν χρησιμοποιηθεί σε κατάλληλα επιλεγμένους ασθενείς, η τοποθέτηση του stent παρέχει τη δυνατότητα της ανακούφισης της οξείας απόφραξης προκειμένου να προσφερθεί ο απαραίτητος χρόνος για προγραμματισμένη προετοιμασία του παχέος εντέρου, κολονοσκόπηση, ογκολογική εκτομή και αναστόμωση σε πρώτο χρόνο.
Εικόνα 3. Παρασκεύασμα υφολικής κολεκτομής για πλήρως αποφράσσοντα όγκο κατιόντος κόλου. Ο ασθενής προσήλθε με κλινική εικόνα απόφραξης και στον προεγχειρητικό αξονοτομογραφικό έλεγχο αναδείχθηκε ενδοτοιχωματικός αέρας στο δεξιό κόλον. Διεγχειρητικά η επαπειλούμενη ρήξη του τυφλού οδήγησε στη διενέργεια της υφολικής κολεκτομής και στην αποκατάσταση της συνέχειας του εντέρου με ειλεο-ορθική αναστόμωση
Διάτρηση παχέος εντέρου
Ο πρωταρχικός στόχος είναι η απομάκρυνση του τμήματος του εντέρου που φέρει τη βλάβη και αποτελεί και το κύριο αίτιο της ενδοκοιλιακής σήψης. Κάθε προσπάθεια πρέπει να καταβάλεται για τη διενέργεια κολεκτομής (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης C) (13). Εάν υπάρχει ελεύθερη διάτρηση με περιτονίτιδα λόγω ενός καρκίνου στο δεξιό κόλο, μετά τη δεξιά κολεκτομή η αναστόμωση δεν είναι η σοφότερη επιλογή και η δημιουργία μίας τελικής ειλεοστομίας με το άπω κολονικό κολόβωμα να συγκλισθεί ή να εκστομωθεί σα βλεννογονικό συρίγγιο φαίνεται να είναι η καλύτερη επιλογή. Εάν υπάρχει όμως περιορισμένη κοπρανώδης διαφυγή, η αναστόμωση μπορεί να είναι εφικτή με ή χωρίς εγγύς προσωρινή εκτροπή με προστατευτική στομία. Όταν η διάτρηση λαμβάνει χώρα στη θέση ενός καρκίνου αριστερού κόλου, συνήθως διενεργείται μία επέμβαση κατά Hartmann. Στις περιπτώσεις που η διάτρηση συνοδεύεται από εξεσημασμένη εγγύς διάταση με ή χωρίς ισχαιμία, η υφολική κολεκτομή μπορεί να είναι καλύτερη επιλογή. Εάν η περιτοναϊκή σήψη είναι περιορισμένη, η ειλεο-ορθική ή η ειλεο-σιγμοειδική αναστόμωση συνήθως με μία προστατευτική loop-ειλεοστομία είναι έγκριτη επιλογή.
Μαζική αιμορραγία παχέος εντέρου
Η αιματοχεσία που χρειάζεται επείγουσα χειρουργική αντιμετώπιση είναι ασυνήθης επιπλοκή του καρκίνου του παχέος εντέρου (85-87). Η προεγχειρητική ή διεγχειρητική εντόπιση της θέσης της αιμορραγίας πρέπει να προηγείται με κάθε προσπάθεια. Εφόσον η θέση του καρκίνου έχει ταυτοποιηθεί, η τμαματική ογκολογικά άρτια εκτομή του τμήματος πρέπει να διενεργείται όπως, ακριβώς, και μία προγραμματισμένη εκτομή καρκίνου του παχέος εντέρου (Επίπεδο ένδειξης ΙΙΙ, Βαθμός σύστασης C) (13). Λόγω της καθαρτικής δράσης του αίματος το έντερο έχει ήδη επαρκώς καθαριστεί από τον όγκο των κοπράνων και η αναστόμωση σε πρώτο χρόνο μπορεί να είναι εφικτή. Αφού δεν υπάρχουν τυχαιοποιημένες μελέτες που να διευκρινίζουν το συγκεκριμένο θέμα, η ανάγκη για τη δημιουργία στομίας ορίζεται από την κρίση του χειρουργού. Στις περιπτώσεις που η θέση της αιμορραγίας δε μπορεί να εντοπιστεί με ακρίβεια, η προτιμητέα χειρουργική επέμβαση σύμφωνα με τις αναδρομικές μελέτες που έχουν ασχοληθεί με το θέμα αυτό είναι η υφολική κολεκτομή, αφού η συχνότητα επανεμφάνισης της αιμορραγίας είναι ελαττωμένη μετά από υφολική κολεκτομή, ενώ η νοσηρότητα της επέμβασης αυτής δεν είναι σημαντικά διαφορετική από τις διάφορες τμηματικές εκτομές του εντέρου (88).
Είδη κολεκτομών
Δεξιά κολεκτομή
Η δεξιά κολεκτομή ενδείκνυται σε ασθενείς με κακοήθεις όγκους στο τυφλό, ανιόν κόλον και την ηπατική καμπή, αφού η άρδευση των περιοχών αυτών προέρχεται από την ειλεοκολική και τη δεξιά κολική αρτηρία. Ο ασθενής τοποθετείται σε θέση ύπτια ή σε θέση λιθοτομής στις πριπτώσεις που θα απαιτηθεί διεγχειρητική κολονοσκόπηση. Η τοποθέτηση του χειρουργού στην αριστερή πλευρά του ασθενούς διευκολύνει σημαντικά. Η διενέργεια κάθετης χειρουργικής τομής στη μέση γραμμή βοηθά στην πλήρη επισκόπηση της κοιλιάς και του χειρουργικού πεδίου. Η διεγχειρητική σταδιοποίηση της νόσου λαμβάνει χώρα με επισκόπηση και ψιλάφηση των ενδοκοιλιακών οργάνων δίνοντας έμφαση στις θέσεις πιθανών μεταστατικών εστιών, όπως το ήπαρ και οι ωοθήκες. Η εξαιρεσιμότητα του όγκου ελέγχεται με ήπιους ψιλαφητικούς χειρισμούς, όπως γίνεται και η διερεύνηση τυχόν διήθησης παρακείμενων οργάνων. Οι έλικες του λεπτού εντέρου απομακρύνονται από το χειρουργικό πεδίο έτσι ώστε να αποκαλυφθει η ριζα του δεξιού μεσοκόλου και το μεσεντέριο του εγκάρσιου κόλου. Στην τεχνική της παρασκεύης του δεξιού κόλου από το κέντρο προς την περιφέρεια (μέση-προς-πλάγια προσέγγιση, medial-to-lateral approach) γίνεται αρχικά αναγνώριση, διατομή και απολίνωση των δεξιών κολικών αγγείων και των δεξιών κλάδων των μέσων κολικών αγγείων στη ρίζα του μεσεντερίου του δεξιού κόλου, επιτυγχάνοντας με αυτόν τον τρόπο την αγγειακή απομόνωση της περιοχής του όγκου (Εικόνα 4).
Μετά την αποκάλυψη της ρίζας του δεξιού μεσοκόλου, η δεξιά κολική αρτηρία (παρούσα στο 50% των ασθενών) και τα ειλεοκολικά αγγεία ανασπώνται απομακρυνόμενα από το οπισθοπετιτόναιο. Μία κάθετη τομή διενεργείται στη ρίζα του δεξιού μεσοκόλου ουραίως της 3ης μοίρας του δωδεκαδακτύλου στα δεξιά της άνω μεσεντερίου αρτηρίας. Τα αγγεία απομακρύνονται από το οπισθοπεριτόναιο και η εγγύς απολίνωση λαμβάνει χώρα στην αρχή της ειλεοκολικής αρτηρίας από την άνω μεσεντέριο (Εικόνα 5). Το δεξιό μεσόκολο παρασκευάζεται διαχωριζόμενο από το οπισθοπεριτόναιο με αποτέλεσμα την ανεύρεση του ηπατικού κλάδου της μέσης κολικής αρτηρίας ο οποίος και απολινώνεται. Με ανάλογη παρασκευή με ουραία κατεύθυνση προς τον τελικό ειλεό ανευρίσκονται και απολινώνονται οι ειλεϊκοί αγγειακοί κλάδοι.
Ο τελικός ειλεός και το δεξιό κόλο ανασπώνται και, μετά από τη διατομή της πλαγίας ανάκαμψης του τοιχωματικού περιτοναίου (γραμμή Toldt), το μεσόκολο αποκολλάται πλήρως από το οπισθοπεριτόναιο έως το ύψος της ηπατικής καμπής. Καθ’ όλη τη διαδικασία της παρασκευής ιδιαίτερη προσοχή δίνεται στη διατήρηση του σύστοιχου ουρητήρα, των έσω σπερματικών αγγείων και της κάτω κοίλης φλέβας. Οι αναρτούντες σύνδεσμοι της ηπατικής καμπής διατέμνονται με προσοχή για την αποφυγή τραυματισμών στα εξωηπατικά χολιφόρα, την ηπατική κάψα και τη χοληδόχο κύστη. Εξέχουσας σημασίας είναι η αναγνώριση και η διατήρηση της ακεραιότητας της οπισθοπεριτοναϊκής μοίρας του δωδεκαδακτύλου. Η αποκάλυψη της κεφαλής του παγκρέατος πιστοποιεί την επάρκεια της παρασκεύης του δωδεκαδάκτυλου και τη δυνατότητα της ασφαλούς απολινώσεως των δεξιών κλάδων των μέσων κολικών αγγείων. Η παρασκευή του δεξιού κόλου από την περιφέρεια προς το κέντρο (πλάγια-προς-μέση παρασκευή, lateral-to-medial approach) γίνεται με την αρχική διατομή του περιτοναίου κατά μήκος της λευκής γραμμής του Τoldt έως το ύψος της ηπατικής καμπής, η κινητοποίηση και ανάσπαση του δεξιού κόλου και ακολούθως τη διατομή του περιτοναίου κατά μήκος της ρίζας του μεσοκόλου, με την απολίνωση και διατομή των αγγειακών στελεχών του να λαμβάνουν χώρα στο τέλος (Εικόνα 6).
Η παρασκευή του εγκαρσίου κόλου και η εκτομή του συμφυόμενου με αυτό επιπλόου ακολουθεί την κινητοποίηση της ηπατικής καμπής και γίνεται με την είσοδο στον ελάσσονα επιπλοϊκό θύλακο η οποία και επιτυγχάνεται με τη διατομή του ελάσσονος επιπλόου κάτωθεν των γαστροεπιπλοϊκών τόξων. Η ανάσπαση του οπίσθιου τοιχώματος του στομάχου βοηθά στην αποφυγή κακώσεων. Το επίπλουν διατέμνεται στο όριο της θέσης του εγκαρσίου κόλου όπου θα διενεργηθεί η αναστόμωση.
Μετά την παρασκευή του δεξιού κόλου ο τελικός ειλεός διατέμνεται 5 έως 10 εκατοστά εγγύς της ειλεοτυφλικής βαλβίδας προκειμένου την εξασφάλιση ικανής αγγείωσης στο τμήμα αυτό. Το εγκάρσιο κόλο διατέμνεται δεξιά του αγγειακού κορμού της μέσης κολικής αρτηρίας. Το χειρουργικό παρασκεύασμα απομακρύνεται. Η ειλεο-εγκαρσία αναστόμωση εκτελείται με τη χρήση κοπτοσυρραπτικών εργαλείων πλάγιο-παλαγίως μεταξύ των αντιμεσεντερικών επιφανειών των δύο εντερικών κολοβωμάτων (Εικόνα 7). Είναι τεχνικώς ευκολότερη και απαιτεί λιγότερο χρόνο σε σύγκριση με την αναστόμωση η οποία διενεργείται με τη χρήση ραμμάτων. Εάν χρησιμοποιηθούν ράμματα για την κατασκευή της αναστόμωσης, γεγονός που είναι πάνω από όλα θέμα προτίμησης του χειρουργού, βασική προϋπόθεση για την εξασφάλιση της στεγανότητάς της είναι το να συμπεριλαμβάνονται στη ραφή ο ορομυϊκός χιτώνας του εντέρου με μικρό τμήμα της βλεννογονικής στιβάδας. Η σύγκλειση του μεσεντερικού ελλείμμταος είναι προαιρετική.
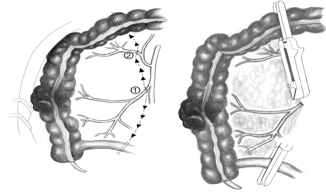
Εικόνα 4. Δεξιά κολεκτομή. Στην τεχνική της παρασκευής του δεξιού κόλου από το κέντρο προς την περιφέρεια (μέση-προς-πλάγια προσέγγιση, medial-to-lateral approach) γίνεται αρχικά αναγνώριση, διατομή και απολίνωση των ειλεοκολικών αγγείων (1) και των δεξιών κλάδων των μέσων κολικών αγγείων (2) στη ρίζα του μεσεντερίου του δεξιού κόλου. Ακολουθεί η διατομή του τελικού ειλεού και του εγκαρσίου κόλου
Εικόνα 5. Τμήμα παρασκευάσματος δεξιάς κολεκτομής. Η ειλεοκολική αρτηρία απολινώνεται στην εκφυσή της από την άνω μεσεντέριο αρτηρία (βέλος)
Εικόνα 6. Δεξιά κολεκτομή. Η παρασκευή του δεξιού κόλου από την περιφέρεια προς το κέντρο (πλάγια-προς-μέση παρασκευή, lateral-to-medial approach) γίνεται με την αρχική διατομή του περιτοναίου κατά μήκος της λευκής γραμμής του Τoldt έως το ύψος της ηπατικής καμπής
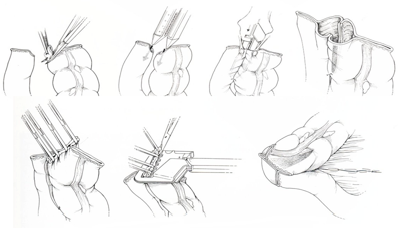
Εικόνα 7. Η ειλεο-εγκαρσία αναστόμωση εκτελείται με τη χρήση κοπτοσυρραπτικών εργαλείων πλάγιο-παλαγίως μεταξύ των αντιμεσεντερικών επιφανειών των δύο εντερικών κολοβωμάτων
Eκτεταμένη δεξιά κολεκτομή
Ενδείξεις για τη διενέργεια της δεξιάς εκτεταμένης κολεκτομής αποτελούν τα καρκινώματ που εντοπίζονται στο εγκάρσιο κόλον, συμπεριλαμβανομένων της ηπατικής και της σπληνικής καμπής. Τα μέσα κολικά αγγεία, τα οποία διατηρούνται στην τυπική δεξιά κολεκτομή, απολινώνονται κατά την εκτέλεση της εκτεταμένης δεξιάς κολεκτομής. Η επέμβαση παραγματοποιείται με τον ίδιο τρόπο, όπως στη δεξιά κολεκτομή, με τη διαφορά ότι, αντί της παρασκευής του εγκαρσίου μεσοκόλου για την απολίνωση του δεξιού κλάδου της μέσης κολικής αρτηρίας, η παρασκευή του εγκαρσίου κόλου συνεχίζεται οπισθοπεριτοναϊκώς, προκειμένου την ανεύρεση του κυρίου αγγειακού κορμού της μέσης κολικής αρτηρίας έμπροσθεν του παγκρέατος, η οποία και απολινώνεται.
Η είσοδος στον ελάσσονα επιπλοϊκό θύλακο γίνεται διά του γαστροκολικού συνδέσμου επί τα εκτός του γαστροεπιπλοϊκού αγγειακού τόξου, έτσι ώστε το επίπλοθν να εκταμεί μαζί με το εγκάρσιο κόλον. Η σπληνική καμπή απελευθερώνεται από την ουρά του παγκρέατος, τον κάτω πόλο του σπληνός και την πρόσθια επιφάνεια της περινεφρικής περιτονίας. Το αριστερό κόλον και το σύστοιχο μεσεντέριο διαιρούνται εγγύς της αριστερής κολικής αρτηρίας, η οποία διατηρείται για τις δεξιές βλάβες, ενώ ο ανιόν κλάδος της αριστερής κολικής χρειάζεται να απολινωθεί όταν η βλάβη βρίσκεται στο άπω εγκάρσιο και τη σπληνική καμπή, με διατήρηση του κατιόντος κλάδου και των σιγμοειδικών αρτηριών, οπότε και μια περισσότερο άπω ειλεοσιγμοειδική αναστόμωση θα χρειαστεί να κατασκευαστεί (Εικόνα 8). Η ειλεοκατιούσα ή η ειλεοσιγμοειδική αναστόμωση διενεργείται τελικο-τελικά ή πλαγιο-πλάγια, ανάλογα με την προτίμηση του χειρουργού.
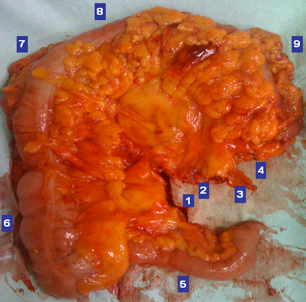
Εικόνα 8. Παρασκεύασμα εκτεταμένης δεξιάς κολεκτομής που έγινε για καρκίνο της μεσότητας του εγκαρσίου κόλου. 1. Ειλεοκολική αρτηρία. 2. Μέση κολική αρτηρία. 3. Ανιόν κλάδος αριστερής κολικής αρτηρίας. 4. Επιχείλιος αρτηρία. 5. Τελικός ειλεός. 6. Δεξιό κόλον. 7. Ηπατική καμπή. 8. Εγκάρσιο κόλον. 9. Σπληνική καμπή
Αριστερή κολεκτομή
Η αριστερή κολεκτομή ενδείκνυται στους ασθενείς με όγκους που εντοπίζονται στο κατιόν και σιγμοειδές κόλον. Οι αρχές που διέπουν κάθε κολεκτομή, όπως περιγράφονται παραπάνω για τη δεξιά κολεκτομή ισχύουν και εδώ. Κατά τη μέση-προς-πλάγια (medial-to-lateral) κινητοποίηση, το μεσεντέριο του λεπτού εντέρου απωθείται προς το δεξιό άνω τεταρτημόριο της κοιλιάς, προκειμένου την αναγνώριση του στελέχους της κάτω μεσεντερίου αρτηρίας. Διενεργείται επιμήκης διατομή του περιτοναίου κατά μήκος της ρίζας του μεσοκόλου από την ιερά ακρολοφία έως το σύνδεσμο του Treitz. Η κάτω μερσεντεριος αρτηρία απολινώνεται εγγύς της έκφυσης της αριστερής κολικής αρτηρίας και η κάτω μεσεντέριος φλέβα ανευρίσκεται στην περιοχή της νηστιδοδωδεκαδακτυλικής καμπής, κάτω από την ουρά του παγκρέατος, όπου και απολινώνεται.
Ο ανάγγειος χώρος ανάμεσα στο αριστερό μεσόκολο και το οπισθοπεροτόναιο παρασκευάζεται, ούτως ώστε να ανευρεθεί ο αριστρερός ουρητήρας και τα σπερματικά αγγεία, δομές που διατηρούνται απωθούμενες ραχιαίως προς την οπισθοπεριτοναϊκή πλευρά, ενώ το μεσόκολο ανασηκώνεται απομακρυνόμενο από τους οπισθοπεριτοναϊκούς ιστούς. Το σιγμοειδές κινητοποιείται από την είσοδο της πυέλου και ολόκληρο το αριστερό κόλον, που έχει ήδη κινητοποιηθεί από τα μέσα-πρός-πλάγια, παρασκευάζεται από το πλάγιο κοιλιακό τοίχωμα με τη διατομή της πλάγιας περιτοναϊκής ανάκαμψης κατά μήκος της γραμμής του Toldt.
Ακολουθεί η κινητοποίηση της σπληνικής καμπής, με την απελευθέρωση των προσφύσεων της από τον αριστερό νεφρό, το σπλήνα και την ουρά του παγκρέατος. Το επίπλουν συναφαιρείται με το αριστερό εγκάριο κόλον. Ο αριστερός κλάδος της μέσης κολικής αρτηρίας στη βάση του εγκαρσίου μεσοκόλου απολινώνεται, ενώ μπορεί να είναι αναγκαίο να να διαιρεθεί και ο δεξιός κλάδος της, προκειμένου να επιτραπεί στο εγκάρσιο κόλον να «φθάσει» στο σιγμοειδές ή στο ορθό για την αναστόμωση (Εικόνα 9). Εάν όμως υπάρχουν ερωτηματικά όσον αφορά τη βιωσιμότητα του δεξιού κόλου για τη χρησιμοποίησή του ως το εγγύς κολόβωμα της αναστόμωσης, τότε η διενέργεια μιας εκτεταμένης δεξιάς κολεκτομής και ειλεοσιγμοειδικής ή ειλεοορθικής αναστόμωσης είναι προτιμητέα. Αναλόγως του τμήματος του αριστερού κόλου που χρειάζεται να αφαιρεθεί, κάτι που ορίζεται από τη θέση του όγκου, η αναστόμωση μετά τη διατομή και την απομάκρυσνση του παρασκευάσματος διενεργείται στο επίπεδο στου σιγμοειδούς ή στο ορθό, ως κολο-ορθική αναστόμωση.
Κατά την πλάγια-προς-μέση (lateral-to-medial) κινητοποίηση), αρχικά το σιγμοειδές κινητοποιείται από την είσοδο της πυέλου και ολόκληρο το αριστερό κόλον, παρασκευάζεται από το πλάγιο κοιλιακό τοίχωμα με τη διατομή της πλάγιας περιτοναϊκής ανάκαμψης κατά μήκος της γραμμής του Toldt. Η σπληνική καμπή κινητοποιείται με οδηγό το πλάνο που δημιουργείται από την πλάγια κινητοποίηση του αριστερού κόλου. Τελευταία λαμβάνουν χώρα η διατομή του περιτοναίου και η απολίνωση της κάτω μεσεντερίου αρτηρίας και της φλέβας, όπως περιγράφονται παραπάνω.
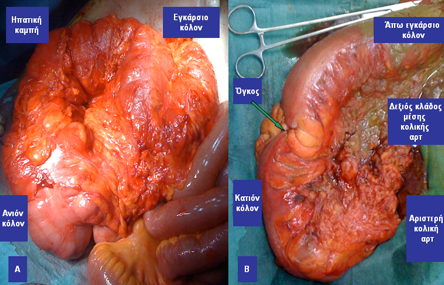
Εικόνα 9. Α. Διατεταμένο δεξιό και εγκάρσιο κόλον σε έδαφος καρκίνου του κατιόντος κόλου που προκαλεί απόφραξη του παχέος εντέρου. Β. Παρασκεύασμα αριστερής κολεκτομής που ακολούθησε. Κατασκευάστηκε τελική εγκαρσιοστομία η οποία αναστράφηκε σε δεύτερο χρόνο για την αποκατάσταση της συνέχειας του εντέρου
Σιγμοειδεκτομή
Η υψηλή απολίνωση της κάτω μεσεντερίου αρτηρίας είναι απαραίτητη κατά τη διενέργεια της σιγμοειδεκτομής, προκειμένου την πληρέστερη δυνατή αφαίρεση του σύστοιχου λεμφαδενικού ιστού, αλλά και για τη δυνατότητα κατασκευής μιας χωρίς τάση αναστόμωσης (Εικόνα 10). Ωστόσο, καλό είναι να γίνεται 1-2 εκ από την έκφυσή της από την αορτή, για την αποφυγή τρώσης του προαρτικού συμπαθητικού κάτω μεσεντερίου πλέγματος και την αποφυγή δυσάρεστων ουρογενετήσιων λειτουργικών διαταράχων μετεγχειρητικά. Ο ανιόν κλάδος της αριστερής κολικής αρτηρίας διατηρείται για την ενίσχυση της ανάδρομης ροής από τη μέση κολική μέσω της επιχειλίου αρτηρίας και την εξασφάλιση της καλύτερης δυνατής αιμάτωσης της αναστόμωσης.
Για την αποφυγή τάσης στην αναστόμωση, η σπληνική καμπή πρέπει να κοινητοπιείται. Είτε με μέση-προ-πλάγια ή με πλάγια-προς-μέση προσέγγιση, το σιγμοειδές κινητοποιείται, ενώ το ανώτερο ορθό κινητοποιείται από την ιερά ακρολοφία (Εικόνα 11). Ο ασθενής πρέπει να βρίσκεται σε θέση λιθοτομής για να καταστεί εφικτή η δια του ορθού, με κυκλικό αναστομωτήρα, διενεργούμενη τελικο-τελική κολο-ορθική αναστόμωση, μετά τη διατομή της ορθοσιγμοειδικής ανάκαμψης (Εικόνα 12).
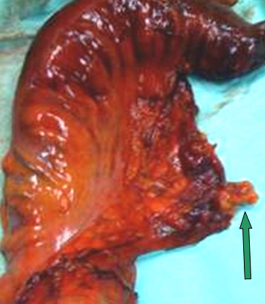
Εικόνα 10. Υψηλή απολίνωση της κάτω μεσεντερίου σε παρασκεύασμα σιγμοειδεκτομής (βέλος)
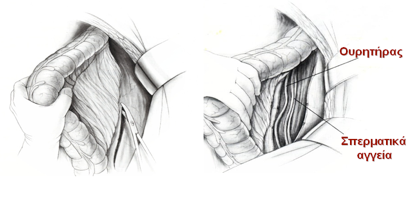
Εικόνα 11. Σιγμοειδεκτομή. Η παρασκευή του αριστερού κόλου από την περιφέρεια προς το κέντρο (πλάγια-προς-μέση παρασκευή, lateral-to-medial approach) γίνεται με την αρχική διατομή του περιτοναίου κατά μήκος της λευκής γραμμής του Τoldt έως το ύψος της σπληνικής καμπής
Εικόνα 12. Σιγμοειδεκτομή. Μετά την αφαίρεση του παρασκευάσματος, διενεργείται τελικο-τελική κολο-ορθική αναστόμωση με τη δια του ορθού διεκβολή κυκλικού αναστομωτήρα
Υφολική κολεκτομή
Παρά το γεγονός ότι η εκτομή του μεγαλύτερου τμήματος του παχέος εντέρου απποτελεί μία μείζονα επέμβαση, η αναστόμωση του ειλεού με το σιγμοειδές ή με το ανώτερο ορθό μπορεί να πλεονεκτεί της κολο-κολικής αναστόμωσης ως προς τη συχνότητα και τη βαρύτητα των αναστομωτικών επιπλοκών, λόγω της χρησιμοποίησης του εξ’ ορισμού καλύτερα αγγειούμενου τμήματος του λεπτού εντέρου ως το εγγύς κολόβωμα, αλλά και ίσως από ογκολογικής απόψεως, εάν ληφθεί υπόψιν ότι απομακρύνται το μέγιστο ποσό λεμφαδενικού ιστού, ελαττώνοντας έτσι την πιθανότητα παραμονής υπολειμματικής νόσου.
Η υφολική κολεκτομή απαιτείται στις περιπτώσεις συνδρόμου μη πολυποδισιακού καρκίνου (σύνδρομο Lynch), εξασθενημένων τύπων οικογενούς πολυποδιάσεως (Attenuated Familial Adenomatous Polyposis, AFAP), μετάχρονων ή σύγχρονων καρκίνων σε διαφορετικά τμήματα του παχέος εντέρου, και, συχνά, σε περπτώσεις οξείας κακοήθους απόφραξης, ειδικά εάν το η κατάσταση του εγγύς της απόφραξης τμήματος του παχέος εντέρου είναι άγνωστη. Τα διάφορα τμήματα της παρασκευής, κινητοποίησης και των αγγειακών απολινώσεων που απαιτούνται προκύπτουν από το συνδυασμό των τμηματικών κολεκτομών, όπως αυτές περιγράφεισαν στις παραπάνω επιμέρους ενότητες. Ο τελικός ειλεός κινητοποιείται επαρκώς για να «φθάσει» στο ορθό και η ειλεο-ορθική αναστόμωση διενεργείται τελικο-τελικά ή, συνηθέστερα, πλάγιο-τελικά, με τη βοήθεια του κατάλληλου μεγέθους κυκλικού αναστομωτήρα.
Βιβλιογραφία
1. Nivatvongs S. Complications in colonoscopic polypectomy. An experience with 1,555 polypectomies. Dis Colon Rectum 1986;29:825-30.
2. Nusko G, Mansmann U, Partzsch U, Altendorf-Hofmann A, Groitl H, Wittekind C, et al Invasive carcinoma in colorectal adenomas: multivariate analysis of patient and adenoma characteristics. Endoscopy 1997;29:626-31.
3. Nivatvongs S. Surgical management of malignant colorectal polyps. Surg Clin North Am 2002;82:956-66.
4. Haggitt RC, Glotzbach RE, Soffer EE, Wruble LD.Prognostic factors in colorectal carcinomas arising in adenomas: implications for lesions removed by endoscopic polypectomy. Gastroenterology. 1985;89:328-36.
5. Kudo S. Endoscopic mucosal resection of flat and depressed types of early colorectal cancer. Endoscopy 1993;25:455-61.
6. Nivatvongs S, Rojanasakul A, Reiman HM, Dozois RR, Wolff BG, Pemberton JH, et al. The risk of lymph node metastasis in colorectal polyps with invasive adenocarcinoma. Dis Colon Rectum 1991;34:323-8.
7. Nascimbeni R, Burgart LJ, Nivatvongs S, Larson DR. Risk of lymph node metastasis in T1 carcinoma of the colon and rectum. Dis Colon Rectum. 2002;45:200-6.
8. Kikuchi R, Takano M, Takagi K, Fujimoto N, Nozaki R, Fujiyoshi T, Uchida Y. Management of early invasive colorectal cancer. Risk of recurrence and clinical guidelines. Dis Colon Rectum. 1995;38:1286-95.
9. Ueno H, Mochizuki H, Hashiguchi Y, Shimazaki H, Aida S, Hase K, et al. Risk factors for an adverse outcome in early invasive colorectal carcinoma. Gastroenterology. 2004;127:385-94.
10. Seitz U, Bohnacker S, Seewald S, Thonke F, Brand B, Bräiutigam T, Soehendra N. Is endoscopic polypectomy an adequate therapy for malignant colorectal adenomas? Presentation of 114 patients and review of the literature. Dis Colon Rectum. 2004 ;47:1789-96
11. NCCN Clinical Practice Guidelines in Oncology Colon Cancer V.I.2009. www.nccn.org
12. Senagore AJ, Fry R. Surgical management of colon cancer. In: Wolff BG, Fleshman JW, Beck DE, Pemerton JH, Wexner SD, editors. The ASCRS Textbook of Colon and Rectal Surgery. New York: Springer; 2007. p. 395-404
13. Otchy D, Hyman NH, Simmang C, Anthony T, Buie D, Cataldo P, et al. Practice Parameters for Colon Cancer Prepared by The Standards Practice Task Force
The American Society of Colon and Rectal Surgeons. Dis Colon Rectum 2004; 47: 1269–1284
14. Nelson H, Petrelli N, Carlin A, Couture J, Fleshman J, Guillem J, et al. Guidelines 2000 for Colon and Rectal Cancer Surgery J Natl Cancer Inst 2001;93:583–96
15. McAndrew MR, Saba A. Efficacy of routine preoperative computed tomography scans in colon cancer. Am Surg 1999;65:205–8.
16. Hundt W, Braunschweig R, Reiser M. Abdominal radiology: evaluation of spiral CT in staging of colon and rectum carcinoma. Eur Radiol 1999;9:78–84.
17. Lavin PT, Day J, Holyoke ED, et al. A statistical evaluation of baseline and follow-up carcinoembryonic antigen in patients with resectable colorectal carcinoma. Cancer 1981;47:823–6.
18. Steele G, Ellenberg S, Ramming K, et al. CEA monitoring among patients in multi-institutional adjuvant therapy protocols. Ann Surg 1982;196:162–9.
19. Zmora O, Mahajna A, Barak B, et al. Colon and rectal surgery without mechanical bowel preparation: randomized prospective trial. Ann Surg 2003;237:363–7.
20. Guenaga KF, Matos D, Castro AA, Atallah AN, Wille-Jorgensen P. Mechanical bowel preparation for elective colorectal surgery. Cochrane Databse Syst Rev 2003;(2):CD001544
21. BucherP, Mermillod B, Morel P, Sovaria C. Does mechanical bowel preparation have a role in preventing postoperativecomplicationsin elective colorectal surgery? Swiss Med Wkly 2004;134(5-6):69-74
22. Baum ML, Anish DS, Chalmers TC, Sacks HS, Smith J, Fagerstrom RM. A survey of clinical trials of antibiotic prophylaxis in colon surgery: evidence against further use of no-treatment controls. N Engl J Med 1981;305: 795–8.
23. Polk HC, Lopez-Mayor JF. Postoperative wound infection: a prospective study of determinant factors and prevention. Surgery 1969;66:97–103.
24. Stone HH, Hooper CA, Kolb LD, Geheber CE, Dawkins EJ. Antibiotic prophylaxis in gastric, biliary, and colonic surgery. Ann Surg 1976;184:443–50.
25. Stone HH, Haney BB, Kolb LD, Geheber CE, Hooper CA. Prophylactic and preventive antibiotic therapy: timing, duration and economics. Ann Surg 1979;189: 691–9.
26. Chung M, Steinmetz OK, Gordon PH. Perioperative blood transfusion and outcome after resection for colorectal carcinoma. Br J Surg 1993;80:427–32.
27. Jensen LS, Kissmeyer-Nielsen P, Wolff B, Qvist N. Randomized comparison of leucocyte-depleted versus buffy-coat poor blood transfusion and complications after colorectal surgery. Lancet 1996;348:841–5.
28. Busch OR, Hop WC, Hoynck MA, Marguet RL, Jeekel J. Blood transfusions and prognosis in colorectal cancer. N Engl J Med 1993;328:1372–6.
29. Tang R, Wang JY, Chien CR, Chen JS, Lin SE, Fan HA. The association between perioperative blood transfusion and survival of patients with colorectal cancer. Cancer 1993;72:341–8.
30. Anonymous. Practice guidelines for blood component therapy. A report by the American Society of Anesthesiologists Task Force on Blood Component Therapy. Anesthesiology 1996;84:732–47.
31. Jensen LS, Andersen AJ, Christiansen PM, et al. Postoperative infection and natural killer cell function following blood transfusion in patients undergoing elective colorectal surgery. Br J Surg 1992;79:513–6.
32. Fischer E, Lenhard V, Seifert P, Kluge A, Johannsen R. Blood transfusion induced suppression of cellular immunity in man. Hum Immunol 1980;3:187–94.
33. van Twuyver E, Mooijaart RJ, Berge IJ, et al. Pretransplantation blood transfusion revisited. N Engl J Med 1991;325:1210–3.
34. Houbiers JG, van de Velde CJ, van de Watering IM, et al. Transfusion of red cells is associated with increased incidence of bacterial infection after colorectal surgery; a prospective study. Transfusion (Paris) 1997;37: 126–34.
35. Vignali A, Braga M, Dionigi P, et al. Impact of a programme of autologous blood donation on the incidence of infection in patients with colorectal cancer. Eur J Surg 1995;161:487–92.
36. Voogt PG, van de Velde CJ, Brand A, et al. Perioperative blood transfusion and cancer prognosis. Cancer 1987;59:836–43.
37. Heiss MM, Mempel W, Delanoff C, et al. Blood transfusion- modulated tumor recurrence; first results of a randomized study of autologous versus allogenic blood transfusion in colorectal cancer surgery. J Clin Oncol 1994;12:1859–67.
38. Vanvakas EC. Perioperative blood transfusion and cancer recurrence, meta-analysis for explanation. Transfusion (Paris) 1995;35:760–8.
39. Collins R, Scrimgeour A, Yusuf S, Peto R. Reduction in fatal pulmonary embolism and venous thrombosis by perioperative administration of subcutaneous heparin. Overview of results of randomized trials in general, orthopedic and urologic surgery. N Engl J Med 1988; 318:1162–73.
40. Ho Y-H, Seow-Choen F, Leong A, Eu K-W, Nyam D, Teoh M-K. Randomized, controlled trial of low molecular weight heparin vs. no deep vein thrombosis prophylaxis for major colon and rectal surgery in Asian patients. Dis Colon Rectum 1999;42:196–203.
41. Kakkar VV, Djazaeri B, Fokm J, Fletcher M, Sculh MF, Westwick J. Low-molecular-weight heparin and prevention of postoperative deep vein thrombosis. Br J Med 1982;284:375–9.
42. Turpie AG, Levin MN, Hirsh J, et al. A randomized controlled trial of a low-molecula-weight heparin (Enoxaprin) to prevent deep-vein thrombosis in patients undergoing elective hip surgery. N Engl J Med 1986;315:925–9.
43. McLeod RS, Geerts WH, Sniderman KW, et al. Subcutaneous heparin versus low-molecular-weight heparin as thromboprophylaxis in patients undergoing colorectal surgery. Results of the Canadian colorectal DVT Prophylaxis Trial: a randomized, double-blind trial. Ann Surg 2001;233:438–44
44. Dentsman F, Lowry A, Vernava A, et al. Practice parameters for the prevention of venous thromboembolism. Dis Colon Rectum 2000;43:1037–47.
45. Rouffet F, Hay JM, Vacher B, Fingerhut A, Elhadad A, Flamant Y, et al. Curative resection for left colonic carcinoma: hemicolectomy vs. segmental colectomy. A prospective, controlled, multicenter trial. French Association for Surgical Research. Dis Colon Rectum. 1994;37:651-9.
46. Malassagne B, Valleur P, Serra J, Sarnacki S, Galian A, Hoang C, Hautefeuille P. Relationship of apical lymph node involvement to survival in resected colon carcinoma. Dis Colon Rectum. 1993;36:645-53.
47. Newland RC, Chapes PH, Smyth EJ. The prognostic value of substaging colorectal cancer. Cancer 1987;60: 852–7.
48. Kawamura YJ, Umetani N, Sunami E, Watanabe T, Masaki T, Muto T. Effect of high ligation on the long-term of patients with operable colon cancer, particularly those with limited nodal involvement. Eur J Surg 2000; 166:803–7.
49. Scott KW, Grace RH. Detection of lymph node metastases in colorectal carcinoma before and after fat clearance. Br J Surg 1989;76:1165–7.
50. Goldstein NS, Sanford W, Coffey M, Layfield LJ. Lymph node recovery from colorectal resection specimens removed for adenocarcinoma. Trends over time and a recommendation for a minimum number of lymph nodes to be recovered. Am J Clin Pathol. 1996;106:209-16.
51. Hernanz F, Revuelta S, Redondo C, Madrazo C, Castillo J, Gomez-Fleitas M. Colorectal adenocarcinoma: quality of the assessment of lymph node metastases. Dis
Colon Rectum 1994;37:373–7.
52. Haboubi NY, Clark P, Kaftan SM, Schofield PF. The importance of combining xylene clearance and immunohistochemistry in the accurate staging of colorectal carcinoma. J R Soc Med 1992;85:386–8.
53. Le Voyer TE, Sigurdson ER, Hanlon AL, Mayer RJ, Macdonald JS, Catalano PJ, Haller DG. Colon cancer survival is associated with increasing number of lymph nodes analyzed: a secondary survey of intergroup trial INT-0089. J Clin Oncol. 2003;21:2912-9.
54. Sarli L, Bader G, Iusco D, Salvemini C, Mauro DD, Mazzeo A, et al. Number of lymph nodes examined and prognosis of TNM stage II colorectal cancer. Eur J Cancer. 2005 Jan;41(2):272-9.
55. Johnson PM, Porter GA, Ricciardi R, Baxter NN. Increasing negative lymph node count is independently associated with improved long-term survival in stage IIIB and IIIC colon cancer. J Clin Oncol. 2006;24:3570-5.
56. Turnbull RB Jr, Kyle K, Watson FR, Spratt J. Cancer of the colon: the influence of the no-touch isolation technic on survival rates. Ann Surg 1967;166:420–7.
57. Wiggers T, Jeekel J, Arends JW, Brinkhorst AP, Kluck HM, Luyk CI, et al. No-touch isolation technique in colon cancer: a controlled prospective trial. Br J Surg 1988;75:409–15.
58. Garcia-Olmo D, Ontanon J, Garcia-Olmo DC, Vallejo M, Cifuentes J. Experimental evidence does not support use of the “no-touch” isolation technique in colorectal cancer. Dis Colon Rectum 1999;42:1449–56
59. Hayashi N, Egami H, Kai M, Kurusu Y, Takano S, Ogawa M. No-touch isolation technique reduces intraoperative shedding of tumor cells into the portal vein during resection of colorectal cancer. Surgery 1999;125:369–74.
60. Welch JP. Multiple colorectal tumors: an appraisal of natural history and therapeutic options. Am J Surg 1981;142:274–80.
61. Whelan RL, Wong WD, Goldberg SM, Rothenberger DA. Synchronous bowel anastomoses. Dis Colon Rectum 1989;32:365–8.
62. Sugerbaker PH, Corlew S. Influence of surgical techniques on survival in patients with colorectal cancer: a review. Dis Colon Rectum 1982;25:545–57.
63. Lopez MS, Monafo WW. Role of extended resection in the initial treatment of locally advanced colorectal carcinoma. Surgery 1993;113:365–72.
64. Gall FP, Tonak J, Altendorf A. Multivisceral resections in colorectal cancer. Dis Colon Rectum 1987;30:337–41.
65. Hunter JA, Ryan JA, Schultz P. En bloc resection of colon cancer adherent to other organs. Am J Surg 1987;154:67–71.
66. Talamonti MS, Shumate CR, Carlson GW, Curley SA. Locally advanced carcinoma of the colon and rectum involving the urinary bladder. Surg Gynecol Obstet 1993;177:481–7.
67. Mulsow J, Winter DC, O'Keane C, O'Connell PR. Sentinel lymph node mapping in colorectal cancer. Br J Surg. 2003;90:1452.
68. Joosten JJ, Strobbe LJ, Wauters CA, Pruszczynski M, Wobbes T, Ruers TJ. Intraoperative lymphatic mapping and the sentinel node concept in colorectal carcinoma. Br J Surg. 1999;86:482-6.
69. Kitagawa Y, Watanabe M, Hasegawa H, Yamamoto S, Fujii H, Yamamoto K, et al. Sentinel node mapping for colorectal cancer with radioactive tracer. Dis Colon Rectum. 2002 Nov;45(11):1476-80.
70. Bertagnolli M, Miedema B, Redston M, Dowell J, Niedzwiecki D, Fleshman J, et al. Sentinel node staging of resectable colon cancer: results of a multicenter study. Ann Surg. 2004;240:624-8.
71. Young-Fadok TM, Wolff BG, Nivatrongs S, Metzger PP, Ilstrup DM. Prophylactic oophorectomy in colorectal carcinoma: preliminary results of a randomized, prospective trial. Dis Colon Rectum 1998;41: 277–85.
72. Morrow M, Enker WE. Late ovarian metastases in carcinoma of the colon and rectum. Arch Surg 1984;119: 1385–8.
73. Stocchi L, Nelson H. Laparoscopic colectomy for colon cancer: Trial update. J Surg Oncol 1998;68:255–67.
74. Runkel HS, Hinz U, Lehnert T, Buhr HJ, Herfarth C. Improved outcome after emergency surgery for cancer of the large intestine. Br J Surg 1998;85:1260–5.
75. Smithers BM, Theile DE, Cohen JR, Evans EB, Davis NC. Emergency right hemicolectomy in colon carcinoma: a prospective study. ANZ J Surg 1986;56:749– 52.
76. Matheson NA. Management of obstructed and perforated large bowel carcinoma. Bailleires Clin Gastroenterol 1989;3:671–97.
77. Lopez-Kostner F, Hool GR, Lavery IC. Management and causes of acute large bowel obstruction. Surg Clin North Am 1997;77:1265–90.
78. The SCOTIA Group. Single stage treatment for malignant left-sided colonic obstruction: a prospective randomized clinical trial comparing subtotal colectomy with segmental resection following intraoperative irrigation. Br J Surg 1995;82:1622–7.
79. Kopera T, Kisser M, Schultz F. Emergency surgery for colon cancer in the aged. Arch Surg 1997;132:1032–7.
80. Perrier G, Peillon C, Liberge N, Steinmetz L, Boyet L, Testart J. Cecostomy is a useful surgical procedure: study of 113 colonic obstructions caused by cancer. Dis Colon Rectum 2000;43:50–4.
81. Kronberg O. Acute obstruction from tumor in the left colon without spread. A randomized trial of emergency colostomy versus resection. Int J Colorectal Dis 1995;10:1–5.
82. Dauphine CE, Tan P, Beart RW, Vukasin P, Cohen H, Corman ML. Placement of self-expanding metal stents for acute management of large-bowel obstruction: a collective review. Ann Surg Oncol 2002;9:574–9.
83. Spinelli P, Mancini A. Use of self-expanding metal stents for palliation of rectosigmoid cancer. Gastrointest Endosc 2001;53:203–6.
84. Binkert CA, Ledermann H, Jost R, Saurenmann P, Decurtins M, Zollikofer CL. Acute colonic obstruction: clinical aspects and cost-effectiveness of preoperative and palliative treatment with self-expanding metallic stents: a preliminary report. Radiology 1998;206:199–204.
85. Camunez F, Echenagusia A, Simo G, Turgano F, Vasquez J, Barreiro-Meiro I. Malignant colorectal obstruction treated by means of self-expanding metallic stents: effectiveness before surgery and in palliation. Radiology 2000;216:492–7.
86. Corman ML. Carcinoma of the colon. In: Corman ML, editor. Colon and rectal surgery. Philadelphia: Lippincott- Raven 1998, p:625–732.
87. Vernava AM, Moore BA, Longo WE, Johnson FE. Lower gastrointestinal bleeding. Dis Colon Rectum 1997;40:846–58.
88. Parkes BM, Obeid FN, Sorensen VJ, Horst HM, Fath JJ. The management of massive lower gastrointestinal bleeding. Am Surg 1993;59:676–8.
89. Farner F, Lichliter W, Kuhn J, Fisher T. Total colectomy versus limited colonic resection for acute lower gastrointestinal bleeding. Am J Surg 1999;178:587–91.
Οι τεχνικές δυσκολίες της χειρουργικής του ορθού
Τα σύγχρονα επιδημιολογικά δεδομένα δείχνουν ότι, παγκοσμίως, 737.000 άνθρωποι διαγιγνώσκονται με καρκίνο του ορθού (GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 11 (Internet). Lyon, France: International Agency for Research on Cancer. http://globocan.iarc.fr.). Η σταθερή και πλέον αποδεκτή, δυνητικά θεραπευτική, χειρουργική τεχνική για την αντιμετώπιση του καρκίνου του ορθού είναι η ολική μεσοορθική εκτομή, η οποία και πρέπει να αποτελεί το απαραίτητο συστατικό κάθε μεθόδου που φιλοδοξεί να προσφέρει χειρουργική θεραπεία για τον καρκίνο αυτό. Μετά την «ανοικτή» ολική μεσοορθική εκτομή, όπως αυτή αρχικά περιγράφηκε από τον Heald, ο εμπλουτισμός του χειρουργικού οπλοστασίου με την ελάχιστα επεμβατική, λαπαροσκοπική ολική μεσοορθική εκτομή εξέγειρε ανησυχίες όσον αφορά την ογκολογική ασφάλειά της λαπαροσκοπικής προσπέλασης. Βέβαια η λαπαροσκοπική είχε ήδη από νωρίτερα, αποδείξει την ισοδυναμία της με την «ανοικτή» προσπέλαση στην αντιμετώπιση του υπόλοιπου παχέος εντέρου, πλην του ορθού. Πολυκεντρικές μελέτες που εστίασαν στον καρκίνο του ορθού, όπως η COLOR II (COlorectal cancer Laparoscopic or Open Resection) ανέδειξαν ότι η λαπαροσκοπική οδηγεί σε καλυτερα βραχυπρόθεσμα αποτελέσματα συγκριτικά με την «ανοικτή» χειρουργική, ενώ τα ογκολογικά αποτελέσματα μακροπρόθεσμα δεν υστερούν. Παρ’ όλα αυτά, τόσο στην «ανοικτή» όσο και στη λαπαροσκοπική χειρουργική η παρασκευή του μέσου και του κατώτερου τριτημορίου του ορθού είναι τεχνικά απαιτητική λόγω της «εκλέπτυνσης» του μεσοορθού στο κατώτερο τμήμα του, αλλά και της φυσιολογικά πρόσθιας γωνίωσης του περιφερικού ορθού. Έτσι το κατώτερο ορθό καθίσταται εξ’ ορισμού λιγότερο προσβάσιμο από την κοιλιά.
Πέραν των τεχνικών δυσκολιών, οι παραπάνω ανατομικοί παράγοντες προδιαθέτουν σε «ατελή» μεσοορθική εκτομή στο κατώτερο τμήμα του ορθού. Αυτό θα μπορούσε να οδηγήσει σε ανεπαρκή «καθαρισμό» των περιμετρικών «πλαγίων» ορίων των όγκων, γεγονός που αυξάνει αναπόφευκτα την πιθανότητα της τοπικής υποτροπής. Επιπλέον, λόγω των τεχνικών δυσκολιών που προκύπτουν από τη στενή πύελο, η διατομή του παρασκευάσματος με τα ειδικά σχεδιασμένα συρραπτικά και η επακόλουθη αναστόμωση μπορεί να αποβούν επισφαλή ή και ανεπαρκή.
Μία αποτυχία δε, σε μία στενή, βαθιά πύελο δεν είναι εύκολα επισκευάσιμη από την κοιλιά και οδηγεί, τουλάχιστον στις λαπαροσκοπικές επεμβάσεις, σε μεγαλύτερα ποσοστά «μετατροπών» σε «ανοικτές», προκειμένου να διευκολυνθούν αυτά τα ιδιαίτερα κρίσιμα βήματα, αυτό της διατομής και εκείνο της αναστόμωσης. Μάλιστα τα αναφερόμενα ποσοστά «μετατροπών» στις λαπαροσκοπικές ολικές μεσοορθικές εκτομές ανέρχονται σε 34%, ποσοστά πολύ μεγαλύτερα από τα αντίστοιχα που αφορούν τη λαπαροσκοπική χειρουργική του υπόλοιπου παχέος εντέρου. «Μετατροπές» απαιτούνται συχνά σε άνδρες, παχύσαρκους και σε περιπτώσεις ευμεγέθων όγκων, που περιορίζουν το χώρο εργασίας στο στενό χώρο της πυέλου, αλλά και τους χειρισμούς του ορθού με τα λαπαροσκοπικά εργαλεία. Οι τεχνικές δυσκολίες και οι επακόλουθες «κακότεχνες» αναστομώσεις ή και οι αναστομωτικές διαφυγές, οι οποίες συνηθέστερα είναι το αποτέλεσμα ανεπαρκούς τεχνικής, οδηγούν και σε χειρότερα λειτουργικά προβλήματα της αφόδευσης.
Οι προσπάθειες αντιμετώπισης των προβλημάτων της χειρουργικής του κατώτερου ορθού: Πώς φθάσαμε στην ta-TME;
Με στόχο τη βελτίωση της όρασης εντός της πυέλου και την επίτευξη καταλληλότερου και επαρκέστερου χειρουργικού πεδίου, αλλά και αποσκοπώντας στη μακροπρόθεσμη λειτουργική και ογκολογική αναβάθμιση αυτών των δύσκολων σφιγκτηροσωστικών επεμβάσεων, ο G. Marks, τη δεκαετία του 1990, εισήγαγε τη «διαπρωκτική διακοιλιακή» (Transanal Transabdominal, TATA) τεχνική. Αυτή η τεχνική περιελάμβανε μία «ανοικτή», διαπρωκτική «από κάτω» προπέλαση για καρκίνους του κατώτερου τριτημορίου του ορθού.
Η είσοδος των λαπαροσκοπικών επεμβάσεων «διά μίας οπής» (“single-port”) και η εμφάνιση πλατφόρμων ειδικά σχεδιασμένων για αυτόν τον σκοπό έδωσε την ιδέα της χρήσης τους και για διαπρωκτική ελάχιστα επεμβατική χειρουργική, και, κατ’ επέκταση, αυτή να καταστεί δυνατή και για την ολική μεσοορθική εκτομή αρχικά από το Lacy το 2010. Η διαπρωκτική εκτέλεση της ολικής μεσοορθικής εκτομής του κατώτερου ορθού με τη βοήθεια ειδικής πλατφόρμας, που περιλαμβάνει κανάλι εργασίας, κατάλληλο να υποδέχεται πολλαπλά trocars, χρησιμοποιεί ειδικά σχεδιασμένα ή και «συμβατικά» λαπαροσκοπικά εργαλεία και βασίζεται στην εμφύσηση CO2 περιμεσοορθικά για τη διάνοιξη πλάνων και τη διευκόλυνση της παρασκευής υπό λαπαροσκοπική όραση, έγινε γνωστή ως διαπρωκτική ολική μεσοορθική εκτομή (Transanal Τotal Mesorectal Excision) και φέρεται διεθνώς με το ακρωνύμιο ta-TME.
Βέβαια ο αρχικός σχεδιασμός και η δυνατότητα χρήσης ειδικών πρωκτοσκοπίων για την εκτέλεση διαπρωκτικών ενδοσκοπικών επεμβάσεων, όπως τοπικών αφαιρέσεων αδενωμάτων και πρώιμων καρκίνων του ορθού, με την υποβοήθηση του χώρου που δημιουργείται μετά την εμφύσηση και πλήρωση του ορθού με CO2 (πνευμο-ορθό), ανήκουν στον Buess. To 1983 εισήγαγε την τεχνική της «διαπρωκτικής ενδοσκοπικής μικροχειρουργικής» (Transanal Endoscopic Microsurgery, TEM). Όμως η ΤΕΜ απαιτεί τη χρήση ενός μεγάλου, άκαμπτου πρωκτοσκοπίου, ο εξοπλισμός που χρησιμοποιείται προορίζεται μόνο για αυτή την τεχνική και είναι ακριβός. Ως εναλλακτική στην ΤΕΜ και σε μία άλλη, πιο οικονομική παρόμοια, όμως, πλατφόρμα, αυτή της ΤΕΟ, οι Atallah και συν, το 2010, απέδειξαν τη δυνατότητα χρήσης μιας εύχρηστης πλατφόρμας, που αποτελείτο από λαπαροσκοπικό κανάλι εργασίας, ίδιο με αυτό που χρησιμοποιείτο και για τη χειρουργική «διά μίας οπής» (“single-incision
laparoscopic port”) και από συμβατικό λαπαροσκοπικό εξοπλισμό, δηλαδή λαβίδες, εργαλεία παρασκευής και συσκευές εμφύσησης, που χρησιμοποιούνται και στην «κλασσική» λαπαροσκοπική χειρουργική. Η τεχνική αυτή ονομάστηκε «διαπρωκτική ελάχιστα επεμβατική χειρουργική» (“Transanal Minimally invasive Surgery”) και φέρεται διεθνώς με το ακρωνύμιο TAMIS.
Στην ta-TME προσφέρεται η δυνατότητα εκτέλεσης λαπαροενδοσκοπικής, δια του πρωκτού, ανάστροφης, «από τα κάτω-προς τα πάνω», ριζικής αφαίρεσης του ορθού χρησιμοποιώντας τις πλατφόρμες ΤΕΜ/ΤΕΟ ή της TAMIS, με την τελευταία να είναι η πιο δημοφιλής για το σκοπό αυτό. Η εκτομή αυτή έχει ήδη αποδειχθεί να είναι εφικτή και ασφαλής και να προσφέρει τη δυνατότητα επίτευξης «καθαρών» ογκολογικά περιφερικών και περιμετρικών ορίων εκτομής για τους καρκίνους του ορθού που έχει εφαρμοστεί.
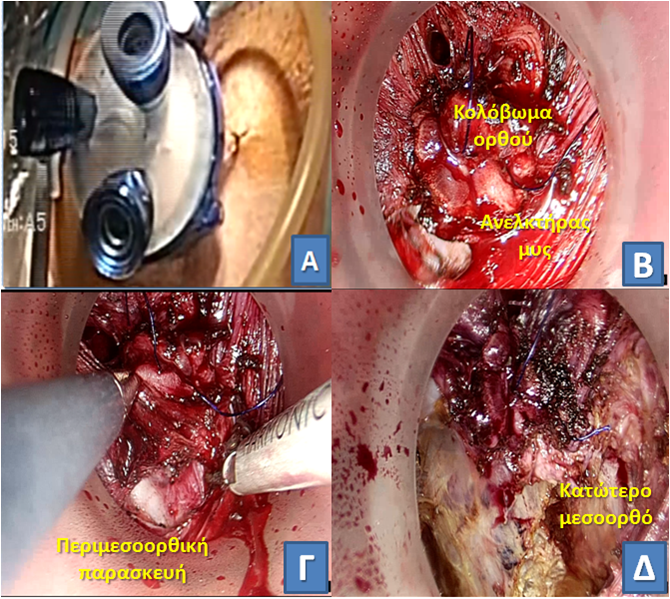
Η διαπρωκτική ολική μεσοορθική εκτομή (ta-TME)
A. Το διαπρωκτικό κανάλι εργασίας της TAMIS (GelPOINT® Path TRANSANAL ACCESS PLATFORM, Applied Medical), που χρησιμοποιείται συνήθως
Β, Γ, Δ. Διπρωκτική παρασκευή πέριξ του μεσοορθού του κατώτερου ορθού υπό λαπαροσκοπική όραση για την ta-TME
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
Τα πλεονεκτήματα της ta-TME
Η ta-TME δεν μπορεί να θεωρηθεί ως μία απολύτως καινούρια τεχνική που επινοήθηκε εκ του ουδενός. Εκμεταλλεύεται, όμως τα πιο σημαντικά επιστημονικά και τεχνολογικά επιτεύγματα των τελευταίων 30 ετών στη χειρουργική του ορθού, και τα συνδυάζει σε μία τεχνική. Μπορεί να συνδυαστεί με μία διακοιλιακή λαπαροσκοπική επέμβαση, η οποία δεν μπορεί να ολοκληρωθεί λαπαροσκοπικά, διότι η πυελική παρασκευή μπορεί να παρεμποδίζεται από τη στενότητα του χώρου και από το μέγεθος του όγκου στο κατώτερο ορθό. Αντί να εξελιχθεί η επέμβαση σε μία «μετατροπή» σε «ανοικτή», μπορεί να ολοκληρωθεί με τη συμπλήρωση μιας ογκολογικής αφαίρεσης του κατώτερου ορθού με τη βοήθεια της ta-TME. Eξάλλου, αυτή είναι και η ογκολογικά πιο δύσκολη περιοχή, αφού η επαρκής πλήρης αφαίρεση της μεσοορθικής «ουράς», δηλαδή του μεσοορθού που αντιστοιχεί στο κατώτερο τριτημόριο του ορθού, πολλές φορές δεν είναι καθόλα επιτυχής. Ο ίδιος ο Heald, πατέρας και εμπνευστής της «ανοικτής» ολικής μεσοορθικής εκτομής, είχε, παλαιότερα, δηλώσει ότι «μία ενδοσκοπική διαπρωκτική πλατφόρμα που θα προοριζόταν για τη χειρουργική παρασκευή του κατώτερου ορθού θα έφερνε επανάσταση στην προσπέλαση της πιο δύσκολης ζώνης του «ιερού πλάνου» της μεσοορθικής εκτομής, αυτής που βρίσκεται στην κατώτερη πύελο».
Εκτός από τις λιγότερες «μετατροπές», η συστηματική εφαρμογή της ta-TME θα οδηγήσει στη βελτίωση της ποιότητας των παρασκευασμάτων λόγω της ογκολογικής ριζικότητας που επιτυγχάνεται με την καλύτερη όραση της δύσβατης περιοχής του κατώτερου μεσοορθού, σε ελαττωμένη νοσηρότητα και επιπλοκές από τις κολοπρωκτικές αναστομώσεις, λόγω των «καλύτερων» αναστομωτικών τεχνικών που, με τις κατάλληλες τεχνικές τροποποιήσεις, θα γίνονται διαπρωκτικά και σε περισσότερες σφιγκτηροσωστικές επεμβάσεις χωρίς να διακυβεύεται το ογκολογικό αποτέλεσμα της επέμβασης.
Σε μία πρόσφατη συστηματική ανασκόπηση, που δημοσιεύθηκε στο περιοδικό Techniques in Coloproctology το 2015, όπου συγκεντρώθηκε η εμπειρία από τους πρώτους 150 ασθενείς που αντιμετωπίστηκαν σε 16 κέντρα, η νοσηρότητα και οι ογκολογικές παράμετροι από τα χειρουργικά παρασκευάσματα ήταν απόλυτα ικανοποιητικές. Υπό την αιγίδα του Α. Lacy, βασικού εμπνευστή και με τη μεγαλύτερη εμπειρία χειρουργού στην ta-TME, έχει ξεκινήσει μία τυχαιοποιημένη, διεθνής, πολυκεντρική μελέτη, η COLOR III, που σαν στόχο έχει τη σύγκριση μεταξύ της λαπαροσκοπικής ολικής μεσοορθικής εκτομής και της ta-TME για όγκους του μέσου και του κατώτερου ορθού.
Ο Γ. Θεοδωρόπουλος παρακολούθησε το εκπαιδευτικό σεμινάριο για την ta-TME που διοργανώθηκε στα πλαίσια του Ετησίου Συνεδρίου για το 2016 της Αμερικανικής Εταιρείας Χειρουργών Παχέος Εντέρου (Αmerican Society of Colon and Rectal Surgeons) στο Los Angeles των ΗΠΑ (Μάιος 2016). Έχει διενεργήσει την πρώτη ta-TME σε Ελληνικό Δημόσιο Νοσοκομείο χρησιμοποιώντας την πλατφόρμα της TAMIS (GelPOINT® Path TRANSANAL ACCESS PLATFORM, Applied Medical) και στο 30ο Πανελλήνιο Χειρουργικό Συνέδριο (Νοέμβριος 2016) στη Θεσσαλονίκη, παρουσίασε μία διαπρωκτική αναστομωτική τεχνική με ειδικό κυκλικό αναστομωτήρα, η οποία μπορεί να χρησιμοποιηθεί στην ta-TME.
Η ανατομική βάση της μεσοσφιφκτηριακής εκτομής
Η ολική μεσοορθική εκτομή είναι ουσιαστικής ογκολογικής σημασίας και αποτελεί απαραίτητο τμήμα όλων των χειρουργικών τεχνικών που εφαρμόζονται για τη ριζική χειρουργική αντιμετώπιση των καρκίνων του μέσου και του κατώτερου ορθού, δηλαδή αυτών που εντοπίζονται σε απόσταση έως και 12 cm από το πρωκτικό άνοιγμα. Περιλαμβάνει την πλήρη αφαίρεση του λιπώδους περιβλήματος του ορθού, το οποίο περιέχει λεμφαγγειακό ιστό, λεμφαδένες και τυχόν εναποθέσεις καρκινικών κυττάρων που μεταναστεύουν στο λιπώδη ιστό μετά από νεοπλασματική διήθηση του μυϊκού χιτώνα του ορθού. Η ολική αφαίρεση του μεσοορθού λαμβάνει χώρα περιμετρικά, οπισθίως, πλαγίως και προσθίως διατηρώντας ανέπαφη την ιδίως μεσοορθική περιτονία, η οποία αποτελεί το σπλαγχνικό πέταλο της πυελικής περιτονίας και περιβάλει πλήρως το μεσοορθικό λίπος. Ο ανάγγειος περι-μεσοορθικός χώρος, ο οποίος, χειρουργικά, παρασκευάζεται οξέως, και ποτέ αμβλέως, αντιστοιχεί:
- Κατά το οπίσθιο τμήμα του στον προϊερό χώρο, δηλαδή στο διάστημα μεταξύ της προϊεράς περιτονίας (τοιχωματικό πέταλο της πυελικής περιτονίας) και της ιδίως μεσοοορθικής περιτονίας (σπλαγχνικό πέταλο της πυελικής περιτονίας), οι οποίες συντήκονται οπισθίως του κατώτερου ορθού στην ενιαία στερεά περιτονία Waldayers.
- Στα πλάγια στο χώρο ανάμεσα στη σπλαγχνική μεσοορθική περιτονία και τις περιτονίες των πλαγίων μυών της πυέλου. Στον πλάγιο μεσοορθικό ιστό, ο οποίος παλαιότερα αναφερόταν ως «πλάγιοι σύνδεσμοι» εισέρχονται αυτόνομα νεύρα του ορθού και οι συχνά υποτροφικά, αν όχι ανύπαρκτα μέσα αιμορροϊδικά αγγεία.
- Προσθίως αντιστοιχεί στη σύντηξη της πρόσθιας μοίρας του σπλαγχνικής πυελικής περιτονίας με την οπισθοκυστική περιτονία, που φέρεται ως περιτονία Denonvilliers.
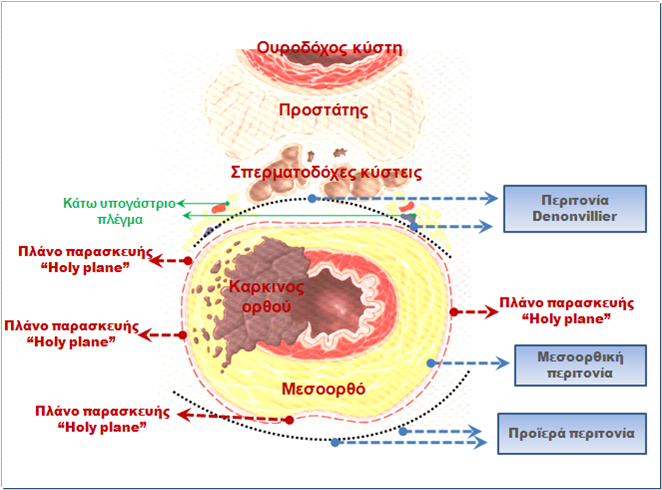
Η ολική μεσοορθική εκτομή αποτελεί αναπόσπαστο κομμάτι κάθε σωστής ογκολογικά επέμβασης για καρκίνο του ορθού. Φαίνονται διαγραμματικά οι ανατομικές σχέσεις με σημαντικές δομές της περιοχής
Το πέρας του ορθού αντιστοιχεί και με το κατώτερο σημείο στο οποίο εκτείνεται το μεσοορθικό λίπος, το οποίο είναι γνωστό και ως «μεσοορθική ουρά» οπισθίως, ενώ καθίσταται σχεδόν ανύπαρκτο προσθίως του κατώτερου ορθού. Ο ορθοπρωκτικός δακτύλιος, δηλαδή η πρόσφυση του ανελκτήρα μυός στο κατώτερο ορθό, οριοθετεί το σημείο μετάπτωσης του ορθού στον πρωκτικό αυλό. Ο ανελκτήρας συνέχεται ανατομικά με τον έξω σφιγκτήρα, ο οποίος περιβάλει τον πρωκτικό αυλό. Η συνέχεια του κυκλοτερούς μυϊκού χιτώνα του ορθού αποτελεί τον έσω σφιγκτήρα του πρωκτού. Ο χώρος ανάμεσα στον έσω και στον έξω σφιγκτήρα αποτελεί τη φυσική συνέχεια του περι-μεσοορθικού διαστήματος, οπότε η περιμετρική παρασκευή στο ανάγγειο πλάνο της ολικής μεσοορθικής εκτομής μπορεί να επεκταθεί περιφερικά για όγκους του κατώτερου ορθού που εμφανίζουν επέκταση στο πρωκτικό κανάλι. Αυτή η τακτική εμφανώς απαιτεί αφαίρεση άλλοτε άλλου μήκους του έσω σφιγκτήρα. Το τμήμα του σφιγκτήρα που θα αφαιρεθεί θα καθορισθεί από το απώτερο όριο του πρωκτικού αυλού, το οποίο θα αποτελέσει και το περιφερικό όριο εκτομής προκειμένου να επιτευχθεί το επιθυμητό ογκολογικά περιφερικό όριο εκτομής. Το τελευταίο βιβλιογραφικά υποστηρίζεται ότι πρέπει να είναι από μικροσκοπικά ελεύθερο διηθήσεως έως και 1 εκατοστό.
Στη βάση (α) των ανωτέρω ανατομικών δεδομένων, (β) της απόδειξης ότι η περιφερική εξάπλωση του καρκίνου του κατώτερου ορθού είναι μάλλον σπάνιο ιστολογικό φαινόμενο (γεγονός που έχει ελαχιστοποιήσει το μήκος του ογκολογικά αναγκαίου περιφερικού ορίου) και (γ) του γεγονότος ότι το σύμπλεγμα των γραμμωτών μυών ανελκτήρα και έξω σφιγκτήρα είναι διαφορετικό όργανο από το σύμπλεγμα του έσω σφιγκτήρα-πρωκτού που αποτελούν φυσική ανατομική συνέχεια του κατώτερου ορθού προς τα κάτω (οπότε η αφαίρεση του δεν είναι ογκολογικά αναγκαία στα πλαίσια της κοιλιοπερινεϊκής εκτομής, εκτός και αν διηθείται κατά συνέχεια ιστού - το τελευταίο το αποκλείει η σταδιοποιητική αξιολόγηση με τη μαγνητική τομογραφία), αναπτύχθηκε η μεσοσφιγκτηριακή εκτομή για την αντιμετώπιση επιλεγμένων καρκίνων του κατώτερου ορθού.
Η μεσοσφιγκτηριακή εκτομή, που περιγράφηκε για πρώτη φορά από τους Schiessel και συν το 1994, «εκμεταλλεύεται» το ανάγγειο πλάνο ανάμεσα στις λείες μυϊκές ίνες (τον έσω σφιγκτήρα) και τις γραμμωτές μυϊκές ίνες (το σύμπλεγμα έξω σφιγκτήρα- ανελκτήρα μυός) για να πετύχει την επιθυμητή ισορροπία ανάμεσα σε μία επαρκή ογκολογική επέμβαση και στη διατήρηση της εγκράτειας.
Κατά τη μεσοφιγκτηριακή εκτομή, η οποία αποτελεί την επέκταση της χαμηλής πρόσθιας εκτομής, ο έσω σφιγκτήρας συναφαιρείται μερικώς ή και πλήρως, προκειμένου να επιτευχθεί ένα περιμετρικά ολικού πάχους επαρκές ογκολογικά περιφερικό όριο. Λόγω του «σεβασμού» στην ακεραιότητα του απαραίτητου για την εγκράτεια των κοπράνων μυϊκού συμπλέγματος ανελκτήρα – έξω σφιγκτήρα, η μεσοσφιγκτηριακή εκτομή θεωρείται η «απόλυτη» σφιγκτηροσωστική επέμβαση και, μαζί με την υποσταδιοποιητική δράση της νέο-επικουρικής χήμειο-ακτινοθεραπείας, βοηθά στην αποφυγή της κοιλιοπερινεϊκής εκτομής, με αποτέλεσμα τα καλύτερα λειτουργικά αποτελέσματα, την πιο ικανοποιητική ποιότητα ζωής, χωρίς να κινδυνεύει το ογκολογικό αποτέλεσμα, εφόσον εφαρμοστούν οι χειρουργικές αρχές της σωστής ανατομικής παρασκευής.
Οι ενδείξεις της μεσοσφιγκτηριακής εκτομής
Μεσοσφιγκτηριακή εκτομή μπορεί να διενεργηθεί για οποιοδήποτε καρκίνο του κατώτερου ορθού που επεκτείνεται εντός του πρωκτικού καναλιού (τα 3-4 εκατοστά από τον ορθοπρωκτικό δακτύλιο, σημείο πρόσφυσης της ηβοορθικής μοίρας του ανελκτήρα μυός, έως το πρωκτικό άνοιγμα). Αυστηρότερα κριτήρια επιλογής έχουν, ωστόσο, θεσπιστεί και πρέπει να πληρούνται για όγκους του κατώτερου ορθού προκειμένου τη διενέργεια της μεσοσφιγκτηριακής εκτομής. Συνοψίζονται στα παρακάτω:
(α) Ο όγκος να βρίσκεται σε απόσταση 3 εκατοστών από το πρωκτικό άνοιγμα
(β) Ο όγκος να βρίσκεται σε απόσταση 1,5 εκατοστών από την οδοντωτή γραμμή
(γ) Ο όγκος να φθάνει σε απόσταση έως και 1 εκατοστό κάτω από τον ορθοπρωκτικό δακτύλιο
(δ) Η νεοπλασματική διήθηση να περιορίζεται στο τοίχωμα του ορθού ή στον έσω σφιγκτήρα
(ε) Να υφίσταται επαρκής σφιγκτηριακή λειτουργία και εγκράτεια
(στ) Να μην υπάρχει απομακρυσμένη μεταστατική νόσος
Αντενδείξεις της μεσοσφιγκτηριακής εκτομής είναι:
(α) Η παρουσία ακράτειας κοπράνων
(β) Οι καρκίνοι σταδίου Τ4
(γ) Οι αδιαφοροποίητοι ιστολογικά όγκοι
(δ) Όγκοι που διηθούν τον ανελκτήρα ή τον έξω σφιγκτήρα
Σε κάποιες μελέτες έχει υποστηριχθεί ότι η χορήγηση νέο-επικουρικής (χήμειο-) ακτινοθεραπείας είναι σχετική αντένδειξη για την εκτέλεση μεσοσφιγκτηριακής εκτομής, λόγω της επιπλέον επιβάρυνσης της σφιγκτηριακής λειτουργίας. Στη μελέτη του Denost και συν, ωστόσο, το 93% των ασθενών που υποβλήθηκαν σε μεσοσφιγκτηριακή εκτομή είχαν λάβει προεγχειρητική χημειοθεραπεία. Πρέπει να τονιστεί ότι σε ασθενείς με ικανοποιητική σφιγκτηριακή λειτουργία κατά τη δακτυλική εξέταση, αλλά με πρόσφατη κλινική έναρξη ακράτειας, η δυσλειτουργία μπορεί να αποδοθεί στην ύπαρξη της νεοπλασματικής εξεργασίας στο κατώτερο ορθό, οπότε και σε αυτή την ομάδα των ασθενών μπορεί να αναμένεται μετεγχειρητική βελτίωση της σφιγκτηριακής λειτουργίας σε σύγκριση με αυτήν που είχαν αμέσως πριν τη διενέργεια της μεσοσφιγκτηριακής εκτομής. Αν και η ηλικία αφ’εαυτής δεν αποτελεί κριτήριο αποκλεισμού, πρέπει να λαμβάνεται σοβαρά υπόψη το γεγονός ότι οι περισσότερο ηλικιωμένοι ασθενείς έχουν μάλλον ελαττωμένο τόνο του σφιγκτήρα και λιγότερη μυϊκή μάζα στο σφιγκτηριακό σύμπλεγμα, τα οποία είναι επιβαρυντικά στοιχεία στην προσπάθεια διατήρησης επαρκούς σφιγκτηριακής λειτουργίας μετά τη μεσοσφιγκτηριακή εκτομή. Η κατατομή του σώματος του ασθενούς παίζει, επίσης, ρόλο στην απόφαση για την επιλογή της τεχνικής, αφού ο ιδεώδης δείκτης μάζας σώματος ενδείκνυται να είναι <32. Άρρενες ασθενείς με στενή πύελο και, ιδιαίτερα μακρύ πρωκτικό κανάλι μπορεί να δυσχεράνουν την εκτέλεση της μεσοσφιγκτηριακής εκτομής.
Η απόφαση για την επιλογή και η ικανότητα για την ολοκλήρωση μιας σφιγκτηροσωστικής επέμβασης πρέπει να καθορίζεται πέρα από την εμπειρία του χειρουργού και από την ύπαρξη της απαραίτητης εξειδίκευσης του στη χειρουργική του παχέος εντέρου και του πρωκτού.
Η προεγχειρητική προετοιμασία
Η προεγχειρητική επιλογή των ασθενών είναι ουσιαστικής σημασίας. Η λήψη προσεκτικού ιστορικού και η ολοκληρωμένη αντικειμενική εξέταση του ασθενούς προεξάρχει οποιουδήποτε παρακλινικού και απεικονιστικού – σταδιοποιητικού ελέγχού. Το ύψος στο οποίο εντοπίζεται ο καρκίνος και η σχέση του με κάθε ένα από τα ανατομικά συστατικά του σφιγκτηριακού συμπλέγματος, η παρουσία τυχόν λεμφαδενικής διήθησης ή απομακρυσμένων μεταστάσεων, η τοπικο-περιοχική επέκταση της πρωτοπαθούς εστίας και το περιμετρικό όριο προσβολής του μεσοορθού αξιολογούνται από τη διενέργεια της κλινικής δακτυλικής εξέτασης, της άκαμπτης ορθοσκόπησης, των αξονικών τομογραφιών θώρακα και κοιλίας και της μαγνητικής τομογραφίας πυέλου υψηλής ανάλυσης με ειδικό πρωτόκολλο ακολουθιών για τον καρκίνο του πρωκτού.
Ο μηχανικός καθαρισμός του παχέος εντέρου την προηγούμενη του χειρουργείου εξακολουθεί να είναι αναγκαίος για τις επεμβάσεις που διενεργούνται για τον καρκίνο του ορθού, οι οποίες ακολουθούνται από αποκατάσταση της εντερικής συνέχειας. Οι κατάλληλες θέσεις στομίας, ειδικά της προστευτικής loop ειλεοστομίας (που συνήθως συνοδεύει την επέμβαση μετά το πέρας της) πρέπει να σημειώνονται στο κοιλιακό τοίχωμα πριν από την επέμβαση. Απαραίτητη είναι η θρομβοπροφύλαξη με ηπαρίνη χαμηλού ΜΒ το προηγούμενο βράδυ και η χορήγηση αντιβιοτικής χημειοπροφύλαξης, όπως και σε όλα τα ογκολογικά χειρουργεία του παχέος εντέρου.
Η χειρουργική τεχνική
Η μεσοσφιγκτηριακή εκτομή περιλαμβάνει έναν κοιλιακό και έναν περινεϊκό χρόνο. Η φάση της κοιλιακής παρασκευής διενεργείται «ανοικτά» ή λαπαροσκοπικά. Το πρώτο βήμα του κοιλιακού τμήματος της επέμβασης αποτελείται από την υψηλή απολίνωση της κάτω μεσεντερίου αρτηρίας και την πλήρη κινητοποίηση της σπληνικής καμπής, συμπεριλαμβανομένης και της απολίνωσης της κάτω μεσεντερίου φλέβας κάτω από τη ουρά του παγκρέατος. Αυτή η κινητοποίηση θα προσφέρει το απαραίτητο μήκος στο τμήμα του αριστερού κόλου το οποίο θα χρειαστεί να κατέλθει έως το πρωκτικό κανάλι προκειμένου την «πολύ χαμηλή» κολο-πρωκτική αναστόμωση στο τέλος της επέμβασης. Το δεύτερο βήμα της κοιλιακής επέμβασης είναι η διενέργεια της ολικής μεσοορθικής εκτομής, η οποία πρέπει να εκτελείται ακολουθώντας την αυστηρά οξεία παρασκευή κατά μήκος των ανάγγειων εμβρυολογικών πλάνων μεταξύ της ιδίως μεσοορθικής και της προϊεράς τοιχωματικής περιτονίας και τη διατήρηση των υπογαστρίων νευρικών πλεγμάτων. H παρασκευή εκτελείται όσο «πιο βαθιά» είναι εφικτό, ώστε να αποκαλυφθεί το πυελικό έδαφος και να γίνει ορατός ο ηβοορθικός μυς, ο οποίος αποτελεί τη μοίρα του ανελκτήρα που περιβάλλει και βρίσκεται σε άμεση επαφή με το κατώτερο ορθό από πίσω και από τα πλάγια. Αυτή η πλήρης κατά το δυνατόν παρασκευή θα διευκολύνει την φάση της περινεϊκής παρασκευής που θα επακολουθήσει.
Το πρώτο βήμα του περινεϊκού χρόνου της επέμβασης συνίσταται στην επίτευξη καλής έκθεσης του πρωκτικού καναλιού με την τοποθέτηση ενός ειδικού αυτοσυγκρατούμενου διαστολέα (Lone Star Retractor; Lone Star Medical Products Inc., Houston, TX, USA), ο οποίος διαθέτει λεπτά άγκιστρα για την αποφυγή τραυματισμού του σφιγκτήρα, αλλά και την επαρκή εξάλειψη της σχισμοειδούς διαμόρφωσης του πρωκτικού ανοίγματος, προκειμένου τη διευκόλυνση των διαπρωκτικών χειρισμών επί του ορθικού βλεννογόνου. Στο μεσοσφιγκτηριακό χώρο ανάμεσα στον έσω και στον έσω σφιγκτήρα εγχέεται διάλυμα 1 mg επινεφρίνης σε 20 ml φυσιολογικού ορού, προκειμένου τη διευκόλυνση της μεσοσφιγκτηριακής παρασκευής, αλλά και την ελαχιστοποίηση της αιμορραγίας με τη βοήθεια της τοπικά αγγειοσυσπαστικής δράσης της επινεφρίνης. Ο ορθοπρωκτικός βλεννογόνος με τον υποκείμενο έσω σφιγκτήρα διατέμνονται περιμετρικά σε απόσταση τουλάχιστον 1 εκατοστού από το περιφερικό άκρο του όγκου. Το ορθοπρωκτικό κολόβωμα που δημιουργείται συγκλείεται με ράμμα περίπαρσης για την παρεμπόδιση διασποράς καρκινικών κυττάρων κατά την επακολουθούσα περινεϊκή παρασκευή.
Η μεσοσφιγκτηριακή εκτομή που ακολουθεί μπορεί να είναι ολική, υφολική ή μερική. Εάν ο όγκος επεκτείνεται περιφερικότερα της οδοντωτής γραμμής τότε εκτελείται ολική μεσοσφιγκτηριακή εκτομή, κατά την οποία ολόκληρος ο έσω σφιγκτήρας αφαιρείται με την αρχή της περιμετρικής διατομής του ορθοπρωκτικού βλεννογόνου να ξεκινά από το επίπεδο της μεσοσφιγκτηριακής αύλακας. Εάν το περιφερικό άκρο του όγκου βρίσκεται από την οδοντωτή γραμμή έως και 2 εκατοστά κεντρικότερα αυτής, τότε διενεργείται υφολική μεσοσφιγκτηριακή εκτομή, οπότε το περιφερικό όριο εκτομής ξεκινά ανάμεσα στην οδοντωτή γραμμή και στη μεσοσφιγκτηριακή αύλακα. Εφόσον ο όγκος βρίσκεται κεντρικότερα, τότε το περιφερικό όριο εκτομής μπορεί να βρίσκεται επί της οδοντωτής γραμμής ή και κεντρικότερα, εφόσον εξασφαλίζεται το 1 εκατοστό, ως περιφερικό όριο εκτομής. Η τελευταία μεσοσφιγκτηριακή εκτομή καλείται μερική. Η παρασκευή συνεχίζεται εντός του μεσοσφιγκτηριακού χώρου οπίσθίως, πλάγια και προσθίως και συνδέεται με το περιμεσοορθικό πλάνο της κοιλιακής παρασκευής, η οποία έχει προηγηθεί. Τελικώς το ορθό αποκολλάται από τον προστάτη ή από τον κόλπο και το το ορθοσιγμοειδές συνεχόμενο με τμήμα του πρωκτικού καναλιού και του περιβάλλοντα αυτού έσω σφιγκτήρα, ως ένα χειρουργικό παρασκεύασμα αφαιρούνται δια του πρωκτού.
Μετά την απομάκρυνση του παρασκευάσματος το κινητοποιημένο κόλον αναστομώνεται με το πρωκτόδερμα «με το χέρι» ή με «μηχανική» τεχνική όπου χρησιμοποιείται κυκλικός αναστομωτήρας, είτε με τη δημιουργία μιας ευθείας κολο-πρωκτικής αναστόμωσης, είτε μετά τη δημιουργία μιας κολονικής ληκύθου τύπου J και την αναστόμωσή της με τον πρωκτό. Σχεδόν πάντα η δημιουργία μιας προστατευτικής loop ειλεοστομίας είναι επιβεβλημένη.
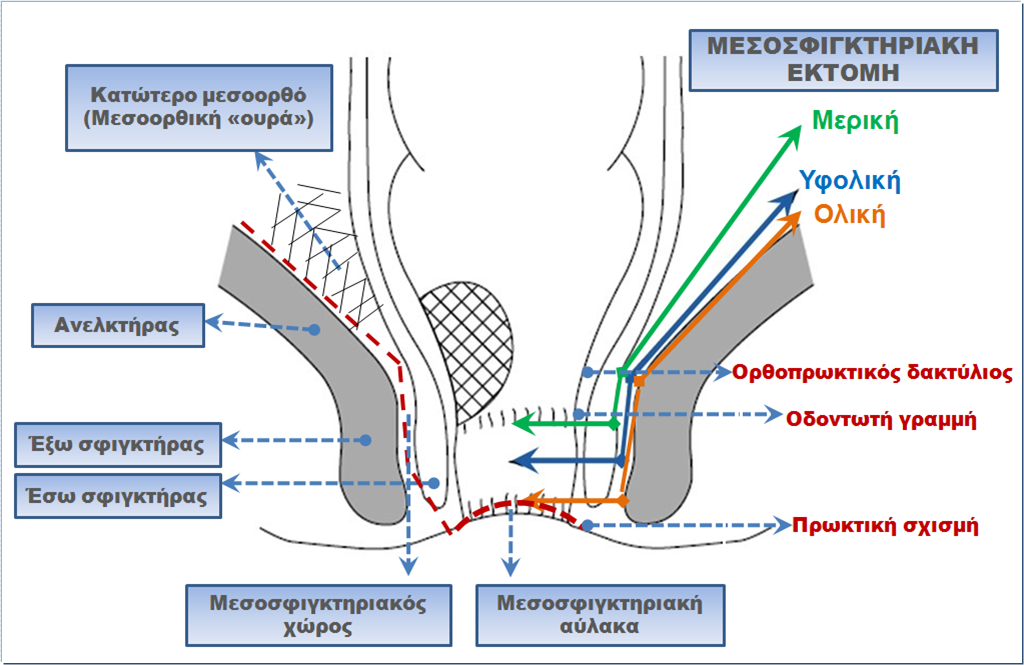
Η μεσοσφιγκτηριακή εκτομή
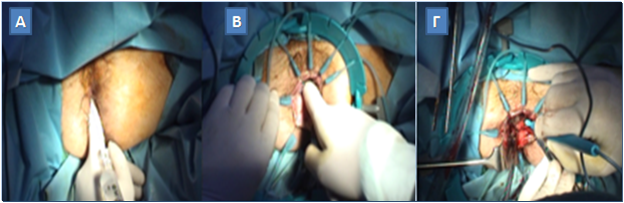
Περινεϊκοί χρόνοι της μεσοσφιγκτηριακής εκτομής: Α. Διήθηση με επινεφρίνη. Β. Τοποθέτηση του ειδικού άγκιστρου Lone Star. Γ. Μεσοσφιγκτηριακή παρασκευή
(Από το προσωπικό αρχείο του Γ. Θεοδωρόπουλου)
Τα αποτελέσματα της μεσοσφιγκτηριακής εκτομής
Οι ογκολογικές ανησυχίες για τη μεσοσφιγκτηριακή εκτομή αφορούσαν όχι τόσο την επίτευξη ενός επαρκούς περιφερικού ορίου εκτομής, αλλά την πιθανότητα ο όγκος να εκτείνεται πέραν του μεσοσφιγκτηριακού διαστήματος στον έξω σφιγκτήρα, οπότε το πολύ σημαντικότερο ογκολογικά περιμετρικό «πλάγιο» όριο εκτομής να βρεθεί σε κίνδυνο ή και να είναι διηθημένο. Σε μία τέτοια περίπτωση η επίτευξη ενός «καθαρού» περιμετρικού ορίου θα απαιτούσε τη διενέργεια, αναπόφευκτα, μιας κοιλιοπερινεϊκής εκτομής. Όμως, από μεγάλες σειρές ασθενών που έχουν δημοσιευθεί σε Ευρώπη, Αμερική και Ασία, και σε 14 υψηλής ποιότητας μελέτες που συμπεριελάμβαναν 1200 ασθενείς, αναδείχθηκε ότι ογκολογικά επαρκής, με ελεύθερα ιστολογικά όρια, εκτομή R0 επιτεύχθηκε στο 97%, ενώ το μέσο περιμετρικό όριο εκτομής ήταν 1,7 εκατοστά, δηλαδή πέρα από επαρκές. Συνολικά το ποσοστό της τοπικής υποτροπής ήταν 6,7% (διακύμανση: 0-23%), η 5ετής επιβίωση 86,3% (διακύμανση: 62-97%) και η ελεύθερη νόσου επιβίωση 78,6% (69-87%).
Δεδομένων της αφαίρεσης έστω και τμήματος του έσω σφιγκτήρα και της δημιουργίας μιας ενδοπρωκτικής αναστόμωσης, η οποία θα διαταράξει φυσιολογικούς αισθητηριακούς μηχανισμούς του πρωκτικού καναλιού, η ενημέρωση των ασθενών, που υποβάλλονται σε μεσοσφιγκτηριακή εκτομή, οφείλει να είναι πλήρης και να αφορά τα συγκεκριμένα λειτουργικά προβλήματα που μπορεί να έχουν να αντιμετωπίσουν μετά την επανεγκατάσταση της λειτουργίας του εντέρου. Φαίνεται ότι οι νεότεροι ασθενείς, που διαθέτουν ισχυρό σφιγκτηριακό μηχανισμό, ιδιαίτερα δε εάν αυτός συνυπάρχει με ένα μακρύ πρωκτικό κανάλι, θα επωφεληθούν περισσότερο και θα έχουν τα καλύτερα λειτουργικά αποτελέσματα. Στην αρχική σειρά των ασθενών των Shissel και συν, αν και υπήρξαν τοπικές υποτροπές σε 5,5% και σε 9,4% αναπτύχθηκε μακροπρόθεσμα στένωση στην περιοχή της αναστόμωσης, η εγκράτεια για τα αέρια, τα υγρά και τα στερεά κόπρανα διατηρήθηκε σε 86% των ασθενών. Η συχνότητα των καθημερινών κενώσεων ήταν αρχικά υψηλή, αλλά έπεσε σε περίπου 2-3 κενώσεις/ημέρα μετά από 6-12 μήνες. Σε μία συστηματική ανασκόπηση 8 μελετών, 11-63% των ασθενών ανέφεραν διαβροχή από υδαρή κόπρανα και «λέρωμα» (soiling), ενώ το 30-86% είχαν τέλεια εγκράτεια κοπράνων. Η αλήθεια είναι ότι παρουσιάζονται μεγάλες διακυμάνσεις στην αναφορά των λειτουργικών διαταραχών που ακολουθούν αυτές τις επεμβάσεις, οι οποίες φαίνεται να σχετίζονται θετικά με το ύψος της αναστόμωσης περισσότερο παρά με τη δημιουργία μιας κολονικής ληκύθου, η οποία σε ένα βαθμό φαίνεται να προστατεύει από τις δυσμενείς μετεγχειρητικές λειτουργικές συνέπειες.
.
Βασιζόμενος στην προσωπική μου εμπειρία, ενισχύω τη θεώρηση ότι η μεσοσφιγκτηριακή εκτομή είναι μία ασφαλής και ογκολογικά επαρκής σφιγκτηροσωστική επέμβαση, που μπορεί να προσφέρει μακρές επιβιώσεις στους ασθενείς με όγκους που βρίσκονται πολύ χαμηλά στο ορθό. Οι λειτουργικές διαταραχές, που απασχόλησαν τους ασθενείς μετά τη διενέργεια αυτών των επεμβάσεων, ενέπιπταν στο φάσμα αυτού που αποκαλείται «σύνδρομο πρόσθιας εκτομής», με κύρια την εμφάνιση του φαινομένου της κατάτμησης των κενώσεων. Ο ασθενής επισκέπτεται συχνά την τουαλέτα σε διάστημα 1-2 ωρών και αφοδεύει από μικρές ποσότητες κοπράνων κάθε φορά. Η δυσλειτουργία αυτή βελτιώνεται σημαντικά μετά την πάροδο 6 μηνών και, σε σημαντικό βαθμό, ρυθμίζεται μέσω διαιτολογικών χειρισμών ή με τη λήψη σκευασμάτων φυτικών ινών ή αντιδιαρροϊκών φαρμάκων. Σχεδόν πότε δεν παραπονέθηκε ασθενής για πραγματική ακράτεια κοπράνων. Επίσης, όταν ερωτήθηκαν, κανένας δεν θα επιθυμούσε να επανέλθει σε μία κατάσταση με στομία, ακόμη και εάν αυτή η ερώτηση γινόταν σε περιόδους που διέρχονται δύσκολες καταστάσεις λόγω του «συνδρόμου πρόσθιας εκτομής». Σημειοτέον, αφού σε όλους τους ασθενείς μου που υποβάλλονται σε σφιγκτηροσωστικές επεμβάσεις, ακολουθώ την ασφαλή τακτική δημιουργίας μιας προστατευτικής στομίας, η οποία και συγκλείεται μετά από 2-3 μήνες, όλοι οι ασθενείς έχουν βιώσει μία μικρή περίοδο με στομία, ακόμη και αν αυτή ήταν παροδική. Επομενως η εμπειρία της «παρά φύσιν» έδρας είναι υπαρκτή σε όλους. Ποτέ οι λειτουργικές διαταραχές μετά από μία σφιγκτηροσωστική επέμβαση για καρκίνο του ορθού δεν ήταν τόσο σοβαρή και αναπηρική που ανάγκασε τον ασθενή να αποδεχθεί την εγκατάσταση μιας μόνιμης «παρά φύσιν» έδρας και την απώλεια της φυσιολογικής λειτουργίας της αφόδευσης από τον πρωκτό, ακόμα και εάν αυτή δεν ήταν τέλεια.
Γ. Θεοδωρόπουλος
Περισσότερα...
Ογκολογική επάρκεια και λειτουργική αποκατάσταση: οι σύγχρονοι στόχοι της χειρουργικής θεραπείας του καρκίνου του ορθού
Η θεραπευτική στρατηγική για την αντιμετώπιση του καρκίνου του ορθού έχει εξελιχθεί σε μία περίπλοκη πολυδύναμη προσέγγιση, κατά την οποία η επιμήκυνση της συνολικής επιβίωσης των ασθενών, η ελαχιστοποίηση της τοπική υποτροπής και η βελτιστοποίηση όλων των λειτουργικών παραμέτρων που συνιστούν την ποιότητα ζωής των ασθενών να αποτελούν βασικούς στόχους για την επιτυχή έκβαση. Η χειρουργική θεραπεία για των καρκίνο του ορθού, ιδιαίτερα δε, για τον καρκίνο που προσβάλει το κατώτερο τριτημόριο του ορθού, το οποίο και βρίσκεται σε στενή ανατομική σχέση με το σφιγκτήρα του πρωκτού, έχει αλλάξει δραματικά μέσα στα τελευταία 100 χρόνια. Τις τελευταίες όμως τρεις δεκαετίες η μεταβολή στη συμπεριφορά των χειρουργών που εξειδικεύονται σε αυτήν την κακοήθεια, η αναμόρφωση των χειρουργικών προσεγγίσεων, η υιοθέτηση «αυστηρότερων» ογκολογικών αρχών στις σχετικές εκτομές του ορθού και η κατανόηση των ανατομικών πλάνων με βάση την εμβρυολογική αρχή τους και τη σχέση τους με τις δυσδιάκριτες ανατομικές δομές της πυέλου, έχουν ορίσει τη χειρουργική προσέγγιση στον καρκίνο του ορθού ως την πλέον δυναμικά εξελισσόμενη συγκριτικά με τις άλλες κακοήθειες του πεπτικού σωλήνα. Εξάλλου, ενώ για τους περισσότερους καρκίνους, τα τελευταία χρόνια, οι επικουρικές ογκολογικές θεραπείες με τα καλύτερα νεότερα φάρμακα βελτίωσαν την πρόγνωση των ασθενών, για τον καρκίνο του ορθού ισχύει το ότι «η καλύτερη και σωστότερη χειρουργική» ήταν ο βασικός παράγοντας που οδήγησε στις μακρές επιβιώσεις των ασθενών και, μάλιστα, με ελαχιστοποίηση της αναπηρικής και ιδιαιτέρως επώδυνης απειλής της τοπικής υποτροπής.
Πέρα όμως από την ογκολογική ωφέλεια που έχει προσφέρει η σύγχρονη χειρουργική στον καρκίνο του ορθού, η βαθύτερη κατανόηση της παθοφυσιολογίας της νόσου, η επινόηση νεοτερισμών στη χειρουργική προσπέλαση της ανατομικά δύσκολης περιοχής, στην οποία εδράζεται το κατώτερο τμήμα του ορθού, οι τεχνολογικές επιτεύξεις με την εξέλιξη εύκαμπτων και περισσότερο εργονομικών μηχανικών συρραπτικών και αναστομωτήρων, οι νέο-επικουρικές ογκολογικές θεραπείες με τη δυνατότητα που προσφέρουν για την προεγχειρητικιή συρρίκνωση των όγκων του ορθού, αλλά και, κυρίως, το γεγονός ότι ο σύγχρονος εξειδικευμένος χειρουργός άρχισε να εκτιμά περισσότερο και τελικά να αποσκοπεί στη διατήρηση του βέλτιστου δυνατού επιπέδου ποιότητας ζωής μετά την επέμβαση για τον καρκίνο του ορθού, οδήγησαν στη διενέργεια όλο και περισσότερων «σφιγκτηροσωστικών» επεμβάσεων. Τέτοιου τύπου χειρουργικές επεμβάσεις στοχεύουν στην αποκατάσταση της εντερικής συνέχειας και στη διατήρηση του σφιγκτηριακού μηχανισμού, χωρίς ωστόσο να διακυβεύεται η ογκολογική επάρκεια του χειρουργείου. Έτσι η κοιλιοπερινεϊκή εκτομή, που περιλαμβάνει και την πλήρη αφαίρεση του πρωκτικού αυλού με τον περιβάλλοντα σφιγκτήρα και, εν τέλει, τη δημιουργία μόνιμης κολοστομίας, η οποία κάποτε αποτελούσε τη «χρυσή σταθερά» της χειρουργικής θεραπείας του καρκίνου του κατώτερου ορθού, διενεργείται όλο και λιγότερο συχνά από τους χειρουργούς παχέος εντέρου, οι οποίοι προτιμούν τις δυσκολότερες τεχνικά, αλλά με ικανοποιητικότερο για τους ασθενείς αποτέλεσμα, «πολύ χαμηλές» πρόσθιες εκτομές ή ακόμη και τις τοπικές εκτομές, πάντα, ωστόσο, υπό δεδομένες συνθήκες και με ορισμένες ενδείξεις και προϋποθέσεις. Ο ασθενής με καρκίνο του κατώτερου ορθού, ενώ κάποτε ήταν «καταδικασμένος» σε ανικανότητα και κολοστομία, σήμερα, πέρα από την καλύτερη επιβίωση που τους προσφέρεται με την καλύτερη χειρουργική, έχουν και τη δυνατότητα αποφυγής της μόνιμης «παρά φύσιν» έδρας και της διατήρησης της φυσιολογικής οδού για τη λειτουργία της αφόδευσης.
Η εξέλιξη της χειρουργικής του ορθού στον 20ο αιώνα
Η μοντέρνα περίοδος της χειρουργικής για τον καρκίνο του ορθού ξεκινά με την περιγραφή της κοιλιοπερινεϊκής εκτομής από τον Ernest Miles το 1908. Η επέμβαση κατά Miles ήταν μία ευρεία, «επιθετική» και ριζική επέμβαση, που βασιζόταν στην ανεύρεση καρκινικών εμφυτεύσεων στο πυελικό περιτόναιο, στο μεσοορθό και στα λαγόνια αγγεία. Αυτά τα ευρήματα οδήγησαν τον Miles στη διαμόρφωση της «κυλινδρικής θεώρησης» στην επέκταση του καρκίνου του ορθού σε τρείς ζώνες: «προς τα πάνω», «προς τα πλάγια» και «προς τα κάτω». Σήμερα γνωρίζουμε ότι η προς τα πλάγια επέκταση με παρουσία εμφυτεύσεων εντός του ισχιοορθικού χώρου, πέραν των πλαγίων ορίων των σφιγκτήρων δεν υφίσταται, εκτός και εάν υπάρχει κατά συνέχεια ιστών προσβολή από ευμεγέθεις, παραμελημένους όγκους, ενώ η προς τα κάτω επέκταση είναι σπάνια και αφορά κυρίως καρκίνους χαμηλής διαφοροποίησης με εγγενώς επιθετική συμπεριφορά. Στις κοιλιοπερινεϊκές εκτομές της εποχής εκείνης η θνητότητα ήταν υψηλή, η τοπική υποτροπή του καρκίνου, ωστόσο, μετά τις επεμβάσεις αυτές ελαττώθηκε δραματικά από 95% σε 29%. Επακόλουθες βελτιώσεις στην αναισθησία, στην αντισηψία και στη μετεγχειρητική φροντίδα ων ασθενών οδήγησαν σε πτώση της θνητότητας και σε καλύτερη επιβίωση των ασθενών. Η κοιλιοπερινεϊκή εκτομή κατέστη η βασική επέμβαση για όλους τους καρκίνους του ορθού. Παρά τις διάφορες τροποποιήσεις της τεχνικής, οι οποίες αφορούσαν κυρίως τη θέση του ασθενούς στο χειρουργείο και τον περινεϊκό χρόνο της επέμβασης, ο στόχος παρέμεινε αναλλοίωτος: η πλήρης αφαίρεση του ορθοπρωκτικού σωλήνα μαζί με τον ευρύ καθαρισμό του περιβάλλοντα λεμφαγγειακού ιστού.
Η χειρουργική πρόοδος κατά τη διάρκεια του 20ου αιώνα οδήγησε στον περιορισμό της διενέργειας κοιλιοπερινεϊκών εκτομών στους καρκίνους που προσέβαλαν το κατώτερο τριτημόριο του ορθού, δηλαδή κάτω από την πρόσθια περιτοναϊκή ανάκαμψη. Η επιτυχής εκτέλεση της χαμηλής πρόσθιας εκτομής για τους καρκίνους του ανώτερου και μέσου τριτημορίου του ορθού, δηλαδή της αφαίρεσης του προσβεβλημένου τμήματος και της διενέργειας κολο-ορθικής αναστόμωσης για αποκατάσταση της εντερικής συνέχειας και της διατήρησης της σφιγκτηριακής λειτουργίας, όπως αυτή, ως τεχνική, έκανε την εμφάνισή της και πρωτοδημοσιεύτηκε από τον Claude F. Dixon το 1948, οδήγησε στην ευρύτερη αποδοχή της και στην καθιέρωση του κανόνα των «5 εκατοστών» ως την ελάχιστη απόσταση στην οποία θα έπρεπε να βρίσκεται ο όγκος από την οδοντωτή γραμμή, προκειμένου να επιτευχθεί επαρκές ογκολογικά «άπω όριο», αλλά και αναστόμωση με το ορθοπρωκτικό κολόβωμα. Η κοιλιοπερινεϊκή εκτομή διατηρήθηκε ως η ενδεικνυόμενη τεχνική για τους όγκους που βρίσκονταν σε απόσταση μικρότερη των 5 εκατοστών από την οδοντωτή γραμμή, ή αλλιώς 7 εκατοστών από το πρωκτικό άνοιγμα. Στην κλασσική δημοσίευσή του ο Dixon σχολίασε για τα τελευταία 20 εκατοστά του πεπτικού σωλήνα ως εξής: “the most controversial segment of the large intestine… It is for this region new procedures are constantly being advocated and interest in old ones is being rekindled”. Τα τελευταία 60 χρόνια, οι προτάσεις αυτές παραμένουν αληθείς, αν και περισσότερο πια αφορούν τα τελευταία 5 εκατοστά του ορθού.
Η λογική της διάσωσης των σφιγκτήρων
Η αναθεώρηση του κανόνα των «5 εκατοστών» ξεκίνησε στις δεκαετίες του 1980 και του 1990, οπότε το «προαπαιτούμενο» μήκος του ελεύθερου «άπω ορίου» εκτομής άρχισε να «συρρικνώνεται». Με την παράλληλη συστηματική εισαγωγή της νέο-επικουρικής (χημειο-)ακτινοβολίας για τους καρκίνους σταδίου ΙΙ και ΙΙΙ, η αξία της εμμονής στο «επαρκές ογκολογικά» «άπω όριο» αμφισβητήθηκε από την αναγνώριση της σημασίας του περιμετρικού «πλάγιου ορίου» εκτομής, την εισαγωγή της τεχνικής της «ολικής μεσοορθικής εκτομής» και την ευρεία υιοθέτηση του κυκλικού αναστομωτήρα που διευκόλυνε την εκτέλεση των «χαμηλών» κολοπρωκτικών αναστομώσεων. Το 1983 οι Williams και συν., μετά την εξέταση 50 χειρουργικών παρασκευασμάτων κοιλιοπερινεϊκής εκτομής, βρήκαν ότι, στο 90% αυτών, ενδοτοιχωματική επέκταση των όγκων δεν υπήρχε καθόλου ή περιοριζόταν μόνο σε <1 εκατοστό από τον όγκο. Οι λίγοι ασθενείς με ενδοτοιχωματική επέκταση του καρκίνου σε απόσταση >1 εκατοστό είχαν και χαμηλής διαφοροποίησης όγκους με, έτσι ή αλλιώς, βιολογικά κακή πρόγνωση και, τελικά, κατέληξαν από απομακρυσμένες μεταστάσεις. Συμπέραναν ότι η αυστηρή εφαρμογή του κανόνα των «5 εκατοστών» προσέφερε μικρό ογκολογικό όφελος, ενώ, ταυτόχρονα, επηρέαζε δυσμενώς την ποιότητα ζωής των ασθενών, αναγκάζοντάς τους σε μόνιμη απώλεια του πρωκτού και κολοστομία. Σε μία αναδρομική μελέτη που δημοσιεύτηκε την ίδια χρονιά από τους Pollett & Nicholls, σε 334 ασθενείς που είχαν υποβληθεί σε χαμηλή πρόσθια εκτομή με «άπω όρια» εκτομής <2, 2–5, και >5 εκατοστά δεν βρέθηκαν διαφορές στα ποσοστά τοπικής υποτροπής (7.3%, 6.2%, και 7.8 %, αντίστοιχα) ή στη 5ετή επιβίωση (69.1%, 68.4%, και 69.6 %, αντίστοιχα). Οι ενδείξεις υπέρ της ελάττωσης των «απαραίτητων» «άπω ορίων» αυξήθηκαν μέσα στα επόμενα έτη και σε μία πρόσφατη συστηματική ανασκόπηση 17 σχετικών μελετών δεν αναδείχθηκε σημαντικό αρνητικό ογκολογικό αντίκτυπο για «άπω όριο» < 1 εκατοστό ή ακόμη και < 5 χιλιοστά, όσον αφορά τόσο την τοπική υποτροπή όσο και τη συνολική επιβίωση. Συνεπώς η εφαρμογή «σφιγκτηροσωστικών» επεμβάσεων είναι επιτρεπτή και ασφαλής ογκολογικά ακόμα και για καρκίνους του ορθού που βρίσκονται πολύ χαμηλά.
To περιμετρικό «πλάγιο όριο» εκτομής και η «ολική μεσοορθική εκτομή»
Η αναθεώρηση του κανόνα των «5 εκατοστών» συνέπεσε με την αναγνώριση του «ελεύθερου», μη διηθημένου περιμετρικού «πλάγιου ορίου» εκτομής ως του πλέον σημαντικού ογκολογικά στοιχείου καθώς και με την περιγραφή της «ολικής μεσοορθικής εκτομής». Ο ρόλος του «πλάγιου ορίου» εκτομής άρχισε να διερευνάται μετά τη διαπίστωση των απαράδεκτα υψηλών ποσοστών τοπικής υποτροπής που ακολουθούσαν τις χειρουργικές επεμβάσεις για τον καρκίνο του ορθού. Οι Quirke και συν. σε μία σειρά 52 ασθενών διαπίστωσαν ότι στο ¼ αυτών τα «πλάγια όρια» ήταν διηθημένα και σε 80% από αυτή την ομάδα ασθενών επήλθε τοπική υποτροπή του καρκίνου του ορθού. Οι προοπτικές μελέτες που ακολούθησαν αυτή τη σημαντική παρατήρηση επιβεβαίωσαν το δυσμενή ρόλο των «θετικών» περιμετρικών ορίων στην υποτροπή και στην επιβίωση των ασθενών. Χειρουργικά το πρόβλημα της επίτευξης των ογκολογικά καθαρών και επαρκών «πλαγίων ορίων» διευθετήθηκε από τη σωστή εφαρμογή και την υιοθέτηση της άρτιας «ολικής μεσοορθικής εκτομής». Πρωτοπόρος στη λεπτομερή περιγραφή της και στη διάδοση της ήταν ο Bill Heald. Η «ολική μεσοορθική εκτομή» αποσκοπεί στην ανατομικά ορθή αφαίρεση του ορθού ως ένα «πακέτο που περιέχει τον όγκο» εντός ενός άθικτου μεσοορθικού διαμερίσματος, το οποίο ορίζεται από το εμβρυολογικό πλάνο που βρίσκεται ανάμεσα στην τοιχωματική πυελική προϊερά περιτονία και τη σπλαγχνική μεσοορθική περιτονία. Το πλάνο αυτό έγινε γνωστό στην ιστορία της σύγχρονης χειρουργικής ως «ιερό πλάνο» (“holy plane”), λόγω του σεβασμού του και στην επιμονή της χειρουργικής παρασκευής μόνο εντός αυτού, καθώς και της αυστηρότητας που πρέπει να διέπει η κάθε προσπάθεια διατήρησης άθικτης της μεσοορθικής περιτονίας.
Η υιοθέτηση της «ολικής μεσοορθικής εκτομής» από τους Σουηδούς χειρουργούς παχέος εντέρου οδήγησε σε πτώση της συχνότητας διενέργειας κοιλιοπερινεϊκών εκτομών από 60% σε 27%, αποδεικνύοντας τη δύναμη που έχει μία ανατομικά σωστή χειρουργική τεχνική στη διασφάλιση μιας ογκολογικά επαρκούς παρασκευής και κατ’επέκταση ενός ογκολογικά ικανοποιητικού αποτελέσματος.
Ο ρόλος της ιατρικής βιομηχανίας
Οι χαμηλές αναστομώσεις κοντά στο σφιγκτήρα διευκολύνθηκαν όχι μόνο από την «ολική μεσοορθική εκτομή», αλλά και από την εισαγωγή των κυκλικών αναστομωτήρων, καθώς και, αργότερα, από την εφεύρεση και την ευρεία χρήση ευθύγραμμων συρραπτικών με ειδική γωνιώδη διαμόρφωση, τα οποία είχαν τη δυνατότητα να διατέμνουν το ορθό μέσα στη «βαθειά» πύελο, δημιουργώντας γραμμή συρραφής ταυτόχρονα επί των κολοβωμάτων. Ο κυκλικός αναστομωτήρας αναπτύχθηκε αρχικά στη Ρωσσία και οι μετέπειτα βελτιώσεις του και η αποδοχή της χρήσης του από τους χειρουργούς επέτρεψε την πραγματοποίηση γρήγορων χρονικά και σχετικώς εύκολων τεχνικά χαμηλών αναστομώσεων. Το 1980 ο Heald ανέφερε ότι, μετά την εισαγωγή των κυκλικών αναστομωτήρων για τις χαμηλές αναστομώσεις, ελάττωσε τα ποσοστά των κοιλιοπερινεϊκών εκτομών από 27% σε 4%. Η ανοχή ελαττωμένων ελεύθερων «άπω ορίων», η «ολική μεσοορθική εκτομή» και η διαθεσιμότητα συρραπτικών για την πύελο και κυκλικών αναστομωτήρων οδήγησαν στη δραματική ελάττωση των κοιλιοπερινεϊκών εκτομών.
Η κοιλιοπερινεϊκή εκτομή δεν είναι ογκολογικά καλύτερη επέμβαση
Οι ενδείξεις της κοιλιοπερινεϊκής εκτομής έχουν αναδιαμορφωθεί ριζικά από τη στιγμή της πρώτης περιγραφής της από τον Miles. Η διατήρηση του σφιγκτήρα σήμερα αποτελεί δείκτη ποιότητας για τη χειρουργική του ορθού, με άλλα λόγια όσο υψηλότερο είναι το ποσοστό των σφιγκτηροσωστικών επεμβάσεων έναντι των κοιλιοπερινεϊκών εκτομών τόσο περισσότερο εξειδικευμένη είναι η ομάδα των χειρουργών παχέος εντέρου και πιο ειδική η Μονάδα παχέος εντέρου ή το αντίστοιχο Ίδρυμα. Όχι, όμως, μόνο η επιδείνωση των παραμέτρων που σχετίζονται με την ποιότητα ζωής, αλλά και τα ογκολογικά αποτελέσματα μετά από την κοιλιοπερινεϊκή εκτομή δημιούργησαν ανησυχίες, αφού φαίνεται να είναι χειρότερα από τα αντίστοιχα των χαμηλών πρόσθιων εκτομών, όπου και διασώζεται ο σφιγκτήρας. Σήμερα πιστεύουμε ότι η ογκολογική κατωτερότητα των κοιλιοπερινείκών εκτομών οφείλεται κυρίως στο γεγονός ότι, αν και αρχικά από τον Miles περιγράφηκε ως μία ευρεία «κυλινδρική» επέμβαση που συμπεριελάμβανε την αφαίρεση των ανελκτήρων (που αποτελούν και τον κύριο όγκο του σφιγκτηριακού συμπλέγματος) από την έκφυσή τους, στη σύγχρονη έκφρασή της κοιλιοπερινεϊκής εκτομής, η παρασκευή γινόταν κοντά στο ορθό, πλησίον του ηβοορθικού μυός (της εσωτερικής μοίρας του ανελκτήρα), με αποτέλεσμα τον μη καλό «καθαρισμό» του κατώτερου μεσοορθού και τη δημιουργία ενός ελλείμματος στο μεσοορθό, γνωστού ως μεσοορθική «μέση» (mesorectal “waist”). Ο τρόπος που γίνεται αυτή η συμβατική κοιλιοπερινεϊκή εκτομή, λόγω των μη διακριτών πλάνων, μπορεί να οδηγήσει και σε διεγχειρητική διάτρηση του όγκου με συνέπεια την τοπική διασπορά του καρκίνου και την ογκολογική επιδείνωση του ασθενούς. Αυτός είναι και ο λόγος ότι η συμβατική αυτή κοιλιοπερινεϊκή εκτομή αντικαταστάθηκε από την ευρεία «εξωανελκτηριακή» κοιλιοπερινεϊκή εκτομή, τουλάχιστον για τις περιπτώσεις που υπάρχει η ένδειξη για απώλεια του σφιγκτήρα. Η εξωανελκτηριακή κοιλιοπερινεϊκή εκτομή στη σύγχρονη της μορφή, όπως εφαρμόζεται τουλάχιστον από εξειδικευμένες ομάδες μέσα στην τελευταία δεκαετία, μοιάζει με τη ριζική εκτομή που περιγράφηκε αρχικά από το Miles, αλλά υπάρχουν σαφείς βελτιώσεις όσον αφορά τη σύγκλειση του μεγάλου περινεϊκού τραύματος που απομένει μετά τη εκτεταμένη αφαίρεση του πρωκτού μαζί με ολόκληρο το σφιγκτηριακό σύμπλεγμα.
Η μετα-ανάλυση 14 Ευρωπαϊκών μελετών που αφορούσαν τον καρκίνο του ορθού έδειξαν ότι η χαμηλή πρόσθια εκτομή υπερτερούσε της κοιλιοπερινεϊκής εκτομής (σημειοτέον της συμβατικής και όχι τα σύγχρονης «εξωανελκτηριακής») όσον αφορά τα «καθαρά» περιμετρικά όρια (5% έναντι 10%), τις τοπικές υποτροπές (11% έναντι 20%) και την 5ετή συνολική επιβίωση των ασθενών (70% ένατι 59%). Αυτά τα σαφώς κατώτερα ογκολογικά αποτελέσματα της κοιλιοπερινεϊκής εκτομής οφείλονται τόσο στην εγγενώς «κακή» χειρουργική τεχνική, όπως εξηγήθηκε παραπάνω, αλλά και στα βιολογικώς άσχημα χαρακτηριστικά των όγκων που υποβάλλονται σε αυτή την ακρωτηριαστική επέμβαση.
Υπάρχει θέση για την κοιλιοπερινεϊκή εκτομή στη σύγχρονη εποχή των σφιγκτηροσωστικών επεμβάσεων; Απόλυτη ένδειξη για τη διενέργεια μιας κοιλιοπερινεϊκής εκτομής αποτελεί η άμεση διήθηση, αλλά και η έμμεση προσβολή του (όπως στην συνύπαρξη περιεδρικού συριγγίου που εξορμάται από τον καρκίνο) του σφιγκτήρα από τον καρκίνο του ορθού, οπότε, όπως είναι λογικό, ο σφιγκτήρας πρέπει να συναφαιρεθεί στο χειρουργικό παρασκεύασμα προκειμένου να επιτευχθεί ο ογκολογικός καθαρισμός. Άλλη σχετική ένδειξη για την κοιλιοπερινεϊκή εκτομή είναι η πρόβλεψη ότι η λειτουργική αποκατάσταση στο θέμα της εγκράτειας των κοπράνων μετεγχειρητικά θα είναι κάθε άλλο παρά ικανοποιητική. Τέτοιες καταστάσεις είναι η ήδη υπάρχουσα ακράτεια του σφιγκτήρα πριν από το χειρουργείο, το ιστορικό ιατρογενών, τραυματικών ή μαιευτικών κακώσεων στο σφιγκτήρα και τα χρόνια διαρροϊκά σύνδρομα, όπως αυτά που συνοδεύουν τις ιδιοπαθείς φλεγμονώδεις νόσους του εντέρου.
Ο ρόλος της νέο-επικουρικής θεραπείας
Ο βασικός ρόλος της χορήγησης (χήμειο-) ακτινοθεραπείας πριν ο ασθενής υποβληθεί σε χειρουργική εκτομή για τοπικά προχωρημένο καρκίνο του ορθού (Τ3-Τ4), οριζόμενης και ως νεο-επικουρικής θεραπείας έγκειται στη συρρίκνωση του όγκου, προκειμένου να επιτευχθεί αρτιότερη και πιο σίγουρη ογκολογικά εκτομή με ελεύθερα ιστολογικά όρια (R0 εκτομή). Υποτίθεται ότι η νέο-επικουρική θεραπεία θα μπορούσε να έχει ρόλο στην αύξηση της πιθανότητας διατήρησης του σφιγκτήρα ή ακόμη και στην πλήρη αλλαγή της θεραπευτικής στρατηγικής στις περιπτώσεις που ο όγκος, μετά την επίδραση της (χήμειο-)ακτινοβολίας, εξαφανίζεται (πλήρης ανταπόκριση), οπότε μια «μη χειρουργική» στρατηγική αναμονής (“watch and wait”) θα μπορούσε να εφαρμοστεί.
Εάν η νεο-επικουρική θεραπεία αποδεικνυόταν τόσο αποτελεσματική στη συρρίκνωση και στην υποσταδιοποίηση του όγκου, τότε θα έπρεπε περισσότεροι ασθενείς, που αρχικά δεν θα απέφευγαν την κοιλιοπερινεϊκή εκτομή, τελικά να κατάφερναν να διατηρήσουν τους σφιγκτήρες τους και να υποβάλλονταν σε χαμηλές πρόσθιες εκτομές. Τα υπάρχοντα δεδομένα, ωστόσο, δεν υποστηρίζουν αυτή την υπόθεση. Η μετα-ανάλυση 10 μελετών και η πρόσφατη ανάλυση από την ομάδα Cochrane, που περιελάμβανε 6 τυχαιοποιημένες μελέτες δεν αποκάλυψε διαφορές στις συχνότητες διενέργειας χαμηλών προσθίων εκτομών ανάμεσα στις ομάδες των ασθενών που είχαν υποβληθεί σε προεγχειρητική ακτινοθεραπεία και σε αυτούς που υποβλήθηκαν σε χειρουργείο απ’ευθείας. Επιπροσθέτως, ο Heald, πρωτεργάτης και βασικός εμπνευστής της σωστότερης υπάρχουσας χειρουργικής εκτομής για τον καρκίνο του ορθού, της «ολικής μεσοορθικής εκτομής» κατάφερε να επιτύχει άριστα αποτελέσματα στη διατήρηση των σφιγκτήρων χωρίς τη χορήγηση νέο-επικουρικής θεραπείας, με ποσοστά χαμηλών προσθίων εκτομών στο 90% των ασθενών του, με μόνο το 10% των ασθενών με καρκίνο να καταλήγουν στην κοιλιοπερινεϊκή εκτομή, το οποίο και μεταφραζόταν σε μόνιμη απώλεια των σφιγκτήρων τους. Έτσι, φαίνεται ότι η άρτια χειρουργική τεχνική είναι αυτή που έχει μεγαλύτερη σημασία στη διατήρηση των σφιγκτήρων και όχι η χορήγηση της προεγχειρητικής ακτινο-θεραπείας.

Α. ΔΙΔΑΚΤΟΡΙΚΗ ΔΙΑΤΡΙΒΗ
ΘΕΟΔΩΡΟΠΟΥΛΟΣ Γ
Ιστική ανίχνευση και μελέτη καρκινικών δεικτών (TPA, Ki67-Ag, Ινονενκτίνη, Καθεψίνη D) σε νεοπλάσματα του γαστρεντερικού σωλήνα
Αθήνα 1998
Β. ΣΥΓΓΡΑΦΗ ΒΙΒΛΙΩΝ
1. Β.Α. ΚΟΜΠΟΡΟΖΟΣ, Γ.Ε. ΘΕΟΔΩΡΟΠΟΥΛΟΣ, Χ.Φ. ΓΕΩΡΓΙΑΔΗΣ
«ΤΕΚΜΗΡΙΩΜΕΝΗ ΑΝΤΙΜΕΤΩΠΙΣΗ ΤΟΥ ΟΡΘΟΚΟΛΙΚΟΥ ΚΑΡΚΙΝΟΥ ΚΑΙ ΤΟΥ ΚΑΡΚΙΝΟΥ ΤΟΥ ΠΡΩΚΤΟΥ», ΙSBN: 978-960-93-4232-2
Αθήνα 2012
2. Digestive System Diseases: Stem Cell Mechanisms and Therapies
Editors: Gazouli Maria, Theodoropoulos George (Springer, 2019)
Γ. ΚΕΦΑΛΑΙΑ ΣΕ ΒΙΒΛΙΑ
1. ΓΑΖΟΥΛΗ Μ, ΠΑΠΑΚΩΝΣΤΑΝΤΙΝΟΥ Ι, ΘΕΟΔΩΡΟΠΟΥΛΟΣ Γ. «Moριακή Βιολογία Οισοφαγικού Καρκίνου- Υπερέκφραση Κυκλίνης D, p53, NFκB, E- Cadherin», Καρκίνος Οισοφάγου, Έκδοση της Ελληνικής Εταιρείας Ογκολογίας Πεπτικού, σελ. 113-119
2. ΘΕΟΔΩΡΟΠΟΥΛΟΣ Γ. «Η σημασία της ολικής εκτομής του μεσοορθού», Τιμητικός Τόμος της Ελληνικής Αντικαρκινικής Εταιρείας, 50 χρόνια, Εκδ. 2007, σελ: 173-181
3. Συνεργασία στη συγγραφή του κεφαλαίου «Λαπαροσκοπική Αντιμετώπιση Καρκίνων Πεπτικού Συστήματος» (Κεφ. 14), Επίτομος Χειρουργική Ογκολογία Πεπτικού Συστήματος, Δ. Πανουσόπουλος, Ν. Αποστολίδης, Εκδ. Επτάλοφος, Αθήνα 2006
4. ΘΕΟΔΩΡΟΠΟΥΛΟΣ Γ. «Λεπτό έντερο», Κεφ. 32 (σελ.565-573) στο Βιβλίο: «ΧΕΙΡΟΥΡΓΙΚΗ, Από το Διδακτικό & Ερευνητικό Προσωπικό του Χειρουργικού Τομέα», ΙSBN: 978-960-489-253-2, Εκδόσεις Πασχαλίδης, 2012
5. ΖΩΓΡΑΦΟΣ Γ, ΘΕΟΔΩΡΟΠΟΥΛΟΣ Γ. «Ειλεός», Κεφ. 37 (σελ. 617-628) στο Βιβλίο: «ΧΕΙΡΟΥΡΓΙΚΗ, Από το Διδακτικό & Ερευνητικό Προσωπικό του Χειρουργικού Τομέα», ΙSBN: 978-960-489-253-2, Εκδόσεις Πασχαλίδης, 2012
6. ΘΕΟΔΩΡΟΠΟΥΛΟΣ Γ. «Αρχές χειρουργικής εκτομής πρώιμου καρκίνου του παχέος εντέρου» (σελ. 195-218) στο Βιβλίο: «Καρκίνος του Παχέος Εντέρου», Επιμελητής έκδοσης: Β. Μπαρμπούνης, ISBN: 978-960-99062-1-0, Σειρά: Εγχειρίδια για τον καρκίνο, Α΄ Έκδοση, Αθήνα 2011
7. THEODOROPOULOS G. “Cutaneous Advancement Flap Combined with “Tailored” Lateral Internal Sphincterotomy for Chronic Anal Fissure: Results from our Prospective Database and Review of the Literature” (pages: 25-47) στο βιβλίο: Fistulas and Fissures: Types, Symptoms, Causes and Treatment, Editors: D. Pavlovich & S. Ivanovich, ISBN: 987-1-62618-069-7, Nova Science Publishers, Inc, New York, New York, USA, 2013
8. Theodoropoulos, George E. Μichailidou Efterpi, Kolovos George: The Role of Stem Cells in the Treatment of Anal Fistulas (Digestive System Diseases: Stem Cell Mechanisms and Therapies, Springer 2019, Pages 113-135)
Δ. ΑΡΘΡΟΦΡΑΦΙΑ ΣΕ ΕΝΤΥΠΑ ΚΟΙΝΩΝΙΚΟΥ ΕΝΔΙΑΦΕΡΟΝΤΟΣ
Συνεργασία με το περιοδικό ΘΗΤΕΙΑ (εκδίδεται από τη Διεύθυνση Ενημέρωσης του Υπουργείου Εθνικής Άμυνας), με αρθρογράφηση ιατρικών θεμάτων:
-
ΚΥΣΤΗ ΚΟΚΚΥΓΑ. Ένα συχνό πρόβλημα υγείας στο στρατό. ΘΗΤΕΙΑ, Τεύχος 91, Οκτώβριος 2002.
-
ΚΗΛΗ. Από τον Ιπποκράτη στη Λαπαροσκόπηση. ΘΗΤΕΙΑ, Τεύχος 92, Νοέμβριος 2002.
-
ΤΕΧΝΟΛΟΓΙΑ ΚΑΙ ΙΑΤΡΙΚΗ. Η/Υ, Λαπαροσκόπηση, Τηλεχειρουργική, Ρομποτική... ΘΗΤΕΙΑ, Τεύχος 93, Δεκέμβριος 2002.
-
AIDS. Η γνώση και η πρόληψη σώζουν. ΘΗΤΕΙΑ, Τεύχος 94, Ιανουάριος 2003.
-
ΚΑΡΚΙΝΟΣ, Μέρος Ι, ΘΗΤΕΙΑ, Τεύχος 95, Φεβρουάριος 2003
-
ΚΑΡΚΙΝΟΣ, Μέρος ΙΙ, ΘΗΤΕΙΑ, Τεύχος 96, Μάρτιος 2003
-
ΑΙΜΟΡΡΟΪΔΕΣ, ΘΗΤΕΙΑ, Τεύχος 98, Μάιος 2003
Συνεργασία με το περιοδικό ΙΑΤΡΙΚΟΣ ΚΟΣΜΟΣ με αρθρογράφηση ιατρικών θεμάτων:
-
Λαπαροσκοπική κολεκτομή
Ιατρικός κόσμος, 2004, Περίοδος Β, αρ. Τεύχους 14
-
Εκκολπωμάτωση- Εκκολπωματίτιδα
Ιατρικός κόσμος, 2004, Περίοδος Β, αρ. Τεύχους 17
-
H ακράτεια του εντέρου και η νέα ελάχιστα επεμβατική μέθοδος αντιμετώπισής της
Ιατρικός κόσμος, 2005, Περίοδος Β, αρ. Τεύχους 20
Συνεργασία με το περιοδικό Leaders στην Υγεία με αρθρογράφηση ιατρικών θεμάτων:
-
Monitor Δημοσιεύματα πάνω στη Χειρουργική Ογκολογία, 2010, Τεύχος 1
Συνεργασία με το περιοδικό «Ευεξία και διατροφή»
-
Χειρουργική θεραπεία της δυσκοιλιότητας, Μάιος-Ιούνιος 2012
A. ΠΡΟΣΚΕΚΛΗΜΕΝΟΣ ΟΜΙΛΗΤΗΣ ΣΕ ΣΥΝΕΔΡΙΑ
1. Διάλεξη σε δορυφορικό συμπόσιο στα πλαίσια του 1ου Πανελληνίου Συνεδρίου της Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου- Πρωκτού, Θεσσαλονίκη, 25-27.2.2005, με θέμα: «Η μέθοδος SECCA στην αντιμετώπιση της ακράτειας»
2. Συμμετοχή σε στρογγυλή τράπεζα στο 1ο Πανελλήνιο Συνέδριο των Βασικών Ιατρικών Επιστημών, «Από την Εργαστηριακή Εξέταση στην Κλινική Εφαρμογή και Πράξη», Ίδρυμα Ευγενίδου, Αθήνα, 7-10.12.2005, με θέμα: «Νέα δεδομένα σε κληρονομικά σύνδρομα πεπτικού»
3. Ομιλία στα πλαίσια του 25ου Πανελλήνιου Συνεδρίου Χειρουργικής, Διεθνές Χειρουργικό Φόρουμ 2006, Αθήνα, 22-26.11.2006 με θέμα: «Η υπερηχογραφικά καθοδηγούμενη απολίνωση αιμορροϊδικών αρτηριών (DG-HAL) στην αντιμετώπιση της αιμορροϊδικής νόσου»
4. Ομιλία στα πλαίσια της Επιστημονικής Ημερίδας: «Τι νεότερο στις Παθήσεις Παχέος εντέρου- Πρωκτού», Αθήνα 16.12.2006 με θέμα: «Ακράτεια πρωκτού»
5. Ομιλία στο 8ο Πανελλήνιο Συνέδριο Management υπηρεσιών Υγείας και Κοινωνικής Φροντίδας, Ερέτρια, 28-30.9.2006 με θέμα: «Η οργάνωση της μονάδας ελέγχου του Γαστρεντερικού Σωλήνα»
6. Ομιλία στο 1ο Διεθνές Συμπόσιο για τις Προοπτικές της Ποιότητας Ζωής των Ασθενών- Απαρτιωμένη Προσέγγιση στις Μεταμοσχεύσεις Οργάνων, στη Χειρουργική Ογκολογία & Ογκολογία στη Νοτιο-Ανατολική Ευρώπη, Σμύρνη, Τουρκία, 5-8.5.2006, με θέμα: «Σύγχρονες απόψεις στην αντιμετώπιση του καρκίνου του οισοφάγου»
7. Διάλεξη στο 10ο Παγκύπριο Χειρουργικό Συνέδριο, Λευκωσία, Κύπρος, 21-22.10.2006 με θέμα: «Χειρουργικές Παθήσεις Πρωκτού»
8. Συμμετοχή σε στρογγυλή τράπεζα στο 10ο Παγκύπριο Χειρουργικό Συνέδριο, Λευκωσία, Κύπρος, 21-22.10.2006 με θέμα ομιλίας: «Ενδοσκοπική προσπέλαση παθήσεων παχέος εντέρου»
9. Διάλεξη στην 4η Επιστημονική Ημερίδα Συλλόγου Καρκινοπαθών Εθελοντών Φίλων Ιατρών (ΚΕΦΙ) Αθηνών- Καρκίνος...Μπορεί να νικηθεί, Αθήνα 11.11.2007 με θέμα: «Εξελίξεις στη χειρουργική αντιμετώπιση του καρκίνου του παχέος εντέρου»
10. Συμμετοχή σε επιστημονική συνεδρία με τίτλο: “Laparoscopy and adhesions” στο 15th International Congress of the European Association for Endoscopic Surgery (EAES), Athens, 4-7.7.2007 με θέμα ομιλίας: “Adhesions: a medical, surgical, or economical problem”
11. Συμμετοχή σε στρογγυλή τράπεζα στο 7th Mediterranean & Middle Eastern Endoscopic Surgery (MMESA), El-Gouna Hurghada- Egypt, 2-5.12.2007 με θέμα ομιλίας: “Laparoscopic Low Anterior Resection”
12. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Εγχειρητική προσπέλαση του ορθοκολικού καρκίνου σήμερα» στο Πανελλήνιο Αντικαρκινικό Συνέδριο, Αθήνα 25.11-2.12.2007 με εισήγηση με τίτλο: «Η σημασία της αφαίρεσης του μεσοορθού στη χειρουργική του καρκίνου του ορθού»
13. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Εξελίξεις στην Ελάχιστα Επεμβατική Χειρουργική» στο 1ο Πανελλήνιο Συνέδριο Εταιρείας Ιατρικών Σπουδών- «Τι νεότερο στην Ιατρική», Αθήνα, 21-22.3.2008 με θέμα ομιλίας: «Διαπρωκτική Ενδοσκοπική Μικροχειρουργική- ΤΕΜ»
14. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Τεχνικές πρόσβασης NOTES- προσπέλαση της περιτοναϊκής κοιλότητας» στην 1η Επιστημονική Συνάντηση Ενδοσκοπικής Χειρουργικής μέσω Φυσικών Οπών (NOTES), Aθήνα, 28-29.3.2008 με θέμα ομιλίας: «Διαορθική προσπέλαση της περιτοναϊκής κοιλότητας»
15. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Επίκαιρα Θέματα στον Καρκίνο του Ορθού» στο 3ο Πανελλήνιο Συνέδριο & International Forum του Ελληνικού Κολλεγίου Χειρουργών, Αθήνα, 17-19.4.2008 με θέμα ομιλίας: «Η σημασία της ολικής εκτομής του μεσοορθού»
16. Διάλεξη σε δορυφορικό συμπόσιο με τίτλο «Αντιμετώπιση της αιμορροϊδοπάθειας με την υπερηχογραφικά καθοδηγούμενη απολίνωση αιμορροϊδικών αρτηριών (DG-HAL)» στο 3ο Πανελλήνιο Συνέδριο Ελληνικής Εταιρείας Χειρουργικής Πεπτικού (ΕΛΕΧΕΠ), Αθήνα, 4-6.4.2008, με θέμα ομιλίας: «H.A.L. Τεχνική, ενδείξεις, παγκόσμια δεδομένα»
17. Διάλεξη σε δορυφορικό συμπόσιο με τίτλο «Αντιμετώπιση της αιμορροϊδοπάθειας με την υπερηχογραφικά καθοδηγούμενη απολίνωση αιμορροϊδικών αρτηριών (DG-HAL)» στο 3ο Πανελλήνιο Συνέδριο Ελληνικής Εταιρείας Χειρουργικής Πεπτικού (ΕΛΕΧΕΠ), Αθήνα, 4-6.4.2008, με θέμα ομιλίας: «H.A.L., R.A.R., Αιμορροϊδοπηξία και ελαχίστη εκτομή για αιμορροΐδες ΙΙΙ και ΙV βαθμού: Προοπτική, πολυκεντρική μελέτη»
18. Συμμετοχή σε συνεδρίαση με τίτλο «Καρκίνος Παχέος Εντέρου» στο συνέδριο Θέματα Αιχμής στη Σύγχρονη Ογκολογία- Σημερινές Απαντήσεις και Μελλοντικές Προοπτικές, Αθήνα, 17-18.10.2008 με θέμα ομιλίας: «Χειρουργική αντιμετώπιση του καρκίνου του ορθού. Κριτήρια και επιλογές»
19. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Λαπαροσκοπική Χειρουργική: παρόν και μέλλον» στο 26ο Πανελλήνιο Συνέδριο Χειρουργικής- Διεθνές Χειρουργικό Φόρουμ 2008, Αθήνα, 12-15.11.2008 με εισήγηση με τίτλο: «Λαπαροσκοπική χειρουργική παθήσεων παχέος εντέρου»
20. Συμμετοχή σε επιστημονική συνεδρία με τίτλο “ICU as a specialty in surgery and nursing” στο Τhe 5th International Infection Control Conference of Theodor Bilharz Research Institute (TRBI) and the 3rd Egyptian-Greek Training Course on “Intensive Care Skills and Associated Infection Control Protocols”, Cairo, Egypt, 2-5.3.2009 με ομιλία με τίτλο: “ICU and clinical specialty in surgery (Greek experience)”
21. Συμμετοχή σε επιστημονική συνεδρία με τίτλο “Patient admission, access and diagnostic procedures in the ICU” στο Τhe 5th International Infection Control Conference of Theodor Bilharz Research Institute (TRBI) and the 3rd Egyptian-Greek Training Course on “Intensive Care Skills and Associated Infection Control Protocols”, Cairo, Egypt, 2-5.3.2009 με ομιλία με τίτλο: “Access procedures in the ICU: Vascular, Urologic, Respiratory and Pulmonary catheters”
22. Συμμετοχή σε επιστημονική συνεδρία με τίτλο “Specific problems, Basic monitoring and Infection control measures in ICU” στο Τhe 5th International Infection Control Conference of Theodor Bilharz Research Institute (TRBI) and the 3rd Egyptian-Greek Training Course on “Intensive Care Skills and Associated Infection Control Protocols”, Cairo, Egypt, 2-5.3.2009 με ομιλία με τίτλο: “Pressure ulcers”
23. Συμμετοχή σε επιστημονική συνεδρία με τίτλο “Circulatory system: Theoritical and Practical” στο Τhe 5th International Infection Control Conference of Theodor Bilharz Research Institute (TRBI) and the 3rd Egyptian-Greek Training Course on “Intensive Care Skills and Associated Infection Control Protocols”, Cairo, Egypt, 2-5.3.2009 με ομιλία με τίτλο: “Cardiac arrest”
24. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Χειρουργική Θεραπεία του Καρκίνου του Ορθού» στο 3ο Πανελλήνιο Συνέδριο Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου- Πρωκτού, Αθήνα 15-17.5.2009 με εισήγηση με τίτλο: «Λειτουργικές επιπτώσεις (εγκαρσία κολοπλαστική vs J-pouch) και ογκολογικά αποτελέσματα»
25. Διάλεξη στο New European Surgical Academy (NESA) Congress 2009, Athens, 28-30.5.2009 με θέμα: “Innovative techniques for colorectal specimen retrieval”
26. Συμμετοχή σε στρογγυλή τράπεζα στο συνέδριο Θέματα Αιχμής στη Σύγχρονη Ογκολογία- Σημερινές Απαντήσεις και Μελλοντικές Προοπτικές, Αθήνα, 9-10.10.2009 με την ομιλία: «Σύγχρονη χειρουργική αντιμετώπιση του καρκίνου του ορθού»
27. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Λαπαροσκοπική Χειρουργική Πεπτικού» στο 29ο Πανελλήνιο Συνέδριο Γαστρεντερολογίας, Χαλκιδική, 15-18.10.2009 με εισήγηση με τίτλο: «Η λαπαροσκοπική χειρουργική στον καρκίνο του ορθού»
28. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Προηγμένη Λαπαροενδοσκοπική Χειρουργική» στο 9ο ΕλλαδοΚυπριακό Συνέδριο, Λευκωσία, 30.10-1.11.2009 με την ομιλία: «Ποιότητα ζωής μετά ανοικτή ή λαπαροσκοπική κολεκτομή»
29. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Αφόδευση- Ακράτεια κοπράνων» στην Εκπαιδευτική Πρωκτολογική Ημερίδα, Αθήνα, 16.10.2010 με την εισήγηση: «Χειρουργική αντιμετώπιση ακράτειας κοπράνων»
30. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Ηπατικές μεταστάσεις από κολο-ορθικό καρκίνο (ΙΙ)» στο 4ο Μετεκπαιδευτικό Σεμινάριο της Εταιρείας Μελέτης Μεταστατικής Νόσου του Ήπατος, Βόλος, 18-19.02.2011 με την εισήγηση: «Σταδιοποίηση και χειρουργική αντιμετώπιση του καρκίνου του ορθού»
31. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Καρκίνος Ορθού. Σύγχρονη Αντιμετώπιση» στο 2ο Πανελλήνιο Συνέδριο Χειρουργικής Κλινικής Ογκολογίας και Πρόληψης Καρκίνου στη Μακεδονία, Λιτόχωρο Πιερίας, 16-18.09.2011 με την εισήγηση: «Χειρουργικές τεχνικές στον καρκίνο του ορθού»
32. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Επιπλεγμένη περιεδρική νόσος Crohn» στο 10ο Πανελλήνιο Συνέδριο Φλεγμονωδών Νοσημάτων του Εντέρου, Καλαμάτα, 27-29.05.2011 με θέμα: «Συνδυασμένη συντηρητική και χειρουργική αντιμετώπιση της περιεδρικής νόσου Crohn (εξέταση υπό αναισθησία)» (ταυτόχρονη παρουσίαση με τον Γαστρεντερολόγο κο Ε. Συμβουλάκη)
33. Διάλεξη στο 16ο Παγκρήτιο Ιατρικό Συνέδριο, Αγ. Νικόλαος, 25-28.10.2012 με θέμα: «Οξεία εκκολπωματίτιδα: Σύγχρονες ενδείξεις χειρουργικής αντιμετώπισης»
34. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «ACS-Greek Chapter: Νεότερες απόψεις στη διάγνωση και θεραπεία των παθήσεων του παχέος εντέρου» στο 28ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2012, Αθήνα, 21-24.11.2012 με την εισήγηση: «Φλεγμονώδεις νόσοι: Σύγχρονες απόψεις» (21.11.2012)
35. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Ανατομικές και λειτουργικές διαταραχές της πυέλου στη χειρουργική του ορθού και του πρωκτού» στο 28ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2012, Αθήνα, 21-24.11.2012 με την εισήγηση: «Mετεγχειρητική πυελική δυσλειτουργία» (21.11.2012)
36. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Surgical Oncology» στο 28ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2012, Αθήνα, 21-24.11.2012 με την εισήγηση: «Sphincter-preserving and rectal-saving approaches for lower rectal cancer. How far can we go?» (22.11.2012)
37. Σχολιαστής σε στρογγυλή τράπεζα με τίτλο: «Αμφιλεγόμενα θέματα που αφορούν στη χρήση νέων υλικών στη Χειρουργική» στο 28ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2012, Αθήνα, 21-24.11.2012
38. Σχολιαστής σε στρογγυλή τράπεζα με τίτλο: «Εξατομικευμένη γονιδιωματική ιατρική - Καρκίνος ορθού» στο 28ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2012, Αθήνα, 21-24.11.2012
39. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Καρκίνος παχέος εντέρου» στα πλαίσια του 9ου Πανελλήνιου Συνεδρίου Δεικτών Καρκίνου & Στοχευμένης Θεραπείας, Αθήνα, 29.11-1.12.2012 που διοργανώθηκε από την Ελληνική Εταιρεία Δεικτών Καρκίνου και Στοχευμένης Θεραπείας, με την εισήγηση: «Κληρονομικός καρκίνος παχέος εντέρου» (30.11.2012)
40. Σχολιαστής σε στρογγυλή τράπεζα με τίτλο «Νεότερα δεδομένα στον καρκίνο του παχέος εντέρου- Παρουσίαση περιστατικού» στο 7ο Μετεκπαιδευτικό Σεμινάριο της Εταιρείας Μελέτης Μεταστατικής Νόσου του Ήπατος, Ναύπλιο, 21-22.02.2014
41. Συμμετοχή στο 5ο Πανελλήνιο Συνέδριο της Ελληνικής Εταιρείας Χειρουργικής Πεπτικού, 7-9.03.2014, Καλαμπάκα,με ομιλία με τίτλο: «Περιεδρική νόσος Crohn»
42. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «NESA’S SURGICAL, GYNECOLOGICAL INTERDISCIPLINARY SESSION» στο AOGQ 4th International Symposium/MSRM/NESA Days 2014, Ag. Nikolaos, Crete, 19-21.09.2014 με την εισήγηση: «Do minimally invasive approaches confer an advantage to inflammatory bowel disease surgery?» (21.09.2014)
43. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Ελκώδης κολίτιδα: Ιατρική βασισμένη σε ενδείξεις (Evidence Based Medicine) και κατευθυντήριες οδηγίες» στο 29ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2014, Αθήνα, 12-16.11.2014 με την εισήγηση: «Αντιμετώπιση των επιπλοκών της ειλεϊκής ληκύθου μετά την ολική ορθοκολεκτομή» (16.11.2014)
44. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Σύγχρονα Θέματα στην Ογκολογία» στις Πανελλήνιες Εκπαιδευτικές ημερίδες πρωτοβάθμιας φροντίδας υγείας «Γ. Παπαδάκης», Αθήνα, 9-13.02.2015 με την εισήγηση: «Καρκίνος Παχέος Εντέρου»
45. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Λαπαροσκοπική Χειρουργική Κατώτερου Πεπτικού» στο 11ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής, Αθήνα, 8-10.05.2015 με την εισήγηση: «Δεξιά Κολεκτομή. Κινητοποίηση, απολίνωση αγγείων και αναστόμωση. Πώς; (video)»
46. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Χειρουργική Αντιμετώπιση Κολίτιδων» στο 14ο Πανελλήνιο Συνέδριο Χειρουργικών Λοιμώξεων, Ηράκλειο Κρήτης, 29.04-01.05.2015 με την εισήγηση: «Η αντιμετώπιση της ισχαιμικής κολίτιδας»
47. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «ΙΦΝΕ» στο 35ο Πανελλήνιο Συνέδριο Γαστρεντερολογίας, Καλαμάτα, 8-11.10.2015 με την εισήγηση: «Νόσος Crohn: Συντηρητική ή Χειρουργική Αντιμετώπιση;»
48. . Συμμετοχή σε στρογγυλή τράπεζα με τίτλο ΣΥΝΕΔΡΙΑ V- ΠΑΧΕΟΣ ΕΝΤΕΡΟΥ ΚΑΙ ΠΡΩΚΤΟΥ στην Ετήσια Ημερίδα Επιστημονικών Τμημάτων Ελληνικής Γαστρεντερολογικής Εταιρείας, Αθήνα 04.04.2015 με την εισήγηση: «Περιπρωκτικά συρίγγια: χειρουργική αντιμετώπιση»
48. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Εμβολιασμός για την πρόληψη HPV-σχετιζόμενων παθήσεων σε γυναίκες και άνδρες» στην 7η Σύνοδο της Ελληνικής ΗPV Εταιρείας, Θεσσαλονίκη, 26.02.2016 με την εισήγηση «ΗPV εμβολιασμός και η επίδρασή του στον HPV επιπολασμό και στις αλλοιώσεις στην περιοχή του πρωκτού»
49. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Χειρουργική αντιμετώπιση του καρκίνου του ορθού» στο 30ο Πανελλληνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2016, Θεσσαλονίκη 09-12.11.2016 με την εισήγηση «Διορθική χειρουργική αντιμετώπιση του καρκίνου του ορθού»
50. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Διλήμματα στη χειρουργική του κατώτερου πεπτικού» στο 30ο Πανελλληνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2016, Θεσσαλονίκη 09-12.11.2016 με την εισήγηση «Πρόπτωση ορθού, ελάχιστα επεμβατικές τεχνικές»
51. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Τεχνικά ζητήματα της ογκολογικής κολεκτομής» στο 6ο Πανελλήνιο Συνέδριο της Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου και Πρωκτού, Αθήνα 31.03-2.04.2016 με την εισήγηση «Σφιγκτηροσωστικές και ορθοσωστικές επεμβάσεις για καρκίνο ορθού»
52. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Χειρουργική Ογκολογία και Λεμφικό Σύστημα» στο 3ο Πανελλήνιο Λεμφολογικό Συνέδριο, Αμφιθέατρο του Ιπποκρατείου Νοσοκομείου Αθηνών, Αθήνα, 03-04.06.2016, με την εισήγηση «Λεμφαδενικός καθαρισμός κατώτερου πεπτικού»
53. Ομιλία με τίτλο «Χειρουργική αντιμετώπιση των φλεγμονωδών νόσων του εντέρου» στο 15ο Πανελλήνιο Συνέδριο Ιδιοπαθών Φλεγμονωδών Νοσημάτων του Εντέρου, Ιωάννινα, 03-05.06.2016
54. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Νεότερες εξελίξεις στη Χειρουργική Ογκολογία» στο 3ο Πανελλήνιο Συνέδριο Γενικής Χειρουργικής, Βόλος, 10-12.06.2016 με την εισήγηση «Σφιγκτηροσωστικές και ορθοσωστικές επεμβάσεις για τον καρκίνο του ορθού»
55. Συμμετοχή στο 2ο Επιστημονικό Forum: Ογκολογία Quo Vadis, Ναύπλιο, 29.09–01.10.2017 με τη διάλεξη «Θεραπευτικές εξελίξεις και κλινική πράξη. Χειρουργική ογκολογία κατώτερου πεπτικού»
56. Ομιλία στη συνεδρία «Διάλεξη ΙΙΙ» (προεδρείο: Κ. Κουτσόπουλος, Π. Τέκκης) στο 13ο Ελλαδο-Κυπριακό Συνέδριο, Λεμεσός, Κύπρος, 23-25.11.2017 με τίτλο: «Ελάχιστα επεμβατική χειρουργική του ορθού»
57. Διάλεξη στο 7ο Πανελλήνιο Συνέδριο Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου – Πρωκτού, Λάρισα, 15-17.12.2017 με τίτλο: «Tips and tricks στην ογκολογική αρτιότητα της κολεκτομής»
58. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Σύγχρονες απόψεις στη Χειρουργική Ογκολογία» στις Πανελλήνιες Εκπαιδευτικές Ημερίδες Πρωτοβάθμιας Φροντίδας Υγείας «Γ. Παπαδάκης», Αθήνα, 13-17.02.2017 με την εισήγηση «Σύγχρονες απόψεις στη Χειρουργική Ογκολογία: Κατώτερο πεπτικό σύστημα»
59. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Συρίγγια στο χειρουργικό ασθενή» στο 15ο Πανελλήνιο Συνέδριο Χειρουργικών Λοιμώξεων, Αθήνα 10-12. 11. 2017 με την εισήγηση: «Περιπρωκτικά συρίγγια»
60. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο ΝΕΕΣ ΕΓΧΕΙΡΗΤΙΚΕΣ ΤΕΧΝΙΚΕΣ ΣΤΟΝ ΚΑΡΚΙΝΟ ΤΟΥ ΟΡΘΟΥ στο 13ο Συνέδριο της Χειρουργικής Εταιρείας Βορείου Ελλάδος "Σύγχρονη Τεχνολογία & Χειρουργική Εκπαίδευση", Θεσσαλονίκη 03-05.11.2017 με την εισήγηση: «Transanal Minimal Invasive Surgery (TAMIS)»
61. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο “Live video presentation session” στο 12ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής, Αθήνα 29.09-01.10.2017 με την εισήγηση: «TaTME»
62. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Ο ρόλος του χειρουργού στις ΙΦΝΕ» στην 1η Ημερίδα της Μονάδας Παχέος Εντέρου και Πρωκτού «Φλεγμονώδεις νόσοι του εντέρου», Αθήνα 28.04.2018 με την εισήγηση «Λαπαροσκοπική χειρουργική για τη νόσο Crohn: Τεχνικές και αποτελέσματα»
63. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο ««Νανοϊατρική» στο 2ο Συνέδριο Φοιτητών Ιατρικών Σχολών, Πάτρα 23-25.03.2018 με την εισήγηση: «Εφαρμογές της Νανοϊατρικής στην Χειρουργική»
64. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Αντιμετώπιση επιπλοκών χειρουργικής παχέος εντέρου» στο 31ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2018, Αθήνα 21-21.11.2018 με την εισήγηση «Λειτουργικές μετεγχειρητικές διαταραχές»
65. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Debates in Rectal Cancer» στο 11th Biennial Congress of the Mediterranean Society of Coloproctology, Thessaloniki, Greece, 04-05.05.2018 με την εισήγηση «Sphincter-preserving approaches for rectal cancer»
66. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Χειρουργική αντιμετώπιση νόσου Crohn» στο 17ο Πανελλήνιο Συνέδριο Ιδιοπαθών Φλεγμονωδών Νόσων του Εντέρου, Θεσσαλονίκη, 18-20.05.2018 με την εισήγηση: «Περιορισμένη ειλεοτυφλική νόσος: Χειρουργική αντιμετώπιση»
67. Διάλεξη στο 38ο Πανελλήνιο Συνέδριο Γαστρεντερολογίας, Αθήνα 06-09.12.2018 με τίτλο: «Λαπαροσκοπική/Ελάχιστα επεμβατική χειρουργική στα ΙΦΝΕ»
68. Συμμετοχή στην Ημερίδα της Ελληνικής Αντικαρκινικής Εταιρείας «Ενημερώνομαι και προλαμβαίνω: Καρκίνος παχέος εντέρου & Καρκίνος προστάτη» (Στυλίδα, 28.11.2018) με την ομιλία: «Καρκίνος παχέος εντέρου: Εισαγωγικά στοιχεία – Χειρουργική Θεραπεία»
69. Συμμετοχή σε στρογγυλή τράπεζα με θέμα «Ελάχιστα επεμβατική ιατρική» στο Συνέδριο του Ινστιτούτου Βιοϊατρικών Επιστημών «ΑΘΗΝΑ» με τίτλο «Σύγχρονη Δυτική και Ιπποκρατική ιατρική πρακτική. Εξατομικευμένη – στοχευμένη θεραπεία των νεοπλασμάτων», Αθήνα 11-12.05.2018 με την εισήγηση: «Λαπαροσκοπική χειρουργική»
70. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο “Treatment challenges in rectal cancer (II)” στο “Advances and Perspectives in Gastrointestinal Oncology”, Αthens, 15-17.03.2018 με την εισήγηση: “Early rectal cancer: which technique and from whom”
71. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Στην εποχή των ελάχιστων παρεμβάσεων ή αλλιώς Less is More…paradigm shift: εφαρμογές στους τοπικούς χειρισμούς» στο Πανελλήνιο Συνέδριο «Από τη Χημειοθεραπεία στη Μοριακή Στόχευση – Η εξέλιξη στην αντινεοπλασματική θεραπεία», Αθήνα 07-09.12.2018 με την εισήγηση: «Εφαρμογές σε καρκίνο παχέος εντέρου»
72. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Νεώτερες Τεχνικές Χειρουργικής Αντιμετώπισης του Καρκίνου του Ορθού» στην 3η επιστημονική εκδήλωση με θέμα: Τεχνικές “Ελάχιστης Παρέμβασης” στην Αντιμετώπιση Παθήσεων Ανώτερου και Κατώτερου Πεπτικού, Θεσσαλονίκη 26.05.2018 με την εισήγηση: «ΤΑΜΙS»
73. Συμμετοχή στο Σεμινάριο Επείγουσας Χειρουργικής της Χειρουργικής Κλινικής Πανεπιστημίου Θεσσαλίας, Λάρισα 11.05.2018 με την ομιλία: «Θεραπευτικές επιλογές στην οξεία περιτονίτιδα»
74. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Μοντέρνες Εγχειρητικές Τεχνικές στον Καρκίνο του Ορθού» στο 27ο Ιατρικό Συνέδριο Ενόπλων Δυνάμεων, Θεσσαλονίκη 18-20.10.2018 με την εισήγηση: «Διαπρωκτική ολική εκτομή μεσοορθού (TaTME)»
75. Ομιλία με τίτλο «TAMIS» στο Colorectal Masterclass “Current trends in minimally invasive colorectal surgery”, Tirana, Albania, 23.11.2019
76. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Καρκίνος Ορθού» στο 14ο Πανελλήνιο Συνέδριο της Ελληνικής Εταιρείας Χειρουργικής Ογκολογίας, Αθήνα, 31.10-03.11.2019 με την εισήγηση «Η διαπρωκτική προσπέλαση στην αντιμετώπιση του καρκίνου του ορθού»
77. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Σύγχρονη αντιμετώπιση του καρκίνου του ορθού» στο 13ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής και 11ο Πανελλήνιο Συνέδριο Χειρουργικής της Παχυσαρκίας, Αθήνα 12-14.04.2019 με την εισήγηση «ΤΜΕ: ανοικτά, λαπαροσκοπικά, ρομποτικά ή διαπρωκτικά (TaTME)»
78. Συμμετοχή σε στρογγυλή τράπεζα με τίτλο «Νεότερες εξελίξεις στη Χειρουργική» στις Πανελλήνιες Εκπαιδευτικές Ημερίδες Πρωτοβάθμιας Φροντίδας Υγείας «Γ. Παπαδάκης», Αθήνα, 11-15.02.2019 με την εισήγηση «Τι νεότερο στον καρκίνο του ορθού»
79. Στα πλαίσια της 1ης Ημερίδας Χειρουργικής με θέμα «Επείγουσα Χειρουργική – Πρόληψη και σύγχρονες αρχές αντιμετώπισης του καρκίνου» (Σπάρτη, 21.09.2019), που οργανώθηκε από τη χειρουργική κλινική του Νοσοκομείου Σπάρτης, σε συνεργασία με την Α΄ Προπαιδευτική Χειρουργική κλινική ΕΚΠΑ, συμμετοχή σε στρογγυλή τράπεζα με θέμα «Πρώιμη διάγνωση του καρκίνου» και εισήγηση με τίτλο: «Πρώιμη διάγνωση του καρκίνου: Καρκίνος παχέος εντέρου»
80. Συμμετοχή σε εισαγωγική στρογγυλή τράπεζα με τίτλο « Καρκίνος και ποιότητα ζωής» κατά την Τελετή Έναρξης του Εκπαιδευτικού Προγράμματος 2020 της Ελληνικής Χειρουργικής Εταιρείας με την εισήγηση «Ποιότητα ζωής μετά από αντιμετώπιση ορθοκολικού καρκίνου»
Β. ΣΥΜΜΕΤΟΧΗ ΣΕ ΣΥΝΕΔΡΙΑ ΩΣ ΜΕΛΟΣ ΟΡΓΑΝΩΤΙΚΗΣ ΕΠΙΤΡΟΠΗΣ ΚΑΙ ΩΣ ΠΡΟΕΔΡΟΣ ΕΠΙΣΤΗΜΟΝΙΚΟΥ ΠΡΟΓΡΑΜΜΑΤΟΣ
1. Πρόεδρος σε συνεδρία ελεύθερων ανακοινώσεων με θέμα «Παθήσεις Πεπτικού Συστήματος», 1ο Πανελλήνιο Συνέδριο & Ιnternational Symposium του Ελληνικού Κολλεγίου Χειρουργών, 9-12.3.2006
2. Μέλος της Επιστημονικής Επιτροπής στο 1ο Διεθνές Συμπόσιο για τις Προοπτικές της Ποιότητας Ζωής των Ασθενών- Απαρτιωμένη Προσέγγιση στις Μεταμοσχεύσεις Οργάνων, στη Χειρουργική Ογκολογία & Ογκολογία στη Νοτιο-Ανατολική Ευρώπη, Σμύρνη, Τουρκία, 5-8.5.2006
3. Πρόεδρος σε διάλεξη με θέμα: «Πρόληψη των νεοπλασμάτων της ουροδόχου κύστεως» στην 4η Επιστημονική Ημερίδα Συλλόγου Καρκινοπαθών Εθελοντών Φίλων Ιατρών (ΚΕΦΙ) Αθηνών- Καρκίνος...Μπορεί να νικηθεί, Αθήνα 11.11.2007
4. Πρόεδρος σε διάλεξη με θέμα: «Πρόληψη, διάγνωση και θεραπευτικές προσεγγίσεις στον πρωτοπαθή καρκίνο του ήπατος» στην 4η Επιστημονική Ημερίδα Συλλόγου Καρκινοπαθών Εθελοντών Φίλων Ιατρών (ΚΕΦΙ) Αθηνών- Καρκίνος...Μπορεί να νικηθεί, Αθήνα 11.11.2007
5. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο «Colorectal» στο 7th Mediterranean & Middle Eastern Endoscopic Surgery (MMESA), El-Gouna Hurghada- Egypt, 2-5.12.2007
6. Faculty στο 15th International Congress of the European Association for Endoscopic Surgery (EAES), Athens, 4-7.7.2007
7. Πρόεδρος σε συνεδρία ελεύθερων ανακοινώσεων με τίτλο “Gastroduodenal Diseases” στο 15th International Congress of the European Association for Endoscopic Surgery (EAES), Athens, 4-7.7.2007
8. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο “Νon malignant pathology of the esophagus: VATS versus endoscopic/laparoscopic techniques” στο 15th International Congress of the European Association for Endoscopic Surgery (EAES), Athens, 4-7.7.2007
9. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο “Minimal invasive surgery for anorectal pathologies” στο 15th International Congress of the European Association for Endoscopic Surgery (EAES), Athens, 4-7.7.2007
10. Μέλος της οργανωτικής επιτροπής της Επιστημονικής Διημερίδας «Αμφιλεγόμενα σημεία στον καρκίνο του μαστού», Αθήνα 12.9.2007
11. Μέλος της οργανωτικής επιτροπής στην 1η Επιστημονική Συνάντηση Ενδοσκοπικής Χειρουργικής μέσω Φυσικών Οπών (NOTES), Aθήνα, 28-29.3.2008
12. Πρόεδρος δορυφορικού συμποσίου με τίτλο «Αντιμετώπιση της αιμορροϊδοπάθειας με την υπερηχογραφικά καθοδηγούμενη απολίνωση αιμορροϊδικών αρτηριών (DG-HAL)» στο 3ο Πανελλήνιο Συνέδριο Ελληνικής Εταιρείας Χειρουργικής Πεπτικού (ΕΛΕΧΕΠ), Αθήνα, 4-6.4.2008
13. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο «Colorectal Cancer» στο 8th International Conference of Anticancer Research, Kos, Greece, 17-22.10.2008
14. Πρόεδρος σε επιστημονικές συνεδρίες στο Τhe 5th International Infection Control Conference of Theodor Bilharz Research Institute (TRBI) and the 3rd Egyptian-Greek Training Course on “Intensive Care Skills and Associated Infection Control Protocols”, Cairo, Egypt, 2-5.3.2009
15. Μέλος της οργανωτικής επιτροπής στο 3ο Πανελλήνιο Συνέδριο Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου- Πρωκτού, Αθήνα 15-17.5.2009
16. Μέλος της οργανωτικής επιτροπής στο New European Surgical Academy (NESA) Congress 2009, Athens, 28-30.5.2009
17. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο «Λαπαροσκοπική Χειρουργική Παχέος Εντέρου» στο 9ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής και Διεθνές Συμπόσιου, Αθήνα, 21-23.5.2009
18. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο «Prevention of Lymphedema» στο XXXVI Congress of European Society of Lymphology, Αθήνα 14-16.5.2010
19. Μέλος Επιτροπής Αξιολόγησης Αναρτημένων Ανακοινώσεων – Βιντεοπροβολών στο 27ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2010, Αθήνα, 24-27.11.2010
20. Πρόεδρος σε συνεδρία ελεύθερων ανακοινώσεων με θέμα: «Κόλον-Ορθό» (27.11.2010) στο 27ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2010, Αθήνα, 24-27.11.2010
21. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο «Εκκολπωματίτιδα: Σταδιοποίηση-Ενδείξεις χειρουργικής θεραπείας» στο 10ο Ελλαδο-Κυπριακό Συνέδριο, Λευκωσία, 18-20.11.2011
22. Γενικός Γραμματέας, 28ο Πανελλήνιο Χειρουργικό Συνέδριο, Αθήνα, 21-24.11.2012
23. Μέλος Επιτροπής Αξιολόγησης Αναρτημένων Ανακοινώσεων, 28ο Πανελλήνιο Χειρουργικό Συνέδριο, Αθήνα, 21-24.11.2012
24. Συντονιστής (21.11.2012) στρογγυλού τραπεζιού με τίτλο: «Ανατομικές και λειτουργικές διαταραχές της πυέλου στη χειρουργική του ορθού και του πρωκτού» στο 28ο Πανελλήνιο Χειρουργικό Συνέδριο, Αθήνα, 21-24.11.2012
25. Πρόεδρος σε διάλεξη με τίτλο «Ελάχιστο χειρουργικό τραύμα αλλά και μέγιστο θεραπευτικό αποτέλεσμα: πότε, πώς, γιατί» (Ομιλητής: Καθηγητής Ι.Μπράμης) στο 28ο Πανελλήνιο Χειρουργικό Συνέδριο, Αθήνα, 21-24.11.2012
26. Πρόεδρος σε διάλεξη με τίτλο «Response to chemoradiation in rectal cancer: are we ready for a new era?» (Ομιλήτρια: Μ. Maas) στο 28ο Πανελλήνιο Χειρουργικό Συνέδριο, Αθήνα, 21-24.11.2012
27. Πρόεδρος σε διάλεξη με τίτλο «Reading rectal cancer MRI: what should surgeons know?» (Ομιλήτρια: Μ. Maas) στο 28ο Πανελλήνιο Χειρουργικό Συνέδριο, Αθήνα, 21-24.11.2012
28. Πρόεδρος σε συνεδρίαση βιντεοπροβολών (22.11.2012) στο 28ο Πανελλήνιο Χειρουργικό Συνέδριο, Αθήνα, 21-24.11.2012
29. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο: «Rectal Cancer (III)» στο 6th International meeting- Colorectal games, Aθήνα, 13-14.06.2014
30. Γενικός Γραμματέας, 29ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2014, Αθήνα, 12-16.11.2014
31. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο: «Νόσος Crohn: Ιατρική βασισμένη σε ενδείξεις (Evidence Based Medicine) και κατευθυντήριες οδηγίες» στο 29ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2014, Αθήνα, 12-16.11.2014
32. Μέλος Επιτροπής Αξιολόγησης Προφορικών Ανακοινώσεων, 29ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2014, Αθήνα, 12-16.11.2014
33. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο: «Η θέση της Ακτινοθεραπείας στις νεοπλασίες του γαστρεντερικού συστήματος» στο 29ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2014, Αθήνα, 12-16.11.2014
34. Πρόεδρος σε διάλεξη με τίτλο « Single-port colectomy: A help or a hype» (Oμιλητής: T. Voloyiannis) στο 29ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2014, Αθήνα, 12-16.11.2014
35. Ειδικός Γραμματέας του 6ου Πανελληνίου Συνεδρίου της Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου και Πρωκτού, Αθήνα 31.03-2.04.2016
36. Ειδικός Γραμματέας του 30ου Πανελληνίου Χειρουργικού Συνεδρίου και Χειρουργικού Φόρουμ 2016, Θεσσαλονίκη 09-12.11.2016
37. Συντονιστής σε στρογγυλή τράπεζα με τίτλο «Τοπικώς προχωρημένος καρκίνος του ορθού: Συστάσεις» στο 30ο Πανελλληνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2016, Θεσσαλονίκη 09-12.11.2016
38. Συντονιστής (μαζί με κο Β. Κομπορόζο) σε συνεδρία MEET THE EXPERTS με θέμα «Αντιπαραθέσεις στις χειρουργικές παθήσεις του ορθού» στο 30ο Πανελλληνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2016, Θεσσαλονίκη 09-12.11.2016
39. Μέλος της Οργανωτικής Επιτροπής του 13ου Ελλαδο-Κυπριακού Συνεδρίου, 23-25. 11.2017, Λεμεσός, Κύπρος
40. Μέλος της Επιστημονικής Επιτροπής του 7ου Πανελληνίου Συνεδρίου Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου – Πρωκτού, Λάρισα, 15-17.12.2017
41. Πρόεδρος σε συνεδρία βιντεοπαρουσιάσεων στο 7ο Πανελλήνιο Συνέδριο Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου – Πρωκτού, Λάρισα, 15-17.12.2017
42. Πρόεδρος στρογγυλής τράπεζας με τίτλο «Βασικές γνώσεις Παθολογικής Ανατομικής στη Χειρουργική Ογκολογία» στο 1ο Διεταιρικό Επιστημονικό Συμπόσιο Χειρουργικής Ογκολογίας «Από τη σύγχρονη Τεχνολογία στην έγκαιρη Διάγνωση και Θεραπεία», Λιβαδειά, 16-18.09.2016
43. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο «Τεχνικά ζητήματα της ογκολογικής κολεκτομής» στο 6ο Πανελλήνιο Συνέδριο της Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου και Πρωκτού, Αθήνα 31.03-2.04.2016
44. Στο πλαίσιο των εκπαιδευτικών δραστηριοτήτων της Μονάδας Μελέτης του Κατώτερου Πεπτικού του Γ.Ν.Α. Ιπποκρατείου και ως υπεύθυνος της Μονάδας Παχέος Εντέρου της Α΄ Προπαιδευτικής Χειρουργικής Κλινικής ΕΚΠΑ, συντονισμός και οργάνωση της 1ης Ημερίδας της Μονάδας Παχέος Εντέρου και Πρωκτού «Φλεγμονώδεις Νόσοι του Εντέρου», Αμφιθέατρο Γ.Ν.Α. Ιπποκρατείου, Αθήνα 21.04.2018
45. Πρόεδρος (μαζί με κο Β. Κομπορόζο) σε στρογγυλή τράπεζα με τίτλο «Ο ρόλος του χειρουργού στις ΙΦΝΕ» στην 1η Ημερίδα της Μονάδας Παχέος Εντέρου και Πρωκτού «Φλεγμονώδεις Νόσοι του Εντέρου», Αμφιθέατρο Γ.Ν.Α. Ιπποκρατείου, Αθήνα 21.04.2018
46. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο «Φλεγμονώδης νόσος του εντέρου. Αναθεώρηση των επιλογών Θεραπείας» στο 31ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2018, Αθήνα 21-21.11.2018
47. Πρόεδρος σε συνεδρία ελεύθερων ανακοινώσεων με θέμα: «Κατώτερο Πεπτικό» στο 31ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2018, Αθήνα 21-24.11.2018
48. Μέλος της Οργανωτικής Επιτροπής του 11th Biennial Congress of the Mediterranean Society of Coloproctology, Thessaloniki, Greece, 04-05.05.2018
49. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο “Robotics in colorectal surgery” στο 11th Biennial Congress of the Mediterranean Society of Coloproctology, Thessaloniki, Greece, 04-05.05.2018
50. Μέλος της Επιστημονικής Επιτροπής στο 4ο Πανελλήνιο Συνέδριο Αναζωογόνησης & Αντιμετώπισης Επείγοντος Περιστατικού, Αθήνα 05-06.10.2018
51. Στο πλαίσιο των εκπαιδευτικών δραστηριοτήτων της Μονάδας Μελέτης του Κατώτερου Πεπτικού του Γ.Ν.Α. Ιπποκρατείου και ως υπεύθυνος της Μονάδας Παχέος Εντέρου της Α΄ Προπαιδευτικής Χειρουργικής Κλινικής ΕΚΠΑ, συντονισμός και οργάνωση της 2ης Ημερίδας της Μονάδας Παχέος Εντέρου και Πρωκτού «Ορθοκολικός Καρκίνος- Προκλήσεις και Διλήμματα», Αμφιθέατρο Γ.Ν.Α. Ιπποκρατείου, Αθήνα 16.03.2019
52. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο “Best Videos- Colorectal” στο 27th International Congress of European Association of Endoscopic Surgery (EAES), Seville, Spain, 12-15.06.2019
53. Πρόεδρος σε στρογγυλή τράπεζα με τίτλο “S50 Upper Gastro-intestinal 3” στο 27th International Congress of European Association of Endoscopic Surgery (EAES), Seville, Spain, 12-15.06.2019
54. Πρόεδρος στρογγυλής τράπεζας με τίτλο «Στοχευμένες ανοσοθεραπείες στον καρκίνο του γαστρεντερικού συστήματος» στο Πανελλήνιο Συνέδριο της Ελληνικής και Διεθνούς Εταιρείας Μοριακά Στοχευμένων & Εξατομικευμένων Θεραπειών, Βόλος 22-24.03.2019
55. Συντονιστής στρογγυλής τράπεζας με τίτλο «Σύγχρονες θεραπευτικές τάσεις στην αντιμετώπιση του καρκίνου του ορθού» στο 3ο Πολυθεματικό Επιστημονικό Συνέδριο ΚΑΤ, 28-30.11.2019
56. Μέλος της Επιστημονικής Επιτροπής στο 13ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής και το 11ο Πανελλήνιο Συνέδριο Χειρουργικής της Παχυσαρκίας, Αθήνα 12-14.04.2019
57. Πρόεδρος στρογγυλής τράπεζας με τίτλο «ΒΙΝΤΕΟΠΡΟΒΟΛΕΣ - Κατώτερο πεπτικό ΙΙΙ» στο 13ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής και 11ο Πανελλήνιο Συνέδριο Χειρουργικής της Παχυσαρκίας, Αθήνα 12-14.04.2019
58. Πρόεδρος (μαζί με τον κο Β. Κομπορόζο) του 1ου Συνεδρίου Κολοπρωκτολογίας: Τεκμηριωμένη γνώση - εξατομικευμένη προσέγγιση της Ελληνικής Εταιρείας Κολοπρωκτολογίας, Αθήνα 23-25.01.2020
59. Πρόεδρος στρογγυλής τράπεζας με τίτλο «Οι αναστομωτικές διαφυγές στη χειρουργική του παχέος εντέρου» στο 1ο Πανελλήνιο Συνέδριο Κολοπρωκτολογίας: Τεκμηριωμένη γνώση- Εξατομικευμένη προσέγγιση, Αθήνα 23-25.01.2020

Γ. ΠΑΡΑΚΟΛΟΥΘΗΣΗ ΕΡΓΑΣΙΩΝ ΣΥΝΕΔΡΙΩΝ ΚΑΙ ΕΠΙΣΤΗΜΟΝΙΚΩΝ ΣΥΝΑΝΤΗΣΕΩΝ (ΧΩΡΙΣ ΤΗΝ ΠΑΡΟΥΣΙΑΣΗ ΕΡΓΑΣΙΩΝ- ΕΙΣΗΓΗΣΕΩΝ)
-
1ο Πανελλήνιο Συνέδριο AIDS και Σεξουαλικώς Μεταδιδόμενων Νοσημάτων, Αθήνα, 25-27.1.1990
-
XVII Πανελλήνιο Συνέδριο Χειρουργικής, Αθήνα, 10-14.11.1990.
-
International Gastro-Surgical Club, Second International Meeting, Athens, 15-17.11.1990.
-
2ο Πανελλήνιο Συνέδριο AIDS και Σεξουαλικώς Μεταδιδόμενων Νοσημάτων, Αθήνα, 23-26.1.1991.
-
12ο Πανελλήνιο Συνέδριο Γαστρεντερολογίας, Αθήνα, 30.10-2.11.1991.
-
17ο Ετήσιο Πανελλήνιο Ιατρικό Συνέδριο, Αθήνα, 7-11.5.1991
-
Ιατροχειρουργική Εταιρεία Αθηνών, 45ο Πανελλήνιο Ιατρικό Συνέδριο, Αθήνα, 21-23.11.1991.
-
6ο Πανελλήνιο Συνέδριο Νοσημάτων Θώρακος, 5-8.12.1991.
-
18ο Ετήσιο Πανελλήνιο Ιατρικό Συνέδριο, Αθήνα, 12-16.5.1992.
-
13ο Πανελλήνιο Καρδιολογικό Συνέδριο, Αθήνα, 26-28.11.1992.
-
ΙΙ Symposium: Advances in Oncology and Respective Surgery, Αθήνα, 6.1993.
-
1ο Πανελλήνιο Συνέδριο Αγγειοχειρουργικής, Αθήνα, 9.1993.
-
7ο Πανελλήνιο Συνέδριο Ογκολογίας, Αθήνα, 11.1993.
-
International Gastro-Surgical Club Athens, 12.1993.
-
5ο Μετεκπαιδευτικό Σεμινάριο στην Ογκολογία του Γαστρεντερολογικού Συστήματος, Αθήνα, 12.1993.
-
III Greek Friends of the Methodist Hospital Symposium, Athens, 5.1994.
-
ΧΙΧ Πανελλήνιο Συνέδριο Χειρουργικής, Θεσσαλονίκη, 10.1994.
-
American College of Surgeons, New Jersey Chapter, 43rd Annual Meeting, Princeton, New Jersey, USA, 12.1994.
-
Breast Cancer Symposium II, Eatontown, New Jersey, USA, 10.1995.
-
American College of Surgeons, New Jersey Chapter, 44th Annual Meeting, New Brunswick, New Jersey, USA, 12.1995.
-
New Jersey Society of Colon and Rectal Meeting, East Orange, New Jersey, USA, 2.1996.
-
Society for Surgical Oncology, 49th Cancer Symposium, Atlanta, Georgia, USA, 3.1996.
-
Eastern Pennsylvania Chapter, American College of Surgeons, Annual Scientific Meeting, Seraton, Pennsylvania, USA, 25.10.1996.
-
Society of Laparoendoscopic Surgeons, 5th Annual Meeting, Orlando, Florida, USA, 12.1996.
-
Seventh Annual Critical Care Symposium, Lehigh Valley Hospital, Allentown, Pennsylvania, USA, 2.1997.
-
Fourth Annual Update on Heart and Lung Surgery, Lehigh Valley Hospital, Allentown, Pennsylvania, USA, 4.1997.
-
Trauma Management: Moving from the Bench to the Bedside, Lehigh Valley Hospital, Allentwon, Pennsylvania, USA, 5.1997.
-
Trauma Symposium, Detroit, Michigan, USA, 11.1997.
-
Breast Cancer Update, St. John Hospital and Medical Center, Detroit, Michigan, USA, 3.1998.
-
American College of Surgeons, 84th Annual Clinical Congress, Orlando, Florida, USA, 10.1998.
-
Trauma Symposium, Detroit, Michigan, USA, 11.1998.
-
Radiology Update, St.John Hospital and Medical Center, Detroit, Michigan, 3.1999.
-
American College of Surgeons, 85th Annual Clinical Clinical Congress, San Francisco, California, USA, 10.1999.
-
Minimally Invasive Surgery Update, St. John Hospital and Medical Center, Detroit, Michigan, USA, 3.2000.
-
American College of Surgeons, Michigan Chapter, 47th Annual Meeting, Traverse City, Michigan, USA, 5.2000.
-
Innovations in the Management of Inflammatory Bowel Disease, Columbus, Ohio, USA, 21.7.2000.
-
46th Annual Meeting of Ohio Chapter, American College of Surgeons, Dayton, Ohio, USA, 10-12.5.2001.
-
Annual Meeting of the American Society of Colon and Rectal Surgeons, San Diego, California, USA, 2-7.6.2001.
-
1ο Πανελλήνιο Συνέδριο Παθήσεων Παχέος Εντέρου- Πρωκτού, υπό την αιγίδα του European Council of Coloproctology, Αθήνα 20-22.9.2002.
-
23ο Πανελλήνιο Χειρουργικό Συνέδριο Χειρουργικής- Διεθνές Χειρουργικό Φόρουμ 2002, Αθήνα 9-12.11.2002.
-
Επιστημονική Ημερίδα: Τεχνικές στη Χειρουργική "How I do it", Εθνικό Ίδρυμα Ερευνών, Αθήνα, 17.5.2003.
-
6ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής & International Symposium of Advanced Laparoendoscopic Surgery, Αθήνα 22-24.5.2003.
-
89th Annual Clinical Congress, American College of Surgeons, Chicago, Illinois, USA, 19-23.10.2003.
-
1o Πανελλήνιο Συνέδριο Ελληνικής Εταιρείας Χειρουργικής Πεπτικού, Αθήνα 20-23.11.2003.
-
4η Επιστημoνική Συνάντηση Προχωρημένης Λαπαροσκοπικής Χειρουργικής, Ιωάννινα 5-7.12.2003.
-
SAGES 2004 Meeting, Denver, Colorado, USA, 31.3-3.4.2004.
-
XXXIX Congress of the European Society for Surgical Research, Athens, Greece, 12.5-15.5.2004.
-
European Council of Coloproctology- European Association of Coloproctology (ECCP-EACP) 2nd Joint Meeting, Bologna, Italy, 15-17.9.2005
-
2005 Clinical Congress American College of Surgeons, San Francisco, CA,USA, 16-20.10.2005
-
2ο Πανελλήνιο Συνέδριο της Ελληνικής Εταιρείας Χειρουργικής Πεπτικού, Αθήνα, 10-13.11.2005
-
Παρακολούθηση τηλεδιάσκεψης με θέμα: «Μέθοδος SECCA: The 20 minutes RF Treatment for Fecal Incontinence», Νοσοκομείο Ε.Ε.Σ., 14.02.2006
-
1ο Διεθνές Συμπόσιο Χειρουργικής Ήπατος- Παγκρέατος- Χοληφόρων «Αντιμετωπίζοντας τον Ηπατοκυτταρικό Καρκίνο και τις Ηπατικές Μεταστάσεις», Αθήνα- Ίδρυμα Ιατροβιολογικών Ερευνών της Ακαδημίας Αθηνών, 7-8.7.2006
-
2nd International Symposium “Colorectal Games”, Ηράκλειο Κρήτης, 5-7.10.2006
-
2nd International Congress of Laparoscopic Colorectal Surgery, Cleveland Clinic, Florida, USA, 13-14.2.2007
-
18th Annual International Colorectal Disease Symposium, An International Exchange of Medical and Surgical Concepts, Cleveland Clinic, Florida, USA, 15-17.2.2007
-
8ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής, Αθήνα, 5-7.7.2007
-
Πανελλήνιο Αντικαρκινικό Συνέδριο, Ελληνική Αντικαρκινική Εταιρεία, Αθήνα, 25.11-2.12.2007
-
Στρατηγική αντιμετώπισης των ηπατικών μεταστάσεων από καρκίνο παχέος εντέρου, Καστοριά, 10-12.4.2009
-
9ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής και Διεθνές Συμπόσιο, Αθήνα, 21-23.5.2009
-
24th Annual Jagelman/34th Annual Turnbull International Colorectal Disease Symposium, Cleveland Clinic, Florida, USA, 12-16.02.2013
-
14th World Congress of Endoscopic Surgery, Paris, France, 25-28.06.2014
-
23rd International Congress of European Association of Endoscopic Surgery (EAES), Bucharest, Romania, 03-06.06.2015
-
American Society of Colon & Rectal Surgeons (ASCRS) Annual Meeting, Los Angeles, USA, 30.04-04.05.2016
-
26th International Congress of the European Association for Endoscopic Surgery (EAES), London, UK, 30.05-01.06.2018
-
4th AISDD Athens International Symposium 2018, 06-07.07.2018
-
Innovations in Colorectal Surgery, VU Medical Center, Amsterdam, The Netherlands, 29.03.2019
-
14o Eλλαδοκυπριακό Χειρουργικό Συνέδριο «Εξελίξεις στη Χειρουργική», Λευκωσία, Κύπρος, 15-17.11.2019
-
Dilemmas & Debates in Colorectal Surgery, Bush House, King's College London, London,UK, 14-18.12.2019
Δ. ΣΥΝΕΔΡΙΑ ΚΑΙ ΣΥΝΑΝΤΗΣΕΙΣ ΜΕ ΠΑΡΟΥΣΙΑΣΗ ΕΡΓΑΣΙΩΝ- ΕΙΣΗΓΗΣΕΩΝ:
Δ1. ΕΛΛΗΝΙΚΑ ΣΥΝΕΔΡΙΑ
-
13ο Πανελλήνιο Συνέδριο Γαστρεντερολογίας, Ρόδος, 13.10-17.10.1993 (2 εργασίες).
-
7ο Πανελλήνιο Συνέδριο Ογκολογίας, Πειραιάς, 4-7.11.1993 (5 εργασίες).
-
ΧΙΧ Πανελλήνιο Συνέδριο Χειρουργικής, Θεσσαλονίκη, 30.10- 3.11.1994 (4 εργασίες).
-
20ο Ετήσιο Πανελλήνιο Ιατρικό Συνέδριο, Αθήνα, 17-21.5.1994 (5 εργασίες).
-
Συμπόσιο «Νεοπλασματικές Παθήσεις Οισοφάγου- Στομάχου», Ιωάννινα, 27.5.1995 (1 εργασία).
-
1ο Πανελλήνιο Συνέδριο Παθήσεων Παχέος Εντέρου- Πρωκτού, υπό την αιγίδα του European Council of Coloproctology, Αθήνα 20-22.9.2002 (4 εργασίες)
-
19ο Πανελλήνιο Συνέδριο Ενόπλων Δυνάμεων, Θεσσαλονίκη 7-10.11.2002 (1 εργασία).
-
23ο Πανελλήνιο Χειρουργικό Συνέδριο Χειρουργικής- Διεθνές Χειρουργικό Φόρουμ 2002, Αθήνα 9-12.11.2002 (1 εργασία).
-
6ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής & International Symposium of Advanced Laparoendoscopic Surgery, Αθήνα 22-24.5.2003 (6 εργασίες).
-
1o Πανελλήνιο Συνέδριο Ελληνικής Εταιρείας Χειρουργικής Πεπτικού, Αθήνα 20-23.11.2003 (5 εργασίες).
-
9ο Πανελλήνιο Παθολογοανατομικό Συνέδριο, Καβάλα, 24-26.6.2004
(1 εργασία)
-
24ο Πανελλήνιο Συνέδριο Γαστρεντερολογίας, Αθήνα, 6-9.11.2004 (1 εργασία).
-
1o Πανελλήνιο Συνέδριο της Ελληνικής Εταιρείας Χειρουργικής Παχέος εντέρου- Πρωκτού, Θεσσαλονίκη, 25-27.2.2005 (5 εργασίες)
-
2ο Ετήσιο Επιστημονικό Συνέδριο Ιατρικής Σχολής, Αθήνα, 20-22.5.2005 (1 εργασία)
-
1ο Πανελλήνιο Συνέδριο των Βασικών Ιατρικών Επιστημών, «Από την Εργαστηριακή Εξέταση στην Κλινική Εφαρμογή και Πράξη», Ίδρυμα Ευγενίδου, Αθήνα, 7-10/12/2005 (1 ομιλία)
-
4ο Πολυθεματικό Ιατρικό Συνέδριο Λακωνίας, Σπάρτη, 23-24.6.2006 (1 εργασία)
-
25ο Πανελλήνιο Συνέδριο Χειρουργικής, Διεθνές Χειρουργικό Φόρουμ 2006, Αθήνα, 22-26.11.2006 (2 εργασίες & συμμετοχή σε Μετεκπαιδευτικό Φροντιστήριο)
-
Επιστημονική Ημερίδα: «Τι νεότερο στις Παθήσεις Παχέος εντέρου- Πρωκτού», Αθήνα 16.12.2006 (1 ομιλία)
-
1ο Πανελλήνιο Συνέδριο & Ιnternational Symposium του Ελληνικού Κολλεγίου Χειρουργών, 9-12.3.2006 (πρόεδρος σε επιστημονική συνεδρία)
-
8ο Πανελλήνιο Συνέδριο Management υπηρεσιών Υγείας και Κοινωνικής Φροντίδας, Ερέτρια, 28-30.9.2006 (1 ομιλία)
-
2ο Πανελλήνιο Συνέδριο & Ιnternational Symposium του Ελληνικού Κολλεγίου Χειρουργών, 26-28.04.2007 (1 εργασία)
-
Πανελλήνιο Αντικαρκινικό Συνέδριο, Ελληνική Αντικαρκινική Εταιρεία, Αθήνα, 25.11-2.12.2007 (1 ομιλία)
-
4η Επιστημονική Ημερίδα Συλλόγου Καρκινοπαθών Εθελοντών Φίλων Ιατρών (ΚΕΦΙ) Αθηνών- Καρκίνος...Μπορεί να νικηθεί, Αθήνα 11.11.2007 (1 ομιλία)
-
1ο Πανελλήνιο Συνέδριο Εταιρείας Ιατρικών Σπουδών- «Τι νεότερο στην Ιατρική», Αθήνα, 21-22.3.2008 (1 ομιλία)
-
1η Επιστημονική Συνάντηση Ενδοσκοπικής Χειρουργικής μέσω Φυσικών Οπών (NOTES), Aθήνα, 28-29.3.2008 (1 ομιλία)
-
3ο Πανελλήνιο Συνέδριο & International Forum του Ελληνικού Κολλεγίου Χειρουργών, Αθήνα, 17-19.4.2008 (1 ομιλία)
-
3ο Πανελλήνιο Συνέδριο Ελληνικής Εταιρείας Χειρουργικής Πεπτικού (ΕΛΕΧΕΠ), Αθήνα, 4-6.4.2008 (2 ομιλίες, 1 πρόεδρος δορυφορικού συμποσίου)
-
Θέματα Αιχμής στη Σύγχρονη Ογκολογία- Σημερινές Απαντήσεις και Μελλοντικές Προοπτικές, Αθήνα, 17-18.10.2008 (1 ομιλία)
-
5η Επιστημονική Ημερίδα Συλλόγου Καρκινοπαθών Εθελοντών Φίλων Ιατρών (ΚΕΦΙ) Αθηνών- Καρκίνος...Μπορεί να νικηθεί, Αθήνα 2.11.2008 (1 πρόεδρος διάλεξης)
-
26ο Πανελλήνιο Συνέδριο Χειρουργικής- Διεθνές Χειρουργικό Φόρουμ 2008, Αθήνα, 12-15.11.2008 (1 ομιλία, 7εργασίες)
-
3ο Πανελλήνιο Συνέδριο Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου-Πρωκτού, Αθήνα 15-17.5.2009 (1 ομιλία, 7εργασίες)
-
Θέματα Αιχμής στη Σύγχρονη Ογκολογία- Σημερινές Απαντήσεις και Μελλοντικές Προοπτικές, Αθήνα, 9-10.10.2009 (1 ομιλία)
-
9ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής και Διεθνές Συμπόσιου, Αθήνα, 21-23.5.2009 (1 πρόεδρος στρογγυλής τράπεζας, 1 συμμετοχή ως εκπαιδευτής σε κλινικό σεμινάριο με πρακτική άσκηση- workshop)
-
29ο Πανελλήνιο Συνέδριο Γαστρεντερολογίας, Χαλκιδική, 15-18.10.2009 (1 ομιλία)
-
XXXVI Congress of European Society of Lymphology, Αθήνα 14-16.5.2010 (1 πρόεδρος στρογγυλής τράπεζας)
-
Εκπαιδευτική Πρωκτολογική Ημερίδα, Αθήνα, 16.10.2010 (1 εισήγηση)
-
27ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2010, Αθήνα, 24-27.11.2010 (1 πρόεδρος σε συνεδρία ελεύθερων ανακοινώσεων, 1 μέλος επιτροπής αξιολόγησης εργασιών, 1 εκπαιδευτής σε μετεκπαιδευτικό φροντιστήριο, 20 εργασίες)
-
Εκπαιδευτική Ημερίδα του Πρωκτολογικού Τμήματος της Ελληνικής Γαστρεντερολογικής Εταιρείας, Αθήνα, 16.10.2010 (1 εισήγηση)
-
1η Ετήσια Διημερίδα Επιστημονικών Τμημάτων Ελληνικής Γαστρεντερολογικής Εταιρείας, Αθήνα, 17-18.06.2011 (1 εισήγηση)
-
4ο Μετεκπαιδευτικό Σεμινάριο της Εταιρείας Μελέτης Μεταστατικής Νόσου του Ήπατος, Βόλος, 18-19.02.2011 (1 εισήγηση)
-
2ο Πανελλήνιο Συνέδριο Χειρουργικής Κλινικής Ογκολογίας και Πρόληψης Καρκίνου στη Μακεδονία, Λιτόχωρο Πιερίας, 16-18.09.2011 (1 εισήγηση)
-
10ο Πανελλήνιο Συνέδριο Φλεγμονωδών Νοσημάτων του Εντέρου, Καλαμάτα, 27-29.05.2011 (1 εισήγηση)
-
28ο Πανελλήνιο Χειρουργικό Συνέδριο, Αθήνα, 21-24.11.2012 (Γενικός Γραμματέας, 1 μέλος επιτροπής αξιολόγησης εργασιών, 1 πρόεδρος στρογγυλής τράπεζας, 1 πρόεδρος σε συνεδρία βιντεοπροβολών, 3 πρόεδρος διαλέξεων, 1 συντονιστής σε μετεκπαιδευτικό φροντιστήριο, 1 εκπαιδευτής σε μετεκπαιδευτικό φροντιστήριο, 3 ομιλίες, 2 σχολιασμός σε στρογγυλές τράπεζες, 25 εργασίες)
-
16ο Παγκρήτιο Ιατρικό Συνέδριο, Αγ. Νικόλαος, 25-28.10.2012 (1 ομιλία)
-
9ο Πανελλήνιο Συνέδριο Δεικτών Καρκίνου & Στοχευμένης Θεραπείας, Αθήνα, 29.11-1.12.2012 (1 ομιλία)
-
Εκπαιδευτική Ημερίδα «Στομίες: Τεχνικές-Προκλήσεις-Φροντίδα», Αθήνα, 19.01.2013 (Οργανωτής, 2 ομιλίες)
-
7ο Μετεκπαιδευτικό Σεμινάριο της Εταιρείας Μελέτης Μεταστατικής Νόσου του Ήπατος, Ναύπλιο, 21-22.02.2014 (1 σχολιασμός σε στρογγυλή τράπεζα)
-
1ο Εκπαιδευτικό Σεμινάριο Εταιρείας Μελέτης του Καρκίνου του Πεπτικού Συστήματος (ΕΜ-ΚΑΠΕΣ), Θεσσαλονίκη, 22-24.11.2013 (1 συντονιστής σε στρογγυλή τράπεζα)
-
2ο Εκπαιδευτικό Σεμινάριο Εταιρείας Μελέτης του Καρκίνου του Πεπτικού Συστήματος (ΕΜ-ΚΑΠΕΣ), Θεσσαλονίκη, 24-26.10.2014, 25.10.2014 (1 συντονιστής σε στρογγυλή τράπεζα)
-
6th International meeting- Colorectal games, Aθήνα, 13-14.06.2014 (1 πρόεδρος στρογγυλής τράπεζας)
-
Μετεκπαιδευτικό Σεμινάριο Λαπαροσκοπικής Χειρουργικής Κατώτερου Πεπτικού 2014, Αθήνα, 7-8.11.2014 (1 εισήγηση)
-
29ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2014, Αθήνα, 12-16.11.2014 (Γενικός Γραμματέας, 1 μέλος επιτροπής αξιολόγησης εργασιών, 2 πρόεδρος στρογγυλής τράπεζας, 1 πρόεδρος ομιλίας, 1 ομιλία, 1 συντονιστής μετεκπαιδευτικού φροντιστηρίου, 2 ομιλητής σε μετεκπαιδευτικό φροντιστήριο, 21 εργασίες)
-
Πανελλήνιες Εκπαιδευτικές ημερίδες πρωτοβάθμιας φροντίδας υγείας «Γ. Παπαδάκης», Αθήνα, 9-13.02.2015 (1 ομιλία)
-
11ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής, Αθήνα, 8-10.05.2015 (1 ομιλία)
-
14ο Πανελλήνιο Συνέδριο Χειρουργικών Λοιμώξεων, Ηράκλειο Κρήτης, 29.04-01.05.2015 (1 ομιλία)
-
35ο Πανελλήνιο Συνέδριο Γαστρεντερολογίας, Καλαμάτα, 8-11.10.2015 (1 ομιλία, 3 εργασίες)
-
7η Σύνοδος της Ελληνικής ΗPV Εταιρείας, Θεσσαλονίκή, 26.02.2016 (1 ομιλία, 1 πρόεδρος εκπαιδευτικού σεμιναρίου, 2 ομιλίες σε εκαπιδευτικό σεμινάριο)
-
30ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2016, Θεσσαλονίκη 09-12.11.2016 (Ειδικός Γραμματέας, 2 ομιλίες, 2 πρόεδρος στρογγυλής τράπεζας, 11 εργασίες)
-
1η Ημερίδα της Μονάδας Παχέος Εντέρου και Πρωκτού «Φλεγμονώδεις νόσοι του εντέρου», Αθήνα 28.04.2018 (Συντονιστής, 1 ομιλία, 1 πρόεδρος στρογγυλής τράπεζας)
-
6ο Πανελλήνιο Συνέδριο της Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου και Πρωκτού, Αθήνα 31.03-2.04.2016 (1 συντονιστής φροντιστηριακού μαθήματος, 1 ομιλία, 1 πρόεδρος στρογγυλής τράπεζας)
-
3ο Πανελλήνιο Λεμφολογικό Συνέδριο, Αμφιθέατρο του Ιπποκρατείου Νοσοκομείου Αθηνών, Αθήνα, 03-04.06.2016 (1 ομιλία)
-
15ο Πανελλήνιο Συνέδριο Ιδιοπαθών Φλεγμονωδών Νοσημάτων του Εντέρου, Ιωάννινα, 03-05.06.2016 (1 ομιλία)
-
3ο Πανελλήνιο Συνέδριο Γενικής Χειρουργικής, Βόλος, 10-12.06.2016 (1 ομιλία)
-
1ο Διεταιρικό Επιστημονικό Συμπόσιο Χειρουργικής Ογκολογίας «Από τη σύγχρονη Τεχνολογία στην έγκαιρη Διάγνωση και Θεραπεία», Λιβαδειά, 16-18.09.2016 (1 πρόεδρος στρογγυλής τράπεζας)
-
7ο Πανελλήνιο Συνέδριο Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου – Πρωκτού, Λάρισα 15-17.12.2017 (1 ομιλία, 1 πρόεδρος στρογγυλής τράπεζας, 5 εργασίες)
-
Πανελλήνιες Εκπαιδευτικές Ημερίδες Πρωτοβάθμιας Φροντίδας Υγείας «Γ. Παπαδάκης», Αθήνα, 13-17.02.2017 (1 ομιλία)
-
15ο Πανελλήνιο Συνέδριο Χειρουργικών Λοιμώξεων, Αθήνα 10-12.11.2017 (1 ομιλία)
-
Ετήσια Ημερίδα Επιστημονικών Τμημάτων Ελληνικής Γαστρεντερολογικής Εταιρείας, Αθήνα 04.04.2015 (1 ομιλία)
-
13ο Συνέδριο της Χειρουργικής Εταιρείας Βορείου Ελλάδος "Σύγχρονη Τεχνολογία & Χειρουργική Εκπαίδευση", Θεσσαλονίκη 03-05.11.2017 (1 ομιλία)
-
12ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής, Αθήνα 29.09-01.10.2017 (1 ομιλία)
-
2ο Επιστημονικό Forum: Ογκολογία Quo Vadis, Ναύπλιο, 29.09–01.10.2017 (1 ομιλία)
-
17ο Πανελλήνιο Συνέδριο Ιδιοπαθών Φλεγμονωδών Νόσων του Εντέρου, Θεσσαλονίκη, 18-20.05.2018 (1 ομιλία, 1 εργασία)
-
38ο Πανελλήνιο Συνέδριο Γαστρεντερολογίας, Αθήνα 06-09.12.2018 (1 ομιλία, 4 εργασίες)
-
Ημερίδα της Ελληνικής Αντικαρκινικής Εταιρείας «Ενημερώνομαι και προλαμβαίνω: Καρκίνος παχέος εντέρου & Καρκίνος προστάτη», Στυλίδα, 28.11.2018 (1 ομιλία)
-
Συνέδριο του Ινστιτούτου Βιοϊατρικών Επιστημών «ΑΘΗΝΑ» με τίτλο «Σύγχρονη Δυτική και Ιπποκρατική ιατρική πρακτική. Εξατομικευμένη – στοχευμένη θεραπεία των νεοπλασμάτων», Αθήνα 11-12.05.2018 (1 ομιλία)
-
Πανελλήνιο Συνέδριο «Από τη Χημειοθεραπεία στη Μοριακή Στόχευση – Η εξέλιξη στην αντινεοπλασματική θεραπεία», Αθήνα 07-09.12.2018 (1 ομιλία)
-
3η επιστημονική εκδήλωση με θέμα: Τεχνικές “Ελάχιστης Παρέμβασης” στην Αντιμετώπιση Παθήσεων Ανώτερου και Κατώτερου Πεπτικού, Θεσσαλονίκη 26.05.2018 (1 ομιλία)
-
27ο Ιατρικό Συνέδριο Ενόπλων Δυνάμεων, Θεσσαλονίκη 18-20.10.2018 (1 ομιλία)
-
2ο Συνέδριο Φοιτητών Ιατρικών Σχολών, Πάτρα 23-25.03.2018 (1 ομιλία)
-
31ο Πανελλήνιο Χειρουργικό Συνέδριο και Χειρουργικό Φόρουμ 2018, Αθήνα 21-21.11.2018 (1 ομιλία, 2 πρόεδρος στρογγυλής τράπεζας, 1 συντονιστής μετεκπαιδευτικού φροντιστηρίου, 3 εκπαιδευτικές εισηγήσεις σε 2 μετεκπαιδευτικά φροντιστήρια, 19 εργασίες)
-
2η Ημερίδα της Μονάδας Παχέος Εντέρου και Πρωκτού «Ορθοκολικός Καρκίνος- Προκλήσεις και Διλήμματα»», Αθήνα 16.03.2019 (Συντονιστής)
-
14ο Πανελλήνιο Συνέδριο της Ελληνικής Εταιρείας Χειρουργικής Ογκολογίας, Αθήνα, 31.10-03.11.2019 (1 ομιλία, 1 εργασία)
-
Πανελλήνιο Συνέδριο της Ελληνικής και Διεθνούς Εταιρείας Μοριακά Στοχευμένων & Εξατομικευμένων Θεραπειών, Βόλος 22-24.03.2019 (1 πρόεδρος στρογγυλής τράπεζας)
-
Πανελλήνιες Εκπαιδευτικές Ημερίδες Πρωτοβάθμιας Φροντίδας Υγείας «Γ. Παπαδάκης», Αθήνα, 11-15.02.2019 (1 ομιλία)
-
13ο Πανελλήνιο Συνέδριο Λαπαροενδοσκοπικής Χειρουργικής και 11ο Πανελλήνιο Συνέδριο Χειρουργικής της Παχυσαρκίας, Αθήνα 12-14.04.2019 (Mέλος Επιστημονικής Επιτροπής, 1 ομιλία, 2 ανακοινώσεις)
-
3ο Πολυθεματικό Επιστημονικό Συνέδριο ΚΑΤ, 28-30.11.2019 (1 πρόεδρος στρογγυλής τράπεζας)
-
1η Ημερίδα Χειρουργικής με θέμα «Επείγουσα Χειρουργική – Πρόληψη και σύγχρονες αρχές αντιμετώπισης του καρκίνου», Σπάρτη, 21.09.2019 (1 ομιλία)
-
1ο Πανελλήνιο Συνέδριο Κολοπρωκτολογίας: Τεκμηριωμένη γνώση- Εξατομικευμένη προσέγγιση, Αθήνα, , 23-25.01.2020 (Πρόεδρος συνεδρίου, 1 πρόεδρος στρογγυλής τράπεζας, 6 εργασίες)
Δ2. ΔΙΕΘΝΗ ΣΥΝΕΔΡΙΑ
-
3rd International Conference of the Mediterranean Society of Tumor Marker Oncology (MESTMO), Athens, 26-29.10.1994 (2 εργασίες)
-
19th Congress of the European Society for Medical Oncology, Lisbon-Portugal, Athens, 11.1994 (1 εργασία)
-
49th Annual Meeting of the Society of Surgical Oncology, Atlanta, USA, 21-24.3.1996 (1 εργασία)
-
New Jersey Chapter of the American College of Surgeons, 44th Annual Clinical Meeting, Robert Woοd Johnson Medical School, New Jersey-USA, 12.1995 (1 εργασία)
-
The New Jersey Society of Colon and Rectal Surgeons, New Jersey-USA, 2.1996 (1 εργασία)
-
10th International Congress on Senology-Breast Diseases, Portugal, 31.5-4.6.1998 (1 εργασία)
-
American College of Surgeosn, 84th Annual Clinical Congress, Orlando, Florida, USA, 10.1998 (1 εργασία)
-
American College of Surgeons, Michigan Chapter, 47th Annual Meeting, Traverse City, Michigan, USA, 5.2000 (1 εργασία)
-
Midwest Surgical Association Meeting, Maekinak Island, Michigan, USA, 8.2000 (1 εργασία)
-
Columbus Surgical Society, 12th Annual Presidential Symposium, Columbus, Ohio, USA, 3.3.2001 (1 εργασία)
-
American College of Surgeons, Michigan Chapter, 46th Annual Meeting, Dayton, Ohio, USA, 11.5.2001 (1 εργασία)
-
Annual Meeting of American Society of Colon and Rectal Surgeons, San Diego, California, USA, 2-7.6.2001 (1 εργασία)
-
9th Congress of the European Council of Coloproctology, Athens, 31.5-4.6.2003 (1 εργασία)
14. XXXIX Congress of the European Society for Surgical Research, Athens, 12- 15.5.2004 (1 εργασία)
15. 13th International Congress of the EAES, Venice, Italy, 1-4.6.2005 (3 εργασίες)
16. 20th European Congress of Pathology, Paris, France, 3-8. 9. 2005 (2 εργασίες)
17. 10ο Παγκύπριο Χειρουργικό Συνέδριο, Λευκωσία, Κύπρος, 21-22.10.2006 (2 ομιλίες)
18. 1ο Διεθνές Συμπόσιο για τις Προοπτικές της Ποιότητας Ζωής των Ασθενών-Απαρτιωμένη Προσέγγιση στις Μεταμοσχεύσεις Οργάνων, στη Χειρουργική Ογκολογία & Ογκολογία στη Νοτιο-Ανατολική Ευρώπη, Σμύρνη, Τουρκία, 5-8.5.2006 (1 ομιλία)
19. 15th International Congress of the European Association for Endoscopic Surgery (EAES), Athens, 4-7.7.2007 (1 ομιλία, 2 πρόεδρος στρογγυλής τράπεζας, 1 πρόεδρος συνεδρίας ανακοινώσεων)
20. 7th Mediterranean & Middle Eastern Endoscopic Surgery (MMESA), El-Gouna Hurghada- Egypt, 2-5.12.2007(1 ομιλία, 1 πρόεδρος στρογγυλής τράπεζας)
-
American Society of Colorectal Surgery (ASCRS) Annual Meeting and Tripartite Meeting, Boston, MA, USA, 7-11.6.2008 (1 εργασία)
-
3rd International Symposium “Colorectal Games”, Ρέθυμνο, Κρήτη, 16-17.10.2008 (1 εργασία)
-
8th International Conference of Anticancer Research, Kos, Greece, 17-22.10.2008 (1 ομιλία, 3 εργασίες, 1 πρόεδρος στρογγυλής τράπεζας)
-
16th International congress of the European Association for Endoscopic Surgery (EAES), Stockholm, Sweden, 11-14.6.2008 (4 εργασίες)
-
Τhe 5th International Infection Control Conference of Theodor Bilharz Research Institute (TRBI) and the 3rd Egyptian-Greek Training Course on “Intensive Care Skills and Associated Infection Control Protocols”, Cairo, Egypt, 2-5.3.2009 (4 ομιλίες, πρόεδρος σε επιστημονικές συνεδρίες)
-
New European Surgical Academy (NESA) Congress 2009, Athens, 28- 30.5.2009 (1 ομιλία)
-
17th International Congress of the European Association for Endoscopic Surgery (EAES), Prague, 17-20.6.2009 (3 εργασίες)
-
9o EλλαδοΚυπριακό Χειρουργικό Συνέδριο, Λευκωσία, 30.10-1.11.2009 (1 ομιλία)
-
1st International Conference on Molecular Cancer Research, Athens, 28-30.11.2009 (2 εργασίες)
-
European Colorectal Congress 2009, Benign Colorectal Diseases, St Gallen, Switzerland, 2-4.12.2009 (1 εργασία)
-
European Colorectal Congress 2010, Metastasis-Complications, St Gallen, Switzerland, 1-3.12.2010 (3 εργασίες)
-
10ο Ελλαδο-Κυπριακό Συνέδριο, Λευκωσία, 18-20.11.2011 (1 πρόεδρος σε στρογγυλή τράπεζα)
-
American Society of Colon & Rectal Surgeons Annual Meeting 2011, Vancouver, Canada, 24-18.05.2011 (2 εργασίες)
-
6th International Congress of Laparoscopic Colorectal Surgery, Anglia Ruskin University, Chelmsford, UK, 5-7.09.2011 (3 εργασίες)
-
Falk Symposium 2012- Carcinogenesis, Prevention and Treatment of Colorectal Cancer-State-of-the-Art, Munich, Germany, 10-11.02.2012 (2 εργασίες)
-
European Colorectal Congress 2011, What’s New in Rectal Cancer, St Gallen, Switzerland, 29.11-2.12.2014 (5 εργασίες)
-
American Society of Colon & Rectal Surgeons Annual Meeting 2013, Phoenix, Arizona, USA, 27.04-01.05.2013 (2 εργασίες)
-
American Society of Colon & Rectal Surgeons Annual Meeting 2014, Hollywood, Florida, USA, 17-21.05.2014 (1 εργασία)
-
AOGQ 4th International Symposium/MSRM/NESA Days 2014, Ag. Nikolaos, Crete, 19-21.09.2014 (1 εισήγηση)
-
Falk Symposium 196- Critical Evaluation of Current Concepts and Moving to New Horizons in the Management of IBD, Frankfurt, Germany, 06-07.03.2015 (1 εργασία)
-
International Conference on Cytokine Signalling, Chania, Crete, Greece, 24-29.05.2015 (1 εργασία)
-
24th International Congress of European Association of Endoscopic Surgery (EAES), Amsterdam, The Netherlands, 15-18.06.2016 (1 εργασία)
-
EUROPEAN COLORECTAL CONGRESS Spotlight on the rectum, St.Gallen, Switzerland, 03-07.12.2017 (1 εργασία)
-
13ο Ελλαδο-Κυπριακό Συνέδριο, Λεμεσός, Κύπρος, 23-25. 11.2017 (Μέλος Οργανωτικής Επιτροπής, 1 ομιλία)
-
European Society of Coloproctology 13th Scientific and Annual Meeting, Nice, France, 26-28.09.2018 (1 εργασία)
-
11th Biennial Congress of the Mediterranean Society of Coloproctology, Thessaloniki, Greece, 04-05.05.2018 (1 ομιλία)
-
“Advances and Perspectives in Gastrointestinal Oncology”, Αthens, 15-17.03.2018 (1 ομιλία)
-
27th International Congress of European Association of Endoscopic Surgery (EAES), Seville, Spain, 12-15.06.2019 (2 πρόεδρος στρογγυλής τράπεζας)
-
7th International Multithematic Scientific Bio-Medical Congress, European University of Cyprous, 7-9.11.2019 (1 εργασία)
-
Colorectal Masterclass “Current trends in minimally invasive colorectal surgery”, Tirana, Albania, 23.11.2019 (1 ομιλία)
-
Τhe International Colorectal Disease Symposium (Cleveland Clinic Florida)- Joint with the Annual Meeting of the Israel Society of Colon and Rectal Surgery, Jerusalem, Israel, 25-28.01.2020 (Μέλος οργανωτικής επιτροπής, 1 πρόεδρος στρογγυλής τράπεζας, 1 εργασία)

-
Δεκέμβριος 2001-Ιούλιος 2002: Συμβολή στην οργάνωση και λειτουργία χειρουργείου στο Στρατιωτικό Νοσοκομείο Σάμου (79 ΤΥΕΘ)
-
Οκτώβριος 2007- Φεβρουάριος 2013: Στα ακαδημαϊκά πλαίσια εκπόνησης διδακτορικών διατριβών που αφορούν στη μετεγχειρητική Ποιότητα Ζωής ασθενών, οργάνωση Ιατρείου παρακολούθησης ασθενών με κύριο στόχο την επιτήρηση της ογκολογικής θεραπείας, την παρακολούθηση των ασθενών με ορθοκολικό καρκίνο και την αξιολόγηση της σχετιζόμενης με την υγεία ποιότητας ζωής των ασθενών που έχουν υποβληθεί σε κολεκτομή για καλοήθη ή κακοήθη παθολογία του παχέος εντέρου
-
2009-2010: Υπεύθυνος Τμήματος Παχέος Εντέρου της Ελληνικής Χειρουργικής Εταιρείας μαζί με τους κους: Κομπορόζο Β, Παπασταματίου Μ, Τούτουζα Κ.
-
2011-2012: Συμμετοχή ως μέλος στη Δευτεροβάθμια Ειδική Υγειονομική Επιτροπή, αρμόδια για τη γνωμοδότηση επί θεμάτων νοσηλείας στο εξωτερικό ασθενών ασφαλισμένων ασφαλιστικών οργανισμών, αρμοδιότητας Γενικής Γραμματείας Κοινωνικών Ασφαλίσεων (Γ.Γ.Κ.Α.)
-
Γενικός Γραμματέας (μαζί με τους κους Κ. Αλεξίου, Γ. Σγουράκη) του 28ου Πανελληνίου Χειρουργικού Συνεδρίου και Χειρουργικού Φόρουμ 2012, Αθήνα, 21-24.11.2012
-
Στα πλαίσια του 28ου Πανελληνίου Χειρουργικού Συνεδρίου και Χειρουργικού Φόρουμ 2012, οργανωτής (μαζί με τον Καθηγητή κο Δ. Λινό) του Μετεκπαιδευτικού Φροντιστηρίου με τίτλο: «Καρκίνος ορθού» (Αθήνα, 21.11.2012)
-
Διοργάνωση της Ημερίδας «Στομίες: Τεχνικές-Προκλήσεις-Φροντίδα», που διοργανώθηκε από την Hollister (Συνεργαζόμενος Επιστημονικός Φορέας: Α΄ Προπαιδευτική Χειρουργική Κλινική Ιατρικής Σχολής ΕΚΠΑ) Αθήνα, 19.01.2013
-
Γενικός Γραμματέας (μαζί με τους κους Κ. Τούτουζα, Ν. Ρουκουνάκη) του 29ου Πανελληνίου Χειρουργικού Συνεδρίου και Χειρουργικού Φόρουμ 2014, Αθήνα, 12-15.11.2014
-
Μέλος του Επαγγελματικού Συμβουλίου της Ελληνικής Χειρουργικής Εταιρείας για τα έτη 2013 και 2014
-
Στα πλαίσια του 29ου Πανελληνίου Χειρουργικού Συνεδρίου και Χειρουργικού Φόρουμ 2014, διοργάνωση και συντονισμός (μαζί με τον κο S. Papagrigoriadis) του Μετεκπαιδευτικού Φροντιστηρίου με τίτλο: «Ελάχιστα Επεμβατικές Τεχνικές στη Χειρουργική του Παχέος Εντέρου» (Αθήνα, 14.11.2014)
-
2013- : Υπεύθυνος του Τμήματος Παχέος Εντέρου & Φλεγμονωδών Νόσων της Α΄ Προπαιδευτικής Χειρουργικής Κλινικής Ιατρικής Σχολής ΕΚΠΑ (Διευθυντής: Καθηγητής Γ. Ζωγράφος)
-
Μέλος του Εκπαιδευτικού Συμβουλίου της Ελληνικής Χειρουργικής Εταιρείας για τα έτη 2015-2020
-
Ειδικός Γραμματέας (μαζί με τους κους Ε. De Bree και Δ. Μαγγανά) του 6ου Πανελληνίου Συνεδρίου της Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου και Πρωκτού, Αθήνα 31.03-2.04.2016
-
Ειδικός Γραμματέας του 30ου Πανελληνίου Χειρουργικού Συνεδρίου και Χειρουργικού Φόρουμ 2016, Θεσσαλονίκη 09-12.11.2016
-
Στα πλαίσια των τακτικών Μαθημάτων/Ημερίδων που οργανώνονται από το Εκπαιδευτικό Συμβούλιο της Ελληνικής Χειρουργικής Εταιρείας, συντονιστής (μαζί με τον κο Β. Κομπορόζο) της 4ης Εκπαιδευτικής Ημερίδας για το Ακαδημαϊκό έτος 2015-16 (Αθήνα, Ιπποκράτειο Νοσοκομείο, 16.04.2016) με θέμα: «Παθήσεις Παχέος Εντέρου»
-
2015- : Οργάνωση λειτουργίας και υπεύθυνος (με τον Αναπλ. Καθηγητή Παθολογίας Σ. Μανωλακόπουλο και την Επιμελήτρια Α΄ Ακτινοδιαγνωστικού Εργαστηρίου Ιπποκρατείου Νοσοκομείου Α. Μήκα) «Μονάδας Μελέτης Κατώτερου Πεπτικού» στο Ιπποκράτειο Νοσοκομείο Αθηνών (έγκριση Επιστημονικού Συμβουλίου 59/30-10-2014 και Διοικητικού Συμβουλίου, Απόφαση 23/18-6-2015), με στόχο τη θεμελίωση ομάδας πολυπαραγοντικής προσέγγισης ειδικών παθήσεων παχέος εντέρου (π.χ. Φλεγμονώδεις Νόσοι του Εντέρου) και την ενσωμάτωση ειδικών απεικονιστικών εξετάσεων (π.χ. αξονική κολονογραφία, αξονική εντερογραφία)
-
Στο πλαίσιο των εκπαιδευτικών δραστηριοτήτων της Μονάδας Μελέτης του Κατώτερου Πεπτικού του Γ.Ν.Α. Ιπποκρατείου και ως υπεύθυνος της Μονάδας Παχέος Εντέρου της Α΄ Προπαιδευτικής Χειρουργικής Κλινικής ΕΚΠΑ, συντονισμός και διοργάνωση της 1ης Ημερίδας ττης Μονάδας Παχέος Εντέρου και Πρωκτού: «Φλεγμονώδεις Νόσοι του Εντέρου», Αμφιθέατρο Γ.Ν.Α. Ιπποκρατείου, Αθήνα 21.04.2018
-
Στο πλαίσιο των εκπαιδευτικών δραστηριοτήτων της Μονάδας Μελέτης του Κατώτερου Πεπτικού του Γ.Ν.Α. Ιπποκρατείου και ως υπεύθυνος της Μονάδας Παχέος Εντέρου της Α΄ Προπαιδευτικής Χειρουργικής Κλινικής ΕΚΠΑ, συντονισμός και διοργάνωση της 2ης Ημερίδας της Μονάδας Παχέος Εντέρου και Πρωκτού: «Ορθοκολικός καρκίνος- Προκλήσεις και Διλήμματα», Αμφιθέατρο Γ.Ν.Α. Ιπποκρατείου, Αθήνα 16.03.2019
-
Στα πλαίσια του 6ου Πανελλήνιου Συνεδρίου της Ελληνικής Εταιρείας Χειρουργικής Παχέος Εντέρου και Πρωκτού, διοργάνωση, σε συνεργασία με το Εκπαιδευτικό Συμβούλιο της ΕΧΕ, φροντιστηριακού μαθήματος με τίτλο: «Λαπαροσκοπική Κολεκτομή: Τεχνική από το Α έως το Ω», Αθήνα 31.03-2.04.2016
-
Συντονιστής του 9ου Μετεκπαιδευτικού Σεμιναρίου Λαπαροσκοπικής Χειρουργικής Κατώτερου Πεπτικού (Συνδιοργάνωση Εκπαιδευτικό Συμβούλιο Ελληνικής Χειρουργικής Εταιρείας με το Ερευνητικό και Πειραματικό Κέντρο ELPEN) (Αθήνα 20-21.10.2017)
-
Συντονιστής (μαζί με τον Καθηγητή κο Κ. Τεπετέ) της 7ης Διήμερης Συνεδρίας ΕΧΕ 2018 με θέμα «Οξεία κοιλία», στα πλαίσια του 33ου Ετήσιου Κύκλου Μετεκπαιδευτικών Μαθημάτων ΕΧΕ (Συνδιοργάνωση Εκπαιδευτικό Συμβούλιο Ελληνικής Χειρουργικής Εταιρείας με την Πανεπιστημιακή Χειρουργική Κλινική του Πανεπιστημίου Θεσσαλίας), Λάρισα 05-06.10.2017
-
Στα πλαίσια του 31ου Πανελληνίου Χειρουργικού Συνεδρίου και Χειρουργικού Φόρουμ 2018, διοργάνωση και συντονισμός (μαζί με τους κους Β. Κομπορόζο και Ι. Γαλάνη) του Μετεκπαιδευτικού Φροντιστηρίου με τίτλο: «Αναστομώσεις στη Χειρουργική του παχέος εντέρου: Τεχνικές - Επιπλοκές», Αθήνα 21-24.11.2018
-
Συντονιστής του 10ου Μετεκπαιδευτικού Σεμιναρίου Λαπαροσκοπικής Χειρουργικής Κατώτερου Πεπτικού (Συνδιοργάνωση Εκπαιδευτικό Συμβούλιο Ελληνικής Χειρουργικής Εταιρείας με το Ερευνητικό και Πειραματικό Κέντρο ELPEN) (Αθήνα 22-23.07.2019)
-
Συντονιστής (μαζί με τον Καθηγητή κο Γ. Τζοβάρα) της 6ης Πολυθεματικής Διημερίδας ΕΧΕ 2019 (Συνδιοργάνωση Εκπαιδευτικό Συμβούλιο Ελληνικής Χειρουργικής Εταιρείας με την Πανεπιστημιακή Χειρουργική Κλινική του Πανεπιστημίου Θεσσαλίας Ερευνητικό και Πειραματικό Κέντρο ELPEN), 11-12.10.2019
-
Συντονιστής του 11ου Μετεκπαιδευτικού Σεμιναρίου Λαπαροσκοπικής Χειρουργικής Κατώτερου Πεπτικού (Συνδιοργάνωση Εκπαιδευτικό Συμβούλιο Ελληνικής Χειρουργικής Εταιρείας με το Ερευνητικό και Πειραματικό Κέντρο ELPEN) (Αθήνα 12-13.07.2019)
-
Πρόεδρος (μαζί με τον κο Β. Κομπορόζο) του «1ου Συνεδρίου Κολοπρωκτολογίας: Τεκμηριωμένη γνώση - εξατομικευμένη προσέγγιση» της Ελληνικής Εταιρείας Κολοπρωκτολογίας, της οποίας αποτέλεσα ιδρυτικό μέλος και διατελώ Αντιπρόεδρος, Αθήνα 23-25.01.2020