Κακοήθης πολύποδας παχέος εντέρου- Θεραπευτική στρατηγική
Κακοήθης ορίζεται ο αδενωματώδης πολύποδας ο οποίος περιέχει καρκινικά κύτταρα που διηθούν την υποβλεννογόνια μυϊκή στιβάδα, με την καρκινική διήθηση να περιορίζεται στον υποβλεννογόνιο χιτώνα (pT1 ή Τ1ΝxMx σύμφωνα με το σύστημα ΤΝΜ). Αποτελούν το 2-12% των κολονοσκοπικά αφαιρεθέντων πολυπόδων (1). Ο κίνδυνος παρουσίας κακοήθειας σε ένα αδενωματώδη πολύποδα σχετίζεται με το μέγεθος του πολύποδα και συγκεκριμένα για μέγεθος 0,6-1,5 εκ είναι 2%, 1,6-2,5 εκ 19%, 2,6-3,5 εκ 43% και >3,5 εκ 76% (2, 3). Η κλινική απόφαση για την αναγκαιότητα διενέργειας κολεκτομής και η ογκολογική επάρκεια και ασφάλεια της της ενδοσκοπικής πολυποδεκτομής καθορίζονται από τα χαρακτηριστικά, τη βιολογική συμπεριφορά του κακοήθους πολύποδα, τον κίνδυνο ύπαρξης συνοδών λεμφαδενικών μεταστάσεων και από τη γενική κατάσταση του ασθενούς (2, 3). Ο κύριος παράγοντας παρουσίας λεμφαγγειακής διασποράς αποτελεί το βάθος διήθησης των καρκινικών κυττάρων εντός του πολύποδα. Η ταξινόμηση κατά Haggitt (Εικόνα 1) βασίζεται στο επίπεδο διήθησης (4):
• Επίπεδο 0: Χωρίς διήθηση, βαρειά δυσπλασία
• Επίπεδο 1: Το καρκίνωμα διηθεί διά της υποβλεννογονίου μυϊκής στιβάδας, αλλά περιορίζεται στην κεφαλή του έμμισχου πολύποδα
• Επίπεδο 2: Το καρκίνωμα διηθεί έως τον αυχένα, το όριο μεταξύ της κεφαλής και του μίσχου του έμμισχου πολύποδα
• Επίπεδο 3: Το καρκίνωμα διηθεί το μίσχο του έμμισχου πολύποδα
• Επίπεδο 4: Το καρκίνωμα διηθεί τον υποβλεννογόνιο χιτώνα του εντέρου κάτω από το μίσχο του έμμισχου πολύποδα. Όλοι οι κακοήθεις άμισχοι αδενωματώδεις πολύποδες είναι επιπέδου 4 κατά Haggitt.
O Κudo ταξινόμησε περαιτέρω το βάθος της υποβλεννογόνιας διήθησης ως ακολούθως(5):
• SM1: Διήθηση έως το ανώτερο 1/3 του υποβλεννογονίου χιτώνα
• SM2: Διήθηση έως και το μέσο 1/3 του υποβλεννογονίου χιτώνα
• SM3: Διήθηση έως και το κατώτερο 1/3 του υποβλεννογονίου χιτώνα
Τα επίπεδα 1, 2 και 3 κατά Haggitt είναι SM1, ενώ το επίπεδο 4 κατά Haggitt μπορεί να είναι SM1, SM2 ή SM3.
Ο κίνδυνος λεμφαδενικών μεταστάσεων είναι <1% για έμμισχους κακοήθεις πολύποδες με επίπεδο διήθησης κατά Haggitt 1, 2 και 3, ενώ για τα αδενώματα με επίπεδο 4 κατά Haggitt, έμμισχα ή άμισχα, ο κίνδυνος αυτός κυμαίνεται σε 12 έως 25% (6, 7). Παράγοντες που σχετίζονται με αυξημένο κίνδυνο λεμφαγγειακής διασποράς περιλαμβάνουν την παρουσία λεμφαγγειακής διήθησης εντός του νεοπλάσματος, η χαμηλή διαφοροποίηση, η μικροκυψελιδική αρχιτεκτονική, οι επίπεδοι (flat) και υπεσκαμμένοι (depressed) πολύποδες και το επίπεδο διήθησης SM3 (8, 9, 10).
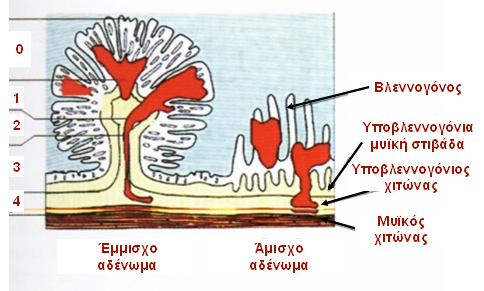
Εικόνα 1. Ταξινόμηση κατά Haggitt
Κατά την ενδοσκοπική αφαίρεση ευμεγέθων, άμισχων ή πολυπόδων με ύποπτα για εξαλλαγή μακροσκοπικά χαρακτηριστικά, ειδικά δε αν θεωρείται πιθανά ατελής η ενδοσκοπική εκτομή τους, συστήνεται η υποβλεννογόνια χορήγηση χρωστικής ουσίας, όπως η ινδική μελάνη, η οποία προσδίδει μόνιμη χρώση που αναγνωρίζεται εύκολα από την ορογονική πλευρά του εντερικού τοιχώματος κατά τη διάρκεια της χειρουργικής διερεύνησης, εφόσον αυτή απαιτηθεί. Σε περίπτωση ανεύρεσης κακοήθους πολύποδα που απαιτεί περαιτέρω χειρουργική εκτομή, σύμφωνα με τα κριτήρια που αναλύονται παρακάτω, η σήμανση της θέσης της ενδοσκοπικής πολυποδεκτομής με σινική μελάνη πρέπει να διενεργείται εντός 2 εβδομάδων από το χρόνο της κολονοσκοπικής αφαίρεσης, εφόσον, βέβαια, τούτο δεν είχε λάβει χώρα τη στιγμή της αρχικής ενδοσκοπικής αφαίρεσης.
Σύμφωνα με τις συστάσεις του Nivatvongs (Surg Clin North Am, 2000) και τις κατευθητήριες οδηγίες του National Comprehensive Cancer Network (NCCN) του 2009, οι οποίες και συνιστούν συστάσεις κατηγορίας 2Α, η ενδοσκοπική αφαίρεση ενός κακοήθους πολύποδα ως ολόκληρο, αδιάσπαστο παρασκεύασμα, με υγιή όρια εκτομής και με «ευνοϊκά» ιστολογικά χαρακτηριστικά, επαρκεί ογκολογικά και δεν χρήζει περαιτέρω χειρουργικής αφαίρεσης (3, 11). Η ενδοσκοπική επιτήρηση της θέσης της πολυποδεκτομής περιλαμβάνει της ενδοσκοπική παρακολούθησή της σε 2-3 μήνες και ακολούθως κάθε 6 μήνες για τα 2 πρώτα χρόνια. Πλήρης κολονοσκόπηση γίνεται στο 3ο έτος και, έπειτα, ανά 3ετία.
Εάν το παρασκεύασμα της ενδοσκοπικής πολυποδεκτομής είναι τεμαχισμένο ή η αφαίρεση έγινε κατά τμήματα (piecemeal) ιδιαίτερα σε ευμεγέθη άμισχο πολύποδα ή εάν τα όρια είναι αδύνατο να εκτιμηθούν ιστοπαθολογικά επαρκώς ή εάν είναι διηθημένα ή εάν το αδενοκαρκίνωμα που περιέχεται στον πολύποδα έχει «δυσμενή» ιστολογικά χαρακτηριστικά ή η διήθηση είναι επιπέδου 4 κατά Haggitt, τότε η διενέργεια κολεκτομής με την en block συναφαίρεση των επιχωρίων λεμφαδένων αποτελούν την ενδεδειγμένη θεραπεία (11). «Ευνοϊκά» ιστολογικά χαρακτηριστικά αποτελούν η καλή (Grade 1) και μέση (Grade 2) διαφοροποίηση του νεοπλάσματος, η απουσία λεμφαγγειακής διήθησης και το «αρνητικό» όριο εκτομής, ενώ «δυσμενή» χαρακτηριστικά είναι η χαμηλή (Grade 3) διαφοροποίηση, η παρουσία λεμφαγγειακής διήθησης και το «θετικό» όριο εκτομής (11). Δεν υπάρχει απόλυτη συμφωνία για το πως ορίζεται η διήθηση του ορίου εκτομής. Αποδεκτοί ορισμοί είναι η παρουσία κακοήθων κυττάρων σε απόσταση <1 χιλ από το όριο εκτομής, σε απόσταση <2 χιλ από το όριο ή η παρουσία τους εντός της ζώνης της διαθερμίας του ενδοσκοπικού βρόγχου.
Υπάρχει σχετική αμφισβήτηση για το εάν η ενδοσκοπική αφαίρεση ενός άμισχου πολύποδα μπορεί να θεωρηθεί επαρκής ογκολογικά ή εάν οι άμισχοι πολύποδες πρέπει να υποβάλλονται σε μια ογκολογικά ριζική εκτομή του αντίστοιχου τμήματος του παχέος εντέρου. Τα βιβλιογραφικά δεδομένα υποδεικνύουν ότι η επίπτωση ανεπιθύμητων συμβαμάτων, όπως υπολειπόμενη νόσος, υποτροπή, θνητότητα και αιματογενείς μεταστάσεις, αλλά όχι και λεμφαδενικές μεταστάσεις, είναι υψηλότερη μετά την ενδοσκοπική αφαίρεση άμισχων πολυπόδων συγκριτικά με τα έμμισχα αδενώματα. Πάντως η προσεκτική ανάλυση των δεδομένων αποδεικνύει ότι η μακροσκοπική εμφάνιση του αδενωματώδους πολύποδα αφ’εαυτής δεν είναι ο σημαντικός παράγοντας για την ανεπιθύμητη ογκολογική έκβαση και ότι ενδοσκοπική αφαίρεση αποτελεί επαρκή θεραπεία για την αντιμετώππιση ενός πλήρως εκταμέντα, με αρνητικά ιστολογικά όρια άμισχου πολύποδα που φέρει αδενοκαρκίνωμα καλής ή μέσης διαφοροποίησης και δεν παρουσιάζει σημεία λεμφαγγειακής διήθησης εντός του παρασκευάσματος.
Προεγχειρητική εκτίμηση και αξιολόγηση
Κατά το σχεδιασμό της χειρουργικής στρατηγικής για την αντιμετώπιση ενός καρκίνου στο παχύ έντερο η κατά το δυνατόν πλήρης αντίληψη της ακριβούς εντόπισης του όγκου, του σταδίου της νόσου και της γενικής κατάστασης του ασθενούς αποτελούν απαραίτητα στοιχεία (12). Διαθέσιμα συστήματα βαθμολόγησης αναλύουν τον αναισθησιολογικό κίνδυνο, όπως το ASA (American Society of Anesthesia) score, αλλά και τους πρόσθετους κνδύνους από τη συνεκτίμηση της θρεπτικής κατάστασης του ασθενούς και τη διενέργεια της κολεκτομής, όπως το POSSUM. H εντόπιση της πρωτοπαθούς βλάβης και η ιστολογική διάγνωση της βιοψίας μπορούν να καθοδηγήσουν την επιλογή της ογκολογικής επέμβασης, καθώς και τα ιδεώδη όρια εκτομής (12, 13, 14). Η παρουσία του όγκου σε διαχωριστικές ζώνες αιμάτωσης, όπως η ηπατική και η σπληνική καμπή οδηγεί σε αναγκαστικά περισσότερο εκτεταμένες εκτομές (εκτεταμένη δεξιά ή εκτεταμένη αριστερή κολεκτομή) του παχέος εντέρου προκειμένου την ογκολογική επάρκεια, αλλά και την ασφάλεια της επικείμενης αναστόμωσης των κολονικών κολοβωμάτων. Ενδείξεις που συνηγορούν με την παρουσία κληρονομικού μη πολυποδισιακού καρκίνου του παχέος εντέρου (Hereditary Nonpolyposis Colon Cnacer, HNPCC), όπως δεξιά εντόπιση της κακοήθους εστίας, νεαρή ηλικία, φλεγμονώδης αντίδραση που μοιάζει με αυτή που απαντάται στη νόσο Crohn, θετικό οικογενειακό ιστορικό, ιδιαίτερα δε εάν τα παραπάνω συνοδεύονται από την παρουσία μικροδορυφορικής αστάθειας στα δείγματα της βιοψίας, κατευθύνουν στην ανάγκη διενέργεια υφολικής, αντί τμηματικής κολεκτομής (12).
Η κολονοσκόπηση αποτελεί το καταλληλότερο μέσο διάγνωσης και εντόπισης του καρκινώματος, ενώ προσφέρει τη δυνατότητα λήψης βιοψιών και σήμανσης της βλάβης με μόνιμη χρωστική για το διεγχειρητικό εντοπισμό της εφόσον τούτο θεωρηθεί αναγκαίο(12, 13, 14). Η αξονική τομογραφία κοιλίας (Computed Tomography, CT) αποτελεί το απεικονιστικό μέσο εκλογής για την προεγχειρητική αξιολόγηση του ενδοκοιλιακά μεταστατικού ορθοκολικού καρκίνου(12, 13, 14, 15). Πληροφορίες για την τοπική επέκταση του όγκου (ειδικά με την παρουσία ψηλαφητής μάζας, ασυνήθους κοιλιακού άλγους και ανεξήγητων μη φυσιολογικών τιμών στο βιοχημικό έλεγχο), την ύπαρξη περιοχικής λεμφαδενοπάθειας (ευαισθησία που κυμαίνεται από 19 έως 67%) και την παρουσία ηπατικών μεταστάσεων (ευαισθησία και ειδικότητα για την ανίχνευση μεταστατικών εστιών >1 εκ 90% και 95%, αντίστοιχα) μπορούν να ληφθούν από τη CT κοιλίας (16). Πολλές φορές, ωσόσο, οι πληροφορίες αυτές δεν επηρεάζουν την απόφαση για χειρουργική επέμβαση, λαμβανομέμου δε υπ’όψιν του γεγονότος ότι τα στοιχεία που παρέχει η προεγχειρητική CT είναι εύκολα αναγνωρίσιμα κατά τη διάρκεια της χειρουργικής επέμβασης. Έτσι, αντί της προεγχειρητικής, η CT κοιλίας που λαμβάνεται μετεγχειρητικά αποτελεί τη βάση απεικονιστικής εκτίμησης (baseline) πριν την εφαρμογή επικουρικής θεραπείας. Σύμφωνα με τις συνιστώμενες πρακτικές αντιμετώπισης που συντάχθηκαν το 2004 από την Αμερικανική Εταιρεία Χειρουργών Παχέος Εντέρου & Ορθού (Αmerican Society of Colon & Rectal Surgeons (ΑSCRS) Standards Practice Task Force, Practice Parameters for Colon Cancer, 2004), «ενδείκνυται η προεγχειρητική CT κοιλίας σε επιλεγμένους ασθενείς, ενώ η χρήση της σαν εξέταση ρουτίνας είναι προαιρετική» (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Β) (13). Ωστόσο με τη σύγχρονη τάση ταυτόχρονης χειρουργικής αφαίρεσης της πρωτοπαθούς και των τυχόν ανευρυσκομένων σύγχρονων ηπατικών μεταστάσεων, καθώς και με την καθιέρωση πρωτοκόλλων χορήγησης νεοεπικουρικής χημειοθεραπείας σε ομάδες ασυμπτωματικών καρκίνων σταδίου IV, η προεγχειρητική CΤ κοιλίας μπορεί να τροποποιήσει χειρουργική στρατηγική αντιμετώποσης του καρκίνου και, έτσι, σήμερα αποτελεί αναπόσπαστη εξέταση στην προεγχειρητική σταδιοποίηση του αδενοκαρκινώματος του παχέος εντέρου.
Η αναγνωρισμένη προγνωστική αξία των ορολογικών επιπέδων του καρκινοεμβρυϊκού αντιγόνου (CEA), ως δείκτη πληρότητας εξαίρεσης της καρκινικής μάζας, αλλά και πιθανής υποτροπής, σε περίπτωση ανόδου της τιμής του, έχει καθιερώσει την προεγχειρητική μέτρηση του εν λόγω καρκινικού δείκτη απαραίτητη (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Α), ενώ μετεγχειρητικά η τακτική παρακολούθηση των επιπέδων του πρέπει να ξεκινά μετά από 3 μήνες (13, 17, 18). Η καθιερωμένη χρήση προεγχειρητικής ακτινογραφίας θώρακα για τον έλεγχο μεταστατικής νόσου στους πνεύμονες είναι αποδεκτή (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης ΙΙΙ, Βαθμός σύστασης C) (13). Πάντως, σύμφωνα με τις οδηγίες του NCCN, 2009 η προεγχειρητική αξιολόγηση του ασθενούς με μη μεταστατικό καρκίνο του παχέος εντέρου περιλαμβάνει ανασκόπηση των κολονοσκοπικών βιοψιών, πλήρη αιματολογικό έλεγχο, πλήρη κολονοσκόπηση, μέτρηση του CEA, αξονική τομογραφία θώρακα, κοιλίας και πυέλου (11). Η ποζιτρονική τομογραφία (Positron Emission Tomography, PET scan) δεν περιλαμβάνεται στην αρχική σταδιοποίηση της νόσου και δεν πρέπει να αποτελεί εξέταση ρουτίνας (11). Το PET scan μπορεί να προσφέρει πολύτιμη βοήθεια στη διευκρίνηση ύποπτων εστιών από τη CT ή τη μαγνητική τομογραφία, εφόσον αυτές ξεπερνούν σε μέγεθος το 1 εκ, καθώς επίσης και στον αποκλεισμό μεταστατικής νόσου σε δυνητικά χειρουργικά αφαιρέσιμη υποτροπή της νόσου, προκειμένου την αποφυγή μιας ριζικής επανεπέμβασης με μεγάλη νοσηρότητα.
Προετοιμασία του ασθενούς
Μηχανικός καθαρισμός του παχέος εντέρου
Παρά την καθιερωμένη χρήση του προεγχειρητικού μηχανικού καθαρισμού του πεχέος εντέρου με διαλύμματα, 5 προοπτικές τυχαιοποιημένες μελέτες (δεν έχουν τη στατιστική ισχύ για τον αποκλεισμό λάθους τύπου ΙΙ), μία μετα-ανάλυση και μία συστηματική ανασκόπηση δεν απέδειξαν κάποιο όφελος από το μηχανικό καθαρισμό σε προγραμματισμένες κολεκτομές συγκριτικά με την απουσία του και την απλή χορήγηση ενδοφλέβιων αντιβιοτικών (19, 20, 21). Μάλιστα στη μετα-ανάλυση των Bucher και συν, όπου συγκρίθηκαν 565 ασθενείς που υποβλήθηκαν σε προεγχειρητικό μηχανικό καθαρισμό με 579 που δεν έλαβαν διαλύμματα καθαρισμού του εντέρου, υπήρξε μεγαλύτερο ποσοστό αναστομωτικών διαφυγών στην ομάδα του μηχανικού καθαρισμού (Odds Ratio, OR: 1,8) (21). Επίσης οι επιπλοκές που αφορούσαν σε εν τω βάθει χειρουργικές λοιμώξεις και λοιμώξεις του τραύματος ήταν περισσότερες στους ασθενείς που είχαν υποβληθεί σε μηχανικό καθαρισμό. Πάντως, στις περισσότερες από τις μελέτες χρησιμοποιήθηκαν τα υψηλού όγκου διαλύματα πολυαιθυλενογλυκόλης, ενώ τα παραπάνω δεδομένα μπορεί να μην ισχύουν με τα χαμηλότερου όγκου διαλύματα φωσφορούχου νατρίου, που χρησιμοποιούνται περισσότερο σήμερα. Η επιλεγμένη χρήση του μηχανικού καθαρισμού με τη χορήγηση συστηματικών αντιβιοτικών συνεχίζει να δικαιολογείται στην προετοιμασία του ασθενούς για κολεκτομή (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Α) (13).
Χημειοπροφύλαξη
Η προφυλακτική χορήγηση αντιβιοτικών έχει αποδεδειγμένη αποτελεσματικότητα στο να ελαττώνει τη συχνότητα των λοιμώξεων, τη θνητότητα και το κόστος της νοσηλείας μετά από κολεκτομές. Ανεξάρτητα από το/α παρεντερικό/ά αντιβιοτικό/ά που θα χρησιμοποιηθεί/ούν, η χορήγηση του/τους πρέπει να γίνεται πριν από την έναρξη της χειρουργικής επέμβασης (22-25). Στις προγραμματισμένες κολεκτομές για καρκίνο η χρήση των ενδοφλέβιων αντιβιωτικών δεν είναι αναγκαίο να επεκτείνεται πέραν των 24 ωρών προεγχειρητικά. Συμπερασματικά, τα προφυλακτικά αντιβιωτικά ενδείκνυνται στις εκλεκτικές κολεκτομές (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης Ι, Βαθμός σύστασης Α) (13).
Μεταγγίσεις
Η προεγχειρητική μετάγγιση αίματος μπορεί να απαιτηθεί για ασθενείς που υποβάλλονται σε κολεκτομή για καρκίνο. Γενικά, η ανάγκη για μετάγγιση καθορίζεται από το επίπεδο της αιμοσφαιρίνης πριν από το χειρουργείο, τη φυσιολογική κατάσταση του ασθενούς και τις διεγχειρητικές απώλειες αίματος. Είναι, ωστόσο, αποδεδειγμένες οι ανοσοκατασταλτικές επιδράσεις των μεταγγίσεων. Ασθενείς που λαμβάνουν αίμα περιεγχειρητικά διατρέχουν μεγαλύτερο κίνδυνο λοιμώξεων. Επίσης, αν και αρκετές μελέτες υποστηρίζουν το μεγαλύτερο κίνδυνο για κακοήθη υποτροπή και ελαττωμένη επιβίωση, οι μεταναλύσεις επί του θέματος αμφισβητούν την ύπαρξη πραγματικής αιτιώδους σχέσης (26-38). Συμπερασματικά, οι μεταγγίσεις αίματος πρέπει να βασίζονται στις φυσιολογικές ανάγκες του ασθενούς (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης ΙΙΙ, Βαθμός σύστασης C) (13).
Θρομβοπροφύλαξη
Οι ασθενείς που υποβάλλονται σε κολεκτομή για καρκίνο έχουν υψηλή συχνότητα εν τω βάθει φλεβοθρόμβωσης και πνευμονικής εμβολής. Πολλαπλές μελέτες έχουν αποδείξει την αποτελεσματικότητα της χορήγησης ηπαρίνης χαμηλού μοριακού βάρους γι’ αυτό το σκοπό (39-44). Στην προοπτική τυχαιοποιημένη μελέτη των Mc Leod και συν (Ann Surg, 2001) που αφορούσε χειρουργικούς ασθενείς παχέος εντέρου, οι θροβοπροφυλακτικές δράσεις της ηπαρίνης χαμηλού μοριακού βάρους και της υποδόριας κοινής ηπαρίνης ήταν ισοδύναμες (43). Πέραν της ηπαρίνης, η αναγκαιότητα πρόσθετης χρήσης άλλων μέσων, όπως συσκευών διακεκομμένης αεροσυμπίεσης των κάτω άκρων, δεν έχει ακόμα διευκρινιστεί. Παρ’ όλ’ αυτά, όλοι οι ασθενείς που υποβάλλονται σε κολεκτομή για καρκίνο πρέπει να λαμβάνουν θρομβοπροφύλαξη (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης Ι, Βαθμός σύστασης Α) (13).
Αρχές χειρουργικής τεχνικής
Ιδανικό μήκος και όρια εκτομής
Το μήκος εκτομής του παχέος εντέρου πρέπει να αντιστοιχεί στη λεμφαγγειακή αποχέτευση του φέροντος τον όγκο τμήματτος του παχέος εντέρου (οδηγίες ASCRS, 2004: Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Β) (13).
Το καθοριστικό κριτήριο της ογκολογικά επαρκούς εκτομής του ιδανικού μήκους τμήματος του εντέρου είναι η αφαίρεση του τροφοδοτούντος αγγειακού μίσχου στην έκφυσή του και του αντίστοιχου λεμφαδενικού ιστού (Εικόνα 2). Όταν ο πρωτοπαθής όγκος είναι σε ίση απόσταση ανάμεσα σε δύο τροφοδοτούντα αγγεία, τότε και τα δύο αγγεία πρέπει να απολινώνονται κοντά στην έκφυσή τους. Έτσι, οι όγκοι που εντοπίζονται σε ζώνες μετάβασης πρέπει να εκτέμνονται μαζί με τις γειτονικές λεμφαδενικές περιοχές προκειμένου να συμπεριληφθούν και οι δύο πιθανές κατευθύνσεις λεμφαδενικής διασποράς. Στη μελέτη των Rouffett και συν. (Dis Colon Rectum, 1994), στην οποία 260 ασθενείς τυχαιοποιήθηκαν σε αριστερή ημικολεκτομή ή σε τμηματική εκτομή του αριστερού κόλου, ο διάμεσος χρόνος επιβίωσης, η νοσηρότητα και η θνητότητα ανάμεσα στις δύο ομάδες ήταν παρόμοια (45).
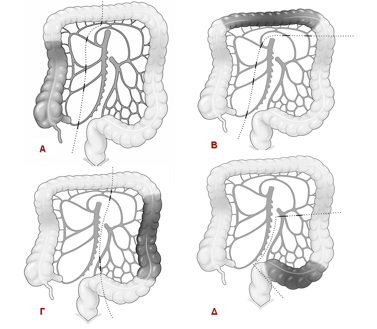
Εικόνα 2. Είδη κολεκτομών αναλόγως της θέσης του όγκου.
Α. Δεξιά κολεκτομή
Β. Δεξιά εκτεταμένη κολεκτομή
Γ. Αριστερή κολεκτομή
Δ. Σιγμοειδεκτομή
Η αφαίρεση της αγγείωσης του προσβεβλημένου τμήματος του παχέος εντέρου η οποία και είναι παράλληλη με τη λεμφαγγειακή του αποχέτευση υπαγορεύει το μήκος του παχέος εντέρου που εκτέμνεται. Τουλάχιστον 5εκ φυσιολογικού εντέρου και από τις δύο πλευρές της πρωτοπαθούς κακοήθους εστίας είναι το ελάχιστο μήκος που απαιτείται προκειμένου την αφαίρεση των επικολικών και παρακολικών (κατά μήκος της επιχειλίου αρτηρίας) λεμφαδένων καθώς και την ελαχιστοποίηση της αναστομωτικής διαφυγής. Το μήκος του ειλεού που εκτέμνεται δεν επηρεάζει την τοπική υποτροπή. Το ελάχιστο μήκος του ειλεού χρειάζεται να αφαιρείται σε ογκολογικές επεμβάσεις του παχέος εντέρου για την πρόληψη της απορρόφησης. Πάντως, δεν είναι δυνατό να εκτιμηθεί με ακρίβεια η ανεξάρτητη επίδραση ειδικά των ορίων εκτομής του παχέος εντέρου στην επιβίωση και στις ογκολογικές υποτροπές διότι το μήκος εκτομής και η έκταση της λεμφαδενεκτομής είναι δύο άρρηκτα συνδεδεμένες παράμετροι που βρίσκονται σε άμεση συνάρτηση.
Έκταση λεμφαδενεκτομής
Η αφαίρεση των σύστοιχων λεμφαδενικών ομάδων έχει ιδιαίτερη προγνωστική και θεραπευτική αξία. Η σωστή λεμφαδενεκτομή πρέπει να εκτείνεται στην έκφυση του πρωτογενώς τροφοδοτούντος αγγειακού κλάδου. Σε όλες τις δυνητικά θεραπευτικές κολεκτομές η αφαίρεση των λεμφαδένων πρέπει να γίνεται en block με το εκταμέν τμήμα του εντέρου. Οι κορυφαίοι λεμφαδένες στην αρχή, δηλαδή στην περιοχή της έκφυσης των τροφοφόρων αγγείων, πρέπει να συναφαιρούνατι όταν αυτό είναι εφικτό και να σημαίνονται για ιστιπαθαλογική εκτίμηση. Στη μελέτη των Malassagne και συν. (Dis Colon Rectum, 1993) η διήθηση των κορυφαίων λεμφαδένων αύξησε κατα 2,5 φορές την ογκολογική θνητότητα των ασθενών (46). Αυτό το εύρημα υπαστηρίχθηκε από την τυχαιοποιημένη μελέτη 1,117 ασθενών από την Αυστραλία όπου αναδείχθηκε ελαττωμένη 5ετής επιβίωση από 54% σε 26% στους ασθενείς με μεταστατική διήθηση των κορυφαίων λεμφαδένων (47).
Εκτεταμένες ριζικές λεμφαδενεκτομές δεν έχουν αποδείξει ότι οδηγούν σε βελτίωση της επιβίωσης και για αυτό η διενέργεια τέτοιου είδους επεμβάσεων δεν υποστηρίζεται γενικά, αφού οι σχετιζόμενες με αυτές επιπλοκές υπερβαίνουν κάθε θεωρητικό πλεονέκτημά τους. Πάντως, αν υπάρχει κάποιο όφελος, αυτό βρίσκεται στην ομάδα των ασθενών με καρκίνο σταδίου C κατά Dukes. Η αυξημένη νοσηρότητα μιας εκτεταμένης λεμφαδενεκτομής μπορεί να μην αποτελεί απαγορευτικό στοιχείο όταν η επέμβαση γίνεται από ειδικούς, αν και η δυνητική αξία μιας τέτοιας επιθετικής χειρουργικής τεχνικής φαίνεται να βρίσκεται στην καλύτερη σταδιοποίηση (48).
Εάν κατά τη διάρκεια της χειρουργικής επέμβασης υπάρξει υποψία ότι λεμφαδένες που βρίσκονται εκτός του πεδίου εκτομής είναι διηθημένοι, τότε αυτοί πρέπει να αφαιρεθούν και να σταλούν για βιοψία. Εάν τα αποτελέσματα της βιοψίας των ύποπτων λεμφαδένων είναι θετικά και αυτοί οι λεμφαδένες έχουν αφαιρεθεί μαζί με τους κορυφαίους λεμφαδένες, τότε η εκτομή θεωρείται πλήρης (R0). Εάν η βιοψία είναι θετική και οι λεμφαδένες δεν έχουν αφαιρεθεί με τους κορυφαίους λεμφαδένες, η εκτομή θεωρείται ατελής. Εάν λεμφαδένες που έχουν αποδειχθεί θετικοί στη βιοψία δε συμπεριληφθούν στα όρια της λεμφαδενεκτομής και αφεθούν στο χειρουργικό πεδίο, τότε η εκτομή είναι ατελής (R2).
Η ακρίβεια της σταδιοποίησης του καρκίνου του παχέος εντέρου αυξάνεται με την αύξηση του αριθμού των λεμφαδένων που εκτιμώνται μικροσκοπικά. O αριθμός των ανευρεθέντων λεμφαδένων κυμαίνεται ανάλογα με τον ασθενή, την ηλικία του, τη θέση και τη διαφοροποίηση του όγκου. Δέκα ή περισότεροι λεμφαδένες ανευρίσκονται στο 98% των παρασκευασμάτων και 13 ή περισσότεροι στο 91% χωρίς να χρησιμοποιηθούν τεχνικές καθαρισμού του λίπους. Χρησιμοποιώντας όμως τέτοιες τεχνικές, ο μέσος αριθμός των διαθέσιμων λεμφαδένων για ιστολογική εξέταση μπορεί να αυξηθεί έως και 58% (49-54).
Με βάση παλαιότερες μελέτες που πιστοποίησαν ότι 15 έως 21 λεμφαδένες χρειάζεται να εκτιμηθούν προκειμένου να ανιχνευθεί λεμφαδενική μετάσταση στο 95% των ασθενών στους οποίους λεμφαδενική διήθηση είναι πραγματικά παρούσα, οι οδηγίες ASCRS 2004 καθόρισαν τον αριθμό 15 ως τον ελάχιστο αναγκαίο αριθμό λεμφαδένων που πρέπει να έχουν μικροσκοπικά αξιολογηθεί (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Β) (13). Οι σύγχρονες οδηγίες του NCCN, 2009 ορίζουν το ελάχιστο αριθμό λεμφαδένων στους 12 (11). Αυτή η οδηγία βασίζεται στη σύσταση από την American Joint Committee on Cancer (AJCC) και το Αμερικανικό Κολλέγιο των Παθολογοανατόμων (College of American Pathologists, CAP), σύμφωνα με την οποία η ακριβής ταυτοποίηση ενός καρκίνου σταδίου ΙΙ (pN0), δηλαδή η απουσία λεμφαδενικής διήθησης απαιτεί την εξέταση τουλάχιστον 12 λεμφαδένων, ειδάλλως υφίσταται κίνδυνος υποσταδιοποίησης της νόσου.
Εάν πρόκειται για καρκίνωμα σταδίου ΙΙ και οι ανευρεθέντες λεμφαδένες είναι λιγότεροι από 12, ο παθολογοανατόμος πρέπει να κάνει περαιτέρω προσπάθειες επαναπροσδιορισμού με επανεξέταση του αποσταλλέντος υλικού, και, εάν, πρ’όλα αυτά, ο αριθμός των ανευρεθέντων λεμφαδένων δεν αποδειχθεί επαρκής, να καταγραφεί στην τελική ιστολογική εξέταση. Ειδικά για τα στάδια ΙΙΙΒ και ΙΙΙC, ο αριθμός των ανευρεθέντων λεμφαδένων αποτελεί ανεξάρτητο προγνωστικό δείκτη (55).
Tεχνική απομονώσεως του όγκου (No-Touch Technique)
Η ανησυχία για για την αποκόλληση καρκινικών κυττάρων και εμβόλων κατά τη διάρκεια των χειρουργικών χεισρισμών αποτελέσε το κίνητρο για την εισαγωγή και εφαρμογή από τους θιασώτες της, της τεχνικής απομόνωσης του όγκου (no-touch technique) (56-58). Αυτή περιλαμβάνει την απολίνωση της αγγειακής κοίτης στην περιοχή της βλάβης, τους απαραίτητους χειρουργικούς χειρισμούς και, τελευταία, την κινητοποίηση του πέριξ του όγκου τμήματος του παχέος εντέρου. Στην αναδρομική μελέτη του Turnbull από το 1967 φάνηκε ότι η 5ετής επιβίωση των ασθενών στους οποίους ακολουθήθηκε αυτή η τεχνική ήταν καλύτερη (56). Η μελέτη όμως αυτή είχε σοβαρά μεθοδολογικά προβλήματα.
Στη μοναδική προοπτική τυχαιοποιημένη μελέτη που υπάρχει, αυτή των Wiggers και συν (Br J Surg, 1988) η διαφορά στην 5ετή επιβίωση μεταξύ της «συμβατικής» και της τεχνικής απομόνωσης δεν ήταν σημαντικές (56,3% vs 59,8%), αν και περισσότεροι ασθενείς εμφάνισαν ηπατικές μεταστάσεις και το ελεύθερο νόσου χρονικό διάστημα ήταν μικρότερο στην ομάδα των ασθενών μετά τη «συμβατική» τεχνική (57). Σε μία μικρή μελέτη 27 ασθενών των Hayashi και συν βρέθηκαν καρκινικά κύτταρα στην πυλαία φλέβα του 73% των ασθενών που χειρουργήθηκαν με τη «συμβατική» τεχνική έναντι 14% αυτών που υποβλήθηκαν σε τεχνική απομόνωσης του όγκου (59). Άλλα πειραματικά δεδομένα δεν υποστηρίζουν την παρουσία αποκολλήσεως σημαντικού αριθμού κυττάρων από τον όγκο κατά τη διάρκεια των χειρουργικών χειρισμών (58). Συμπερασματικά, η αξία της τεχνικής απομόνωσης του όγκου αμφισβητείται σημαντικά και με βάση τα δεδομένα της μίας τυχαιοποιημένης που υπάρχει για το θέμα αυτό, η καθιερωμένη χρήση της δεν προσφέρει ογκολογικά πλεονεκτήματα (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης C) (13).
Σύγχρονος καρκίνος παχέος εντέρου
Η επίπτωση σύγχρονου καρκινώματος παχέος εντέρου κυμαίνεται 2-9%. Η θέση των όγκων και μία ποικιλία παραγόντων που σχετίζονται με τον ασθενή θα καθορίσουν το εάν οι δύο βλάβες θα εκταμούν χωριστά ή εάν θα διενεργηθεί υφολική κολεκτομή. Έχει φανεί ότι και οι δύο προσεγγίσεις έχουν παρόμοια αποτελέσματα, συχνότητα επιπλοκών και αναστομωτικών διαφυγών και θνητότητας (60, 61). Έτσι, οι σύγχρονοι καρκίνοι του παχέος εντέρου μπορούν να αντιμετωπιστούν με δύο χωριστές εκτομές ή με υφολική κολεκτομή (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Β) (13).
Διήθηση οργάνων κατά συνέχεια ιστού
Το 15% των ασθενών με καρκίνο του παχέος εντέρου φέρουν όγκους που διηθούν παρακείμενα όργανα. Πολλές φορές είναι αδύνατον να επιτευχθεί διεγχειρητική διάτρηση των κακοήθων από τις φλεγμονώδεις συμφύσεις. Λόγω του ότι 40% των συμφύσεων και των ιστών προσκόλλησης του όγκου προς τα παρακείμενα όργανα περιέχουν κακοήθη κύτταρα, η en block εκτομή είναι απαραίτητη για να επιτευχθεί ογκολογικά επαρκής αφαίρεση (62, 63). Στη σειρά των Gall και συν ( Dis Colon Rectum, 1987) που περιείχε 121 ασθενείς με διήθηση άλλων οργάνων από όγκους παχέος εντέρου, η 5ετής επιβίωση ήταν παρόμοια στις en block εκτομές, ανεξάρτητα από το εάν οι συμφύσεις ήταν φλεγμονώδεις ή κακοήθεις (54% έναντι 49%) (64). Το ποσοστό επιβίωσης, όμως, ελαττώθηκε στο 17% εάν ο χειρουργός είχε διατάμνει κακοήθεις διηθήσεις. Στη μελέτη του Hunter και συν (Αm J Surg 1987) με 43 ασθενείς, η 5ετής επιβίωση ήταν 61% όταν διενεργήθηκε en block εκτομή ενώ μόνο 23% όταν οι προσφύσεις διαχωρίστηκαν κατά τη διάρκεια του χειρουργείου (65). Έτσι, καρκίνοι παχέος εντέρου που διηθούν κατά συνέχεια ιστού παρακείμενα όργανα πρέπει να αφαιρούνται en block με τις παρακείμενες ανατομικές δομές ((Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Α) (13). Ακόμα και σε ασθενείς με περιοχικές λεμφαδενικές μεταστάσεις (ο πιο σημαντικός προγνωστικός παράγοντας) η en block εκτομή με τα διηθούμενα από τον όγκο όργανα είναι απαραίτητη διότι 25% των ασθενών αυτών θα επιβιώσουν για τουλάχιστον 5 έτη. Τέλος, τα αποτελέσματα των Talamonti και συν. (Surg Gynecol Obstet, 1993) που αφορούσαν διήθηση της ουροδόχου κύστεως, η οποία αποτελεί και το όργανο που πιο συχνά ενέχεται σε έναν τοπικά προχωρημένο ορθοκολικό καρκίνο, επιβεβαίωσαν ότι η en block αφαίρεση τμήματος ή ολόκληρης της ουροδόχου κύστεως επιμηκύνει την επιβίωση εφόσον τα όρια εκτομής είναι αρνητικά (66).
Ο ρόλος του λεμφαδένα – φρουρού
Η αναζήτηση του λεμφαδένα-φρουρού, δηλαδή του λεμφαδένα που αποτελεί την πρώτη θέση συλλογής της λέμφου στη λεμφαδενική άλυσο απορροής της περιοχής του όγκου, έχει κλινική σημασία ιδιαίτερα στους ασθενείς με καρκίνο χαμηλού σταδίου. Η διενέργεια μικρού πάχους τομών και η χρήση ανασοϊστοχημικών μεθόδων βελτιώνει τη δυνατότητα αναδείξεως μικρομεταστάσεων (< 2χιλ.) με αποτέλεσμα την καλύτερη σταδιοποπίηση της νόσου και την εφαρμογή επιθετικότερης επικουρικής θεραπείας. Διενεργείται διεγχειρητικά με την υποορογόνια έγχυση μπλε χρωστικής ισοσουλφάνης η οποία οδηγεί στην αναγνώριση του λεμφαδένα-φρουρού σε 1 λεπτό. Μπορεί επίσης, να γίνει ενδοσκοπική έγχυση ραδιοσεσημασμένου υλικού στον υποβλεννογόνιο υμένα και να χρησιμοποιηθεί διεγχειρητικά ραδιοανιχνευτής για την ανίχνευση του λεμφαδένα–φρουρού. Η χαρτογράφηση του λεμφαγγειακού δικτύου είναι δυνατόν να επιτευχθεί και μετά την κολεκτομή ex fivo, με ένεση της μπλε χρωστικής εντός του όγκου και μάλαξή του.
Η αποτελεσματικότητα της μεθόδου στον καρκίνο του παχέος εντέρου αποτελεί αντικείμενο διχογνωμίας διότι η προγνωστική σημασία των λεμφαδενικών μικρομεταστάσεων αμφισβητείται, το πσοστό των ψευδώς αρνητικών αποτελεσμάτων φαίνεται να είναι μεγάλο (60%) σύμφωνα με τους Joosten και συν, Br Surg, 1999), αν και η διαγνωστική ακρίβεια μπορεί να αυξηθεί με χρήση ραδιοσεσημασμένου υλικού (έως και 92% σύμφωνα με Kitagawa και συν, Dis Colon Rectum, 2002) και τέλος, από τα αποτελέσματα της πολυκεντρικής μελέτης των Bertagnoli και συν (Αnn Surg, 2004) η μέθοδος δεν μετατρέπει την έκταση της χειρουργικής εκτομής (68-70).
Ο ρόλος της ωοθηκεκτομής
Η συχνότητα σύγχρονων μεταστάσεων στις ωοθήκες κυμαίνεται από 2 έως 8%. Διεγχειρητικά οι ωοθήκες πρέπει να ελέγχονται λεπτομερώς. Εάν οι ωοθήκες είναι μακροσκοπικά παθολογικές ή φαίνεται να διηθούνται κατά συνέχεια ιστού, τότε πρέπει να αφαιρούνται en block με τον πρωτοπαθή όγκο. Δεν υπάρχει αποδεδειγμένο πλεονέκτημα στην επιβίωση των ασθενών που να σχετίζεται με τη διενέργεια ωοθηκεκτομής στις ασθενείς με καρκίνο του παχέος εντέρου (τυχαιοποιημένη μελέτη των Young-Fadok και συν, Dis Colon Rectum, 1998), αλλά εάν η μία ωοθήκη φαίνεται να είναι διηθημένη, η διενέ ργεια αμφοτερόπλευρης ωοθηκεκτομής είναι απολύτως ενδεδειγμένη λόγω του κινδύνου μεταστατικής νόσου στην ετερόπλευρη ωοθήκη (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης Β) (13, 71, 72).
Αντιμετώπιση ειδικών καταστάσεων
Απόφραξη παχέος εντέρου
Πολλαπλές μη τυχαιοποιημένες μελέτες με σειρές ασθενών που αντιμετωπίστηκαν για κακοήθη απόφραξη του δεξιού κόλου έχουν επιβεβαιώσει ότι η δεξιά κολεκτομή με άμεση ειλεο-εγκαρσία αναστόμωση, χωρίς κολονική έκπλυση (Lavage) είναι ασφαλής και αποτελεσματική χειρουργική τεχνική (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης C) (13). Αν και δεν υπάρχουν μελέτες που αναλύουν ειδικά τη συγκεκριμένη περίπτωση, η ύπαρξη νεοπλασματικής απόφραξης στο εγκάριο κόλο απαιτεί διενέργεια εκτεταμένης δεξιάς κολεκτομής και ειλεο-κατιούσας αναστόμωσης.
Στις περιπτώσεις αποφράξεως του παχέος εντέρου από καρκίνο που εντοπίζεται στο αριστερό κόλο η χειρουργική αντιμετώπιση πρέπει να εξατομικεύεται με την επιλογή της καταλληλότερης από μία σειρά ενδεδειγμένων χειρουργικων προσεγγίσεων (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης C) (13). Κάθε μία από τις παρακάτω επιλογές έχει τους υποστηρικτές της: εκτομή του φέροντος τον όγκο τμήματος του παχέος εντέρου και τελική κολοστομία (επέμβαση κατά Hartmann), εκτομή ακολουθούμενη από διεγχειρητική κολονική έκπλυση (on table colonic lavage) και αναστόμωση κατά πρώτο σκοπό, και υφολική κολεκτομή με ειλεο-ορθική αναστόμωση (Εικόνα 3) (73-76).
Υπάρχει μόνο μία τυχαιοποιημένη μελέτη η οποία συγκρίνει την υφολική κολεκτομή έναντι της τμηματικής εκτομής ακολουθούμενης από διεγχειρητική κολονική έκπλυση και πρωτογενή αναστόμωση. Η μελέτη δημοσιεύτηκε το 1995 από την ομάδα SCOTTIA και η θνητότητα και η επίπτωση των επιπλοκών ήταν παρόμοια ανάμεσα στις 2 προσεγγίσεις (77). Βασιζόμενοι, όμως, στην καλύτερη γαστρεντερική λειτουργία μετά από 4 μήνες από την επέμβαση, στους ασθενείς που είχαν υποβληθεί σε τμηματική εκτομή και κολονικό lavage, πρότειναν αυτήν τη χειρουργική πρακτική για τις περισσότερες αποφράξεις του αριστερού κόλου αν και η παρουσία σύγχρονης ή επαπειλούμενης διάτρησης του τυφλού από την εξεσημασμένη διάταση του παχέος εντέρου καθώς και η παρουσία ή η υποψία σύγχρονης νεοπλασματικής βλάβης κεντρικότερα (λόγω της αδυναμίας του κεντρικώς του όγκου τμήματος του εντέρου προεγχειρητικά) καθιστούν την υφολική κολεκτομή ως την προτιμητέα επέμβαση. Η ύπαρξη ενδοκοιλιακής σήψης ή σοβαρών τεχνικών δυσκολιών για την κατασκεύη της αναστόμωσης επιβάλλουν τη διενέργεια επέμβασης κατά Hartmann (78-80).
Η σύγχρονη βιβλιογραφία υποστηρίζει, επίσης, την επιλογή της ενδοσκοπικής τοποθέτησης κολονικής ενδοπρόθεσης (stent) (81-84). Εάν χρησιμοποιηθεί σε κατάλληλα επιλεγμένους ασθενείς, η τοποθέτηση του stent παρέχει τη δυνατότητα της ανακούφισης της οξείας απόφραξης προκειμένου να προσφερθεί ο απαραίτητος χρόνος για προγραμματισμένη προετοιμασία του παχέος εντέρου, κολονοσκόπηση, ογκολογική εκτομή και αναστόμωση σε πρώτο χρόνο.
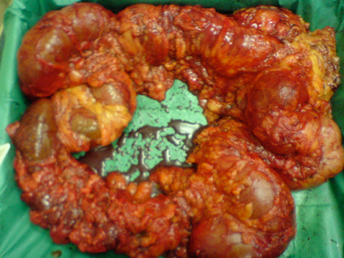
Εικόνα 3. Παρασκεύασμα υφολικής κολεκτομής για πλήρως αποφράσσοντα όγκο κατιόντος κόλου. Ο ασθενής προσήλθε με κλινική εικόνα απόφραξης και στον προεγχειρητικό αξονοτομογραφικό έλεγχο αναδείχθηκε ενδοτοιχωματικός αέρας στο δεξιό κόλον. Διεγχειρητικά η επαπειλούμενη ρήξη του τυφλού οδήγησε στη διενέργεια της υφολικής κολεκτομής και στην αποκατάσταση της συνέχειας του εντέρου με ειλεο-ορθική αναστόμωση
Διάτρηση παχέος εντέρου
Ο πρωταρχικός στόχος είναι η απομάκρυνση του τμήματος του εντέρου που φέρει τη βλάβη και αποτελεί και το κύριο αίτιο της ενδοκοιλιακής σήψης. Κάθε προσπάθεια πρέπει να καταβάλεται για τη διενέργεια κολεκτομής (Επίπεδο ένδειξης ΙΙ, Βαθμός σύστασης C) (13). Εάν υπάρχει ελεύθερη διάτρηση με περιτονίτιδα λόγω ενός καρκίνου στο δεξιό κόλο, μετά τη δεξιά κολεκτομή η αναστόμωση δεν είναι η σοφότερη επιλογή και η δημιουργία μίας τελικής ειλεοστομίας με το άπω κολονικό κολόβωμα να συγκλισθεί ή να εκστομωθεί σα βλεννογονικό συρίγγιο φαίνεται να είναι η καλύτερη επιλογή. Εάν υπάρχει όμως περιορισμένη κοπρανώδης διαφυγή, η αναστόμωση μπορεί να είναι εφικτή με ή χωρίς εγγύς προσωρινή εκτροπή με προστατευτική στομία. Όταν η διάτρηση λαμβάνει χώρα στη θέση ενός καρκίνου αριστερού κόλου, συνήθως διενεργείται μία επέμβαση κατά Hartmann. Στις περιπτώσεις που η διάτρηση συνοδεύεται από εξεσημασμένη εγγύς διάταση με ή χωρίς ισχαιμία, η υφολική κολεκτομή μπορεί να είναι καλύτερη επιλογή. Εάν η περιτοναϊκή σήψη είναι περιορισμένη, η ειλεο-ορθική ή η ειλεο-σιγμοειδική αναστόμωση συνήθως με μία προστατευτική loop-ειλεοστομία είναι έγκριτη επιλογή.
Μαζική αιμορραγία παχέος εντέρου
Η αιματοχεσία που χρειάζεται επείγουσα χειρουργική αντιμετώπιση είναι ασυνήθης επιπλοκή του καρκίνου του παχέος εντέρου (85-87). Η προεγχειρητική ή διεγχειρητική εντόπιση της θέσης της αιμορραγίας πρέπει να προηγείται με κάθε προσπάθεια. Εφόσον η θέση του καρκίνου έχει ταυτοποιηθεί, η τμαματική ογκολογικά άρτια εκτομή του τμήματος πρέπει να διενεργείται όπως, ακριβώς, και μία προγραμματισμένη εκτομή καρκίνου του παχέος εντέρου (Επίπεδο ένδειξης ΙΙΙ, Βαθμός σύστασης C) (13). Λόγω της καθαρτικής δράσης του αίματος το έντερο έχει ήδη επαρκώς καθαριστεί από τον όγκο των κοπράνων και η αναστόμωση σε πρώτο χρόνο μπορεί να είναι εφικτή. Αφού δεν υπάρχουν τυχαιοποιημένες μελέτες που να διευκρινίζουν το συγκεκριμένο θέμα, η ανάγκη για τη δημιουργία στομίας ορίζεται από την κρίση του χειρουργού. Στις περιπτώσεις που η θέση της αιμορραγίας δε μπορεί να εντοπιστεί με ακρίβεια, η προτιμητέα χειρουργική επέμβαση σύμφωνα με τις αναδρομικές μελέτες που έχουν ασχοληθεί με το θέμα αυτό είναι η υφολική κολεκτομή, αφού η συχνότητα επανεμφάνισης της αιμορραγίας είναι ελαττωμένη μετά από υφολική κολεκτομή, ενώ η νοσηρότητα της επέμβασης αυτής δεν είναι σημαντικά διαφορετική από τις διάφορες τμηματικές εκτομές του εντέρου (88).
Είδη κολεκτομών
Δεξιά κολεκτομή
Η δεξιά κολεκτομή ενδείκνυται σε ασθενείς με κακοήθεις όγκους στο τυφλό, ανιόν κόλον και την ηπατική καμπή, αφού η άρδευση των περιοχών αυτών προέρχεται από την ειλεοκολική και τη δεξιά κολική αρτηρία. Ο ασθενής τοποθετείται σε θέση ύπτια ή σε θέση λιθοτομής στις πριπτώσεις που θα απαιτηθεί διεγχειρητική κολονοσκόπηση. Η τοποθέτηση του χειρουργού στην αριστερή πλευρά του ασθενούς διευκολύνει σημαντικά. Η διενέργεια κάθετης χειρουργικής τομής στη μέση γραμμή βοηθά στην πλήρη επισκόπηση της κοιλιάς και του χειρουργικού πεδίου. Η διεγχειρητική σταδιοποίηση της νόσου λαμβάνει χώρα με επισκόπηση και ψιλάφηση των ενδοκοιλιακών οργάνων δίνοντας έμφαση στις θέσεις πιθανών μεταστατικών εστιών, όπως το ήπαρ και οι ωοθήκες. Η εξαιρεσιμότητα του όγκου ελέγχεται με ήπιους ψιλαφητικούς χειρισμούς, όπως γίνεται και η διερεύνηση τυχόν διήθησης παρακείμενων οργάνων. Οι έλικες του λεπτού εντέρου απομακρύνονται από το χειρουργικό πεδίο έτσι ώστε να αποκαλυφθει η ριζα του δεξιού μεσοκόλου και το μεσεντέριο του εγκάρσιου κόλου. Στην τεχνική της παρασκεύης του δεξιού κόλου από το κέντρο προς την περιφέρεια (μέση-προς-πλάγια προσέγγιση, medial-to-lateral approach) γίνεται αρχικά αναγνώριση, διατομή και απολίνωση των δεξιών κολικών αγγείων και των δεξιών κλάδων των μέσων κολικών αγγείων στη ρίζα του μεσεντερίου του δεξιού κόλου, επιτυγχάνοντας με αυτόν τον τρόπο την αγγειακή απομόνωση της περιοχής του όγκου (Εικόνα 4).
Μετά την αποκάλυψη της ρίζας του δεξιού μεσοκόλου, η δεξιά κολική αρτηρία (παρούσα στο 50% των ασθενών) και τα ειλεοκολικά αγγεία ανασπώνται απομακρυνόμενα από το οπισθοπετιτόναιο. Μία κάθετη τομή διενεργείται στη ρίζα του δεξιού μεσοκόλου ουραίως της 3ης μοίρας του δωδεκαδακτύλου στα δεξιά της άνω μεσεντερίου αρτηρίας. Τα αγγεία απομακρύνονται από το οπισθοπεριτόναιο και η εγγύς απολίνωση λαμβάνει χώρα στην αρχή της ειλεοκολικής αρτηρίας από την άνω μεσεντέριο (Εικόνα 5). Το δεξιό μεσόκολο παρασκευάζεται διαχωριζόμενο από το οπισθοπεριτόναιο με αποτέλεσμα την ανεύρεση του ηπατικού κλάδου της μέσης κολικής αρτηρίας ο οποίος και απολινώνεται. Με ανάλογη παρασκευή με ουραία κατεύθυνση προς τον τελικό ειλεό ανευρίσκονται και απολινώνονται οι ειλεϊκοί αγγειακοί κλάδοι.
Ο τελικός ειλεός και το δεξιό κόλο ανασπώνται και, μετά από τη διατομή της πλαγίας ανάκαμψης του τοιχωματικού περιτοναίου (γραμμή Toldt), το μεσόκολο αποκολλάται πλήρως από το οπισθοπεριτόναιο έως το ύψος της ηπατικής καμπής. Καθ’ όλη τη διαδικασία της παρασκευής ιδιαίτερη προσοχή δίνεται στη διατήρηση του σύστοιχου ουρητήρα, των έσω σπερματικών αγγείων και της κάτω κοίλης φλέβας. Οι αναρτούντες σύνδεσμοι της ηπατικής καμπής διατέμνονται με προσοχή για την αποφυγή τραυματισμών στα εξωηπατικά χολιφόρα, την ηπατική κάψα και τη χοληδόχο κύστη. Εξέχουσας σημασίας είναι η αναγνώριση και η διατήρηση της ακεραιότητας της οπισθοπεριτοναϊκής μοίρας του δωδεκαδακτύλου. Η αποκάλυψη της κεφαλής του παγκρέατος πιστοποιεί την επάρκεια της παρασκεύης του δωδεκαδάκτυλου και τη δυνατότητα της ασφαλούς απολινώσεως των δεξιών κλάδων των μέσων κολικών αγγείων. Η παρασκευή του δεξιού κόλου από την περιφέρεια προς το κέντρο (πλάγια-προς-μέση παρασκευή, lateral-to-medial approach) γίνεται με την αρχική διατομή του περιτοναίου κατά μήκος της λευκής γραμμής του Τoldt έως το ύψος της ηπατικής καμπής, η κινητοποίηση και ανάσπαση του δεξιού κόλου και ακολούθως τη διατομή του περιτοναίου κατά μήκος της ρίζας του μεσοκόλου, με την απολίνωση και διατομή των αγγειακών στελεχών του να λαμβάνουν χώρα στο τέλος (Εικόνα 6).
Η παρασκευή του εγκαρσίου κόλου και η εκτομή του συμφυόμενου με αυτό επιπλόου ακολουθεί την κινητοποίηση της ηπατικής καμπής και γίνεται με την είσοδο στον ελάσσονα επιπλοϊκό θύλακο η οποία και επιτυγχάνεται με τη διατομή του ελάσσονος επιπλόου κάτωθεν των γαστροεπιπλοϊκών τόξων. Η ανάσπαση του οπίσθιου τοιχώματος του στομάχου βοηθά στην αποφυγή κακώσεων. Το επίπλουν διατέμνεται στο όριο της θέσης του εγκαρσίου κόλου όπου θα διενεργηθεί η αναστόμωση.
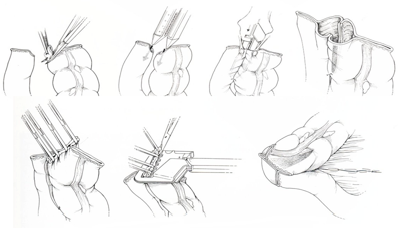
Μετά την παρασκευή του δεξιού κόλου ο τελικός ειλεός διατέμνεται 5 έως 10 εκατοστά εγγύς της ειλεοτυφλικής βαλβίδας προκειμένου την εξασφάλιση ικανής αγγείωσης στο τμήμα αυτό. Το εγκάρσιο κόλο διατέμνεται δεξιά του αγγειακού κορμού της μέσης κολικής αρτηρίας. Το χειρουργικό παρασκεύασμα απομακρύνεται. Η ειλεο-εγκαρσία αναστόμωση εκτελείται με τη χρήση κοπτοσυρραπτικών εργαλείων πλάγιο-παλαγίως μεταξύ των αντιμεσεντερικών επιφανειών των δύο εντερικών κολοβωμάτων (Εικόνα 7). Είναι τεχνικώς ευκολότερη και απαιτεί λιγότερο χρόνο σε σύγκριση με την αναστόμωση η οποία διενεργείται με τη χρήση ραμμάτων. Εάν χρησιμοποιηθούν ράμματα για την κατασκευή της αναστόμωσης, γεγονός που είναι πάνω από όλα θέμα προτίμησης του χειρουργού, βασική προϋπόθεση για την εξασφάλιση της στεγανότητάς της είναι το να συμπεριλαμβάνονται στη ραφή ο ορομυϊκός χιτώνας του εντέρου με μικρό τμήμα της βλεννογονικής στιβάδας. Η σύγκλειση του μεσεντερικού ελλείμμταος είναι προαιρετική.
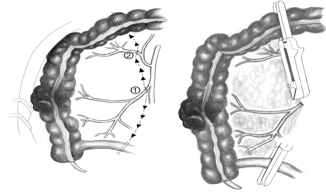
Εικόνα 4. Δεξιά κολεκτομή. Στην τεχνική της παρασκευής του δεξιού κόλου από το κέντρο προς την περιφέρεια (μέση-προς-πλάγια προσέγγιση, medial-to-lateral approach) γίνεται αρχικά αναγνώριση, διατομή και απολίνωση των ειλεοκολικών αγγείων (1) και των δεξιών κλάδων των μέσων κολικών αγγείων (2) στη ρίζα του μεσεντερίου του δεξιού κόλου. Ακολουθεί η διατομή του τελικού ειλεού και του εγκαρσίου κόλου
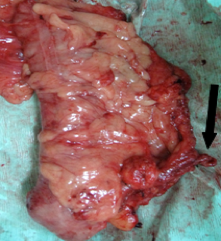
Εικόνα 5. Τμήμα παρασκευάσματος δεξιάς κολεκτομής. Η ειλεοκολική αρτηρία απολινώνεται στην εκφυσή της από την άνω μεσεντέριο αρτηρία (βέλος)
Εικόνα 6. Δεξιά κολεκτομή. Η παρασκευή του δεξιού κόλου από την περιφέρεια προς το κέντρο (πλάγια-προς-μέση παρασκευή, lateral-to-medial approach) γίνεται με την αρχική διατομή του περιτοναίου κατά μήκος της λευκής γραμμής του Τoldt έως το ύψος της ηπατικής καμπής
Εικόνα 7. Η ειλεο-εγκαρσία αναστόμωση εκτελείται με τη χρήση κοπτοσυρραπτικών εργαλείων πλάγιο-παλαγίως μεταξύ των αντιμεσεντερικών επιφανειών των δύο εντερικών κολοβωμάτων
Eκτεταμένη δεξιά κολεκτομή
Ενδείξεις για τη διενέργεια της δεξιάς εκτεταμένης κολεκτομής αποτελούν τα καρκινώματ που εντοπίζονται στο εγκάρσιο κόλον, συμπεριλαμβανομένων της ηπατικής και της σπληνικής καμπής. Τα μέσα κολικά αγγεία, τα οποία διατηρούνται στην τυπική δεξιά κολεκτομή, απολινώνονται κατά την εκτέλεση της εκτεταμένης δεξιάς κολεκτομής. Η επέμβαση παραγματοποιείται με τον ίδιο τρόπο, όπως στη δεξιά κολεκτομή, με τη διαφορά ότι, αντί της παρασκευής του εγκαρσίου μεσοκόλου για την απολίνωση του δεξιού κλάδου της μέσης κολικής αρτηρίας, η παρασκευή του εγκαρσίου κόλου συνεχίζεται οπισθοπεριτοναϊκώς, προκειμένου την ανεύρεση του κυρίου αγγειακού κορμού της μέσης κολικής αρτηρίας έμπροσθεν του παγκρέατος, η οποία και απολινώνεται.
Η είσοδος στον ελάσσονα επιπλοϊκό θύλακο γίνεται διά του γαστροκολικού συνδέσμου επί τα εκτός του γαστροεπιπλοϊκού αγγειακού τόξου, έτσι ώστε το επίπλοθν να εκταμεί μαζί με το εγκάρσιο κόλον. Η σπληνική καμπή απελευθερώνεται από την ουρά του παγκρέατος, τον κάτω πόλο του σπληνός και την πρόσθια επιφάνεια της περινεφρικής περιτονίας. Το αριστερό κόλον και το σύστοιχο μεσεντέριο διαιρούνται εγγύς της αριστερής κολικής αρτηρίας, η οποία διατηρείται για τις δεξιές βλάβες, ενώ ο ανιόν κλάδος της αριστερής κολικής χρειάζεται να απολινωθεί όταν η βλάβη βρίσκεται στο άπω εγκάρσιο και τη σπληνική καμπή, με διατήρηση του κατιόντος κλάδου και των σιγμοειδικών αρτηριών, οπότε και μια περισσότερο άπω ειλεοσιγμοειδική αναστόμωση θα χρειαστεί να κατασκευαστεί (Εικόνα 8). Η ειλεοκατιούσα ή η ειλεοσιγμοειδική αναστόμωση διενεργείται τελικο-τελικά ή πλαγιο-πλάγια, ανάλογα με την προτίμηση του χειρουργού.
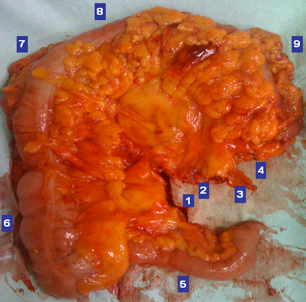
Εικόνα 8. Παρασκεύασμα εκτεταμένης δεξιάς κολεκτομής που έγινε για καρκίνο της μεσότητας του εγκαρσίου κόλου. 1. Ειλεοκολική αρτηρία. 2. Μέση κολική αρτηρία. 3. Ανιόν κλάδος αριστερής κολικής αρτηρίας. 4. Επιχείλιος αρτηρία. 5. Τελικός ειλεός. 6. Δεξιό κόλον. 7. Ηπατική καμπή. 8. Εγκάρσιο κόλον. 9. Σπληνική καμπή
Αριστερή κολεκτομή
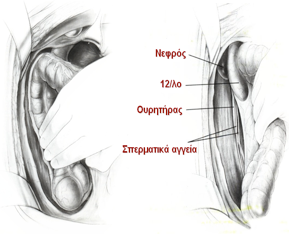
Η αριστερή κολεκτομή ενδείκνυται στους ασθενείς με όγκους που εντοπίζονται στο κατιόν και σιγμοειδές κόλον. Οι αρχές που διέπουν κάθε κολεκτομή, όπως περιγράφονται παραπάνω για τη δεξιά κολεκτομή ισχύουν και εδώ. Κατά τη μέση-προς-πλάγια (medial-to-lateral) κινητοποίηση, το μεσεντέριο του λεπτού εντέρου απωθείται προς το δεξιό άνω τεταρτημόριο της κοιλιάς, προκειμένου την αναγνώριση του στελέχους της κάτω μεσεντερίου αρτηρίας. Διενεργείται επιμήκης διατομή του περιτοναίου κατά μήκος της ρίζας του μεσοκόλου από την ιερά ακρολοφία έως το σύνδεσμο του Treitz. Η κάτω μερσεντεριος αρτηρία απολινώνεται εγγύς της έκφυσης της αριστερής κολικής αρτηρίας και η κάτω μεσεντέριος φλέβα ανευρίσκεται στην περιοχή της νηστιδοδωδεκαδακτυλικής καμπής, κάτω από την ουρά του παγκρέατος, όπου και απολινώνεται.
Ο ανάγγειος χώρος ανάμεσα στο αριστερό μεσόκολο και το οπισθοπεροτόναιο παρασκευάζεται, ούτως ώστε να ανευρεθεί ο αριστρερός ουρητήρας και τα σπερματικά αγγεία, δομές που διατηρούνται απωθούμενες ραχιαίως προς την οπισθοπεριτοναϊκή πλευρά, ενώ το μεσόκολο ανασηκώνεται απομακρυνόμενο από τους οπισθοπεριτοναϊκούς ιστούς. Το σιγμοειδές κινητοποιείται από την είσοδο της πυέλου και ολόκληρο το αριστερό κόλον, που έχει ήδη κινητοποιηθεί από τα μέσα-πρός-πλάγια, παρασκευάζεται από το πλάγιο κοιλιακό τοίχωμα με τη διατομή της πλάγιας περιτοναϊκής ανάκαμψης κατά μήκος της γραμμής του Toldt.
Ακολουθεί η κινητοποίηση της σπληνικής καμπής, με την απελευθέρωση των προσφύσεων της από τον αριστερό νεφρό, το σπλήνα και την ουρά του παγκρέατος. Το επίπλουν συναφαιρείται με το αριστερό εγκάριο κόλον. Ο αριστερός κλάδος της μέσης κολικής αρτηρίας στη βάση του εγκαρσίου μεσοκόλου απολινώνεται, ενώ μπορεί να είναι αναγκαίο να να διαιρεθεί και ο δεξιός κλάδος της, προκειμένου να επιτραπεί στο εγκάρσιο κόλον να «φθάσει» στο σιγμοειδές ή στο ορθό για την αναστόμωση (Εικόνα 9). Εάν όμως υπάρχουν ερωτηματικά όσον αφορά τη βιωσιμότητα του δεξιού κόλου για τη χρησιμοποίησή του ως το εγγύς κολόβωμα της αναστόμωσης, τότε η διενέργεια μιας εκτεταμένης δεξιάς κολεκτομής και ειλεοσιγμοειδικής ή ειλεοορθικής αναστόμωσης είναι προτιμητέα. Αναλόγως του τμήματος του αριστερού κόλου που χρειάζεται να αφαιρεθεί, κάτι που ορίζεται από τη θέση του όγκου, η αναστόμωση μετά τη διατομή και την απομάκρυσνση του παρασκευάσματος διενεργείται στο επίπεδο στου σιγμοειδούς ή στο ορθό, ως κολο-ορθική αναστόμωση.
Κατά την πλάγια-προς-μέση (lateral-to-medial) κινητοποίηση), αρχικά το σιγμοειδές κινητοποιείται από την είσοδο της πυέλου και ολόκληρο το αριστερό κόλον, παρασκευάζεται από το πλάγιο κοιλιακό τοίχωμα με τη διατομή της πλάγιας περιτοναϊκής ανάκαμψης κατά μήκος της γραμμής του Toldt. Η σπληνική καμπή κινητοποιείται με οδηγό το πλάνο που δημιουργείται από την πλάγια κινητοποίηση του αριστερού κόλου. Τελευταία λαμβάνουν χώρα η διατομή του περιτοναίου και η απολίνωση της κάτω μεσεντερίου αρτηρίας και της φλέβας, όπως περιγράφονται παραπάνω.
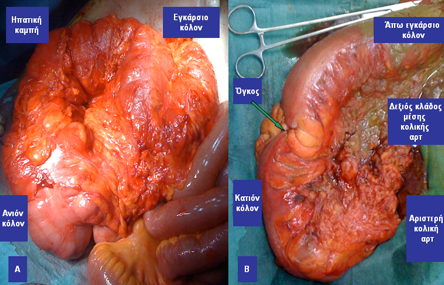
Εικόνα 9. Α. Διατεταμένο δεξιό και εγκάρσιο κόλον σε έδαφος καρκίνου του κατιόντος κόλου που προκαλεί απόφραξη του παχέος εντέρου. Β. Παρασκεύασμα αριστερής κολεκτομής που ακολούθησε. Κατασκευάστηκε τελική εγκαρσιοστομία η οποία αναστράφηκε σε δεύτερο χρόνο για την αποκατάσταση της συνέχειας του εντέρου
Σιγμοειδεκτομή
Η υψηλή απολίνωση της κάτω μεσεντερίου αρτηρίας είναι απαραίτητη κατά τη διενέργεια της σιγμοειδεκτομής, προκειμένου την πληρέστερη δυνατή αφαίρεση του σύστοιχου λεμφαδενικού ιστού, αλλά και για τη δυνατότητα κατασκευής μιας χωρίς τάση αναστόμωσης (Εικόνα 10). Ωστόσο, καλό είναι να γίνεται 1-2 εκ από την έκφυσή της από την αορτή, για την αποφυγή τρώσης του προαρτικού συμπαθητικού κάτω μεσεντερίου πλέγματος και την αποφυγή δυσάρεστων ουρογενετήσιων λειτουργικών διαταράχων μετεγχειρητικά. Ο ανιόν κλάδος της αριστερής κολικής αρτηρίας διατηρείται για την ενίσχυση της ανάδρομης ροής από τη μέση κολική μέσω της επιχειλίου αρτηρίας και την εξασφάλιση της καλύτερης δυνατής αιμάτωσης της αναστόμωσης.
Για την αποφυγή τάσης στην αναστόμωση, η σπληνική καμπή πρέπει να κοινητοπιείται. Είτε με μέση-προ-πλάγια ή με πλάγια-προς-μέση προσέγγιση, το σιγμοειδές κινητοποιείται, ενώ το ανώτερο ορθό κινητοποιείται από την ιερά ακρολοφία (Εικόνα 11). Ο ασθενής πρέπει να βρίσκεται σε θέση λιθοτομής για να καταστεί εφικτή η δια του ορθού, με κυκλικό αναστομωτήρα, διενεργούμενη τελικο-τελική κολο-ορθική αναστόμωση, μετά τη διατομή της ορθοσιγμοειδικής ανάκαμψης (Εικόνα 12).
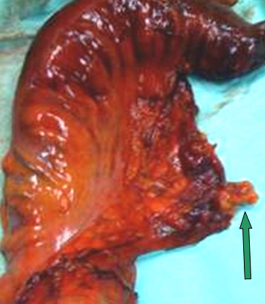
Εικόνα 10. Υψηλή απολίνωση της κάτω μεσεντερίου σε παρασκεύασμα σιγμοειδεκτομής (βέλος)
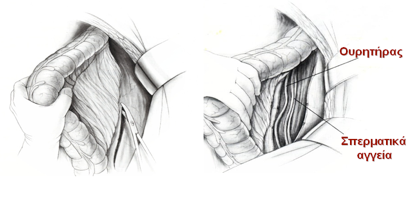
Εικόνα 11. Σιγμοειδεκτομή. Η παρασκευή του αριστερού κόλου από την περιφέρεια προς το κέντρο (πλάγια-προς-μέση παρασκευή, lateral-to-medial approach) γίνεται με την αρχική διατομή του περιτοναίου κατά μήκος της λευκής γραμμής του Τoldt έως το ύψος της σπληνικής καμπής
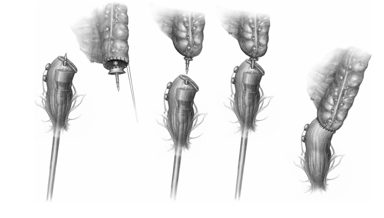
Εικόνα 12. Σιγμοειδεκτομή. Μετά την αφαίρεση του παρασκευάσματος, διενεργείται τελικο-τελική κολο-ορθική αναστόμωση με τη δια του ορθού διεκβολή κυκλικού αναστομωτήρα
Υφολική κολεκτομή
Παρά το γεγονός ότι η εκτομή του μεγαλύτερου τμήματος του παχέος εντέρου απποτελεί μία μείζονα επέμβαση, η αναστόμωση του ειλεού με το σιγμοειδές ή με το ανώτερο ορθό μπορεί να πλεονεκτεί της κολο-κολικής αναστόμωσης ως προς τη συχνότητα και τη βαρύτητα των αναστομωτικών επιπλοκών, λόγω της χρησιμοποίησης του εξ’ ορισμού καλύτερα αγγειούμενου τμήματος του λεπτού εντέρου ως το εγγύς κολόβωμα, αλλά και ίσως από ογκολογικής απόψεως, εάν ληφθεί υπόψιν ότι απομακρύνται το μέγιστο ποσό λεμφαδενικού ιστού, ελαττώνοντας έτσι την πιθανότητα παραμονής υπολειμματικής νόσου.
Η υφολική κολεκτομή απαιτείται στις περιπτώσεις συνδρόμου μη πολυποδισιακού καρκίνου (σύνδρομο Lynch), εξασθενημένων τύπων οικογενούς πολυποδιάσεως (Attenuated Familial Adenomatous Polyposis, AFAP), μετάχρονων ή σύγχρονων καρκίνων σε διαφορετικά τμήματα του παχέος εντέρου, και, συχνά, σε περπτώσεις οξείας κακοήθους απόφραξης, ειδικά εάν το η κατάσταση του εγγύς της απόφραξης τμήματος του παχέος εντέρου είναι άγνωστη. Τα διάφορα τμήματα της παρασκευής, κινητοποίησης και των αγγειακών απολινώσεων που απαιτούνται προκύπτουν από το συνδυασμό των τμηματικών κολεκτομών, όπως αυτές περιγράφεισαν στις παραπάνω επιμέρους ενότητες. Ο τελικός ειλεός κινητοποιείται επαρκώς για να «φθάσει» στο ορθό και η ειλεο-ορθική αναστόμωση διενεργείται τελικο-τελικά ή, συνηθέστερα, πλάγιο-τελικά, με τη βοήθεια του κατάλληλου μεγέθους κυκλικού αναστομωτήρα.
Βιβλιογραφία
1. Nivatvongs S. Complications in colonoscopic polypectomy. An experience with 1,555 polypectomies. Dis Colon Rectum 1986;29:825-30.
2. Nusko G, Mansmann U, Partzsch U, Altendorf-Hofmann A, Groitl H, Wittekind C, et al Invasive carcinoma in colorectal adenomas: multivariate analysis of patient and adenoma characteristics. Endoscopy 1997;29:626-31.
3. Nivatvongs S. Surgical management of malignant colorectal polyps. Surg Clin North Am 2002;82:956-66.
4. Haggitt RC, Glotzbach RE, Soffer EE, Wruble LD.Prognostic factors in colorectal carcinomas arising in adenomas: implications for lesions removed by endoscopic polypectomy. Gastroenterology. 1985;89:328-36.
5. Kudo S. Endoscopic mucosal resection of flat and depressed types of early colorectal cancer. Endoscopy 1993;25:455-61.
6. Nivatvongs S, Rojanasakul A, Reiman HM, Dozois RR, Wolff BG, Pemberton JH, et al. The risk of lymph node metastasis in colorectal polyps with invasive adenocarcinoma. Dis Colon Rectum 1991;34:323-8.
7. Nascimbeni R, Burgart LJ, Nivatvongs S, Larson DR. Risk of lymph node metastasis in T1 carcinoma of the colon and rectum. Dis Colon Rectum. 2002;45:200-6.
8. Kikuchi R, Takano M, Takagi K, Fujimoto N, Nozaki R, Fujiyoshi T, Uchida Y. Management of early invasive colorectal cancer. Risk of recurrence and clinical guidelines. Dis Colon Rectum. 1995;38:1286-95.
9. Ueno H, Mochizuki H, Hashiguchi Y, Shimazaki H, Aida S, Hase K, et al. Risk factors for an adverse outcome in early invasive colorectal carcinoma. Gastroenterology. 2004;127:385-94.
10. Seitz U, Bohnacker S, Seewald S, Thonke F, Brand B, Bräiutigam T, Soehendra N. Is endoscopic polypectomy an adequate therapy for malignant colorectal adenomas? Presentation of 114 patients and review of the literature. Dis Colon Rectum. 2004 ;47:1789-96
11. NCCN Clinical Practice Guidelines in Oncology Colon Cancer V.I.2009. www.nccn.org
12. Senagore AJ, Fry R. Surgical management of colon cancer. In: Wolff BG, Fleshman JW, Beck DE, Pemerton JH, Wexner SD, editors. The ASCRS Textbook of Colon and Rectal Surgery. New York: Springer; 2007. p. 395-404
13. Otchy D, Hyman NH, Simmang C, Anthony T, Buie D, Cataldo P, et al. Practice Parameters for Colon Cancer Prepared by The Standards Practice Task Force
The American Society of Colon and Rectal Surgeons. Dis Colon Rectum 2004; 47: 1269–1284
14. Nelson H, Petrelli N, Carlin A, Couture J, Fleshman J, Guillem J, et al. Guidelines 2000 for Colon and Rectal Cancer Surgery J Natl Cancer Inst 2001;93:583–96
15. McAndrew MR, Saba A. Efficacy of routine preoperative computed tomography scans in colon cancer. Am Surg 1999;65:205–8.
16. Hundt W, Braunschweig R, Reiser M. Abdominal radiology: evaluation of spiral CT in staging of colon and rectum carcinoma. Eur Radiol 1999;9:78–84.
17. Lavin PT, Day J, Holyoke ED, et al. A statistical evaluation of baseline and follow-up carcinoembryonic antigen in patients with resectable colorectal carcinoma. Cancer 1981;47:823–6.
18. Steele G, Ellenberg S, Ramming K, et al. CEA monitoring among patients in multi-institutional adjuvant therapy protocols. Ann Surg 1982;196:162–9.
19. Zmora O, Mahajna A, Barak B, et al. Colon and rectal surgery without mechanical bowel preparation: randomized prospective trial. Ann Surg 2003;237:363–7.
20. Guenaga KF, Matos D, Castro AA, Atallah AN, Wille-Jorgensen P. Mechanical bowel preparation for elective colorectal surgery. Cochrane Databse Syst Rev 2003;(2):CD001544
21. BucherP, Mermillod B, Morel P, Sovaria C. Does mechanical bowel preparation have a role in preventing postoperativecomplicationsin elective colorectal surgery? Swiss Med Wkly 2004;134(5-6):69-74
22. Baum ML, Anish DS, Chalmers TC, Sacks HS, Smith J, Fagerstrom RM. A survey of clinical trials of antibiotic prophylaxis in colon surgery: evidence against further use of no-treatment controls. N Engl J Med 1981;305: 795–8.
23. Polk HC, Lopez-Mayor JF. Postoperative wound infection: a prospective study of determinant factors and prevention. Surgery 1969;66:97–103.
24. Stone HH, Hooper CA, Kolb LD, Geheber CE, Dawkins EJ. Antibiotic prophylaxis in gastric, biliary, and colonic surgery. Ann Surg 1976;184:443–50.
25. Stone HH, Haney BB, Kolb LD, Geheber CE, Hooper CA. Prophylactic and preventive antibiotic therapy: timing, duration and economics. Ann Surg 1979;189: 691–9.
26. Chung M, Steinmetz OK, Gordon PH. Perioperative blood transfusion and outcome after resection for colorectal carcinoma. Br J Surg 1993;80:427–32.
27. Jensen LS, Kissmeyer-Nielsen P, Wolff B, Qvist N. Randomized comparison of leucocyte-depleted versus buffy-coat poor blood transfusion and complications after colorectal surgery. Lancet 1996;348:841–5.
28. Busch OR, Hop WC, Hoynck MA, Marguet RL, Jeekel J. Blood transfusions and prognosis in colorectal cancer. N Engl J Med 1993;328:1372–6.
29. Tang R, Wang JY, Chien CR, Chen JS, Lin SE, Fan HA. The association between perioperative blood transfusion and survival of patients with colorectal cancer. Cancer 1993;72:341–8.
30. Anonymous. Practice guidelines for blood component therapy. A report by the American Society of Anesthesiologists Task Force on Blood Component Therapy. Anesthesiology 1996;84:732–47.
31. Jensen LS, Andersen AJ, Christiansen PM, et al. Postoperative infection and natural killer cell function following blood transfusion in patients undergoing elective colorectal surgery. Br J Surg 1992;79:513–6.
32. Fischer E, Lenhard V, Seifert P, Kluge A, Johannsen R. Blood transfusion induced suppression of cellular immunity in man. Hum Immunol 1980;3:187–94.
33. van Twuyver E, Mooijaart RJ, Berge IJ, et al. Pretransplantation blood transfusion revisited. N Engl J Med 1991;325:1210–3.
34. Houbiers JG, van de Velde CJ, van de Watering IM, et al. Transfusion of red cells is associated with increased incidence of bacterial infection after colorectal surgery; a prospective study. Transfusion (Paris) 1997;37: 126–34.
35. Vignali A, Braga M, Dionigi P, et al. Impact of a programme of autologous blood donation on the incidence of infection in patients with colorectal cancer. Eur J Surg 1995;161:487–92.
36. Voogt PG, van de Velde CJ, Brand A, et al. Perioperative blood transfusion and cancer prognosis. Cancer 1987;59:836–43.
37. Heiss MM, Mempel W, Delanoff C, et al. Blood transfusion- modulated tumor recurrence; first results of a randomized study of autologous versus allogenic blood transfusion in colorectal cancer surgery. J Clin Oncol 1994;12:1859–67.
38. Vanvakas EC. Perioperative blood transfusion and cancer recurrence, meta-analysis for explanation. Transfusion (Paris) 1995;35:760–8.
39. Collins R, Scrimgeour A, Yusuf S, Peto R. Reduction in fatal pulmonary embolism and venous thrombosis by perioperative administration of subcutaneous heparin. Overview of results of randomized trials in general, orthopedic and urologic surgery. N Engl J Med 1988; 318:1162–73.
40. Ho Y-H, Seow-Choen F, Leong A, Eu K-W, Nyam D, Teoh M-K. Randomized, controlled trial of low molecular weight heparin vs. no deep vein thrombosis prophylaxis for major colon and rectal surgery in Asian patients. Dis Colon Rectum 1999;42:196–203.
41. Kakkar VV, Djazaeri B, Fokm J, Fletcher M, Sculh MF, Westwick J. Low-molecular-weight heparin and prevention of postoperative deep vein thrombosis. Br J Med 1982;284:375–9.
42. Turpie AG, Levin MN, Hirsh J, et al. A randomized controlled trial of a low-molecula-weight heparin (Enoxaprin) to prevent deep-vein thrombosis in patients undergoing elective hip surgery. N Engl J Med 1986;315:925–9.
43. McLeod RS, Geerts WH, Sniderman KW, et al. Subcutaneous heparin versus low-molecular-weight heparin as thromboprophylaxis in patients undergoing colorectal surgery. Results of the Canadian colorectal DVT Prophylaxis Trial: a randomized, double-blind trial. Ann Surg 2001;233:438–44
44. Dentsman F, Lowry A, Vernava A, et al. Practice parameters for the prevention of venous thromboembolism. Dis Colon Rectum 2000;43:1037–47.
45. Rouffet F, Hay JM, Vacher B, Fingerhut A, Elhadad A, Flamant Y, et al. Curative resection for left colonic carcinoma: hemicolectomy vs. segmental colectomy. A prospective, controlled, multicenter trial. French Association for Surgical Research. Dis Colon Rectum. 1994;37:651-9.
46. Malassagne B, Valleur P, Serra J, Sarnacki S, Galian A, Hoang C, Hautefeuille P. Relationship of apical lymph node involvement to survival in resected colon carcinoma. Dis Colon Rectum. 1993;36:645-53.
47. Newland RC, Chapes PH, Smyth EJ. The prognostic value of substaging colorectal cancer. Cancer 1987;60: 852–7.
48. Kawamura YJ, Umetani N, Sunami E, Watanabe T, Masaki T, Muto T. Effect of high ligation on the long-term of patients with operable colon cancer, particularly those with limited nodal involvement. Eur J Surg 2000; 166:803–7.
49. Scott KW, Grace RH. Detection of lymph node metastases in colorectal carcinoma before and after fat clearance. Br J Surg 1989;76:1165–7.
50. Goldstein NS, Sanford W, Coffey M, Layfield LJ. Lymph node recovery from colorectal resection specimens removed for adenocarcinoma. Trends over time and a recommendation for a minimum number of lymph nodes to be recovered. Am J Clin Pathol. 1996;106:209-16.
51. Hernanz F, Revuelta S, Redondo C, Madrazo C, Castillo J, Gomez-Fleitas M. Colorectal adenocarcinoma: quality of the assessment of lymph node metastases. Dis
Colon Rectum 1994;37:373–7.
52. Haboubi NY, Clark P, Kaftan SM, Schofield PF. The importance of combining xylene clearance and immunohistochemistry in the accurate staging of colorectal carcinoma. J R Soc Med 1992;85:386–8.
53. Le Voyer TE, Sigurdson ER, Hanlon AL, Mayer RJ, Macdonald JS, Catalano PJ, Haller DG. Colon cancer survival is associated with increasing number of lymph nodes analyzed: a secondary survey of intergroup trial INT-0089. J Clin Oncol. 2003;21:2912-9.
54. Sarli L, Bader G, Iusco D, Salvemini C, Mauro DD, Mazzeo A, et al. Number of lymph nodes examined and prognosis of TNM stage II colorectal cancer. Eur J Cancer. 2005 Jan;41(2):272-9.
55. Johnson PM, Porter GA, Ricciardi R, Baxter NN. Increasing negative lymph node count is independently associated with improved long-term survival in stage IIIB and IIIC colon cancer. J Clin Oncol. 2006;24:3570-5.
56. Turnbull RB Jr, Kyle K, Watson FR, Spratt J. Cancer of the colon: the influence of the no-touch isolation technic on survival rates. Ann Surg 1967;166:420–7.
57. Wiggers T, Jeekel J, Arends JW, Brinkhorst AP, Kluck HM, Luyk CI, et al. No-touch isolation technique in colon cancer: a controlled prospective trial. Br J Surg 1988;75:409–15.
58. Garcia-Olmo D, Ontanon J, Garcia-Olmo DC, Vallejo M, Cifuentes J. Experimental evidence does not support use of the “no-touch” isolation technique in colorectal cancer. Dis Colon Rectum 1999;42:1449–56
59. Hayashi N, Egami H, Kai M, Kurusu Y, Takano S, Ogawa M. No-touch isolation technique reduces intraoperative shedding of tumor cells into the portal vein during resection of colorectal cancer. Surgery 1999;125:369–74.
60. Welch JP. Multiple colorectal tumors: an appraisal of natural history and therapeutic options. Am J Surg 1981;142:274–80.
61. Whelan RL, Wong WD, Goldberg SM, Rothenberger DA. Synchronous bowel anastomoses. Dis Colon Rectum 1989;32:365–8.
62. Sugerbaker PH, Corlew S. Influence of surgical techniques on survival in patients with colorectal cancer: a review. Dis Colon Rectum 1982;25:545–57.
63. Lopez MS, Monafo WW. Role of extended resection in the initial treatment of locally advanced colorectal carcinoma. Surgery 1993;113:365–72.
64. Gall FP, Tonak J, Altendorf A. Multivisceral resections in colorectal cancer. Dis Colon Rectum 1987;30:337–41.
65. Hunter JA, Ryan JA, Schultz P. En bloc resection of colon cancer adherent to other organs. Am J Surg 1987;154:67–71.
66. Talamonti MS, Shumate CR, Carlson GW, Curley SA. Locally advanced carcinoma of the colon and rectum involving the urinary bladder. Surg Gynecol Obstet 1993;177:481–7.
67. Mulsow J, Winter DC, O'Keane C, O'Connell PR. Sentinel lymph node mapping in colorectal cancer. Br J Surg. 2003;90:1452.
68. Joosten JJ, Strobbe LJ, Wauters CA, Pruszczynski M, Wobbes T, Ruers TJ. Intraoperative lymphatic mapping and the sentinel node concept in colorectal carcinoma. Br J Surg. 1999;86:482-6.
69. Kitagawa Y, Watanabe M, Hasegawa H, Yamamoto S, Fujii H, Yamamoto K, et al. Sentinel node mapping for colorectal cancer with radioactive tracer. Dis Colon Rectum. 2002 Nov;45(11):1476-80.
70. Bertagnolli M, Miedema B, Redston M, Dowell J, Niedzwiecki D, Fleshman J, et al. Sentinel node staging of resectable colon cancer: results of a multicenter study. Ann Surg. 2004;240:624-8.
71. Young-Fadok TM, Wolff BG, Nivatrongs S, Metzger PP, Ilstrup DM. Prophylactic oophorectomy in colorectal carcinoma: preliminary results of a randomized, prospective trial. Dis Colon Rectum 1998;41: 277–85.
72. Morrow M, Enker WE. Late ovarian metastases in carcinoma of the colon and rectum. Arch Surg 1984;119: 1385–8.
73. Stocchi L, Nelson H. Laparoscopic colectomy for colon cancer: Trial update. J Surg Oncol 1998;68:255–67.
74. Runkel HS, Hinz U, Lehnert T, Buhr HJ, Herfarth C. Improved outcome after emergency surgery for cancer of the large intestine. Br J Surg 1998;85:1260–5.
75. Smithers BM, Theile DE, Cohen JR, Evans EB, Davis NC. Emergency right hemicolectomy in colon carcinoma: a prospective study. ANZ J Surg 1986;56:749– 52.
76. Matheson NA. Management of obstructed and perforated large bowel carcinoma. Bailleires Clin Gastroenterol 1989;3:671–97.
77. Lopez-Kostner F, Hool GR, Lavery IC. Management and causes of acute large bowel obstruction. Surg Clin North Am 1997;77:1265–90.
78. The SCOTIA Group. Single stage treatment for malignant left-sided colonic obstruction: a prospective randomized clinical trial comparing subtotal colectomy with segmental resection following intraoperative irrigation. Br J Surg 1995;82:1622–7.
79. Kopera T, Kisser M, Schultz F. Emergency surgery for colon cancer in the aged. Arch Surg 1997;132:1032–7.
80. Perrier G, Peillon C, Liberge N, Steinmetz L, Boyet L, Testart J. Cecostomy is a useful surgical procedure: study of 113 colonic obstructions caused by cancer. Dis Colon Rectum 2000;43:50–4.
81. Kronberg O. Acute obstruction from tumor in the left colon without spread. A randomized trial of emergency colostomy versus resection. Int J Colorectal Dis 1995;10:1–5.
82. Dauphine CE, Tan P, Beart RW, Vukasin P, Cohen H, Corman ML. Placement of self-expanding metal stents for acute management of large-bowel obstruction: a collective review. Ann Surg Oncol 2002;9:574–9.
83. Spinelli P, Mancini A. Use of self-expanding metal stents for palliation of rectosigmoid cancer. Gastrointest Endosc 2001;53:203–6.
84. Binkert CA, Ledermann H, Jost R, Saurenmann P, Decurtins M, Zollikofer CL. Acute colonic obstruction: clinical aspects and cost-effectiveness of preoperative and palliative treatment with self-expanding metallic stents: a preliminary report. Radiology 1998;206:199–204.
85. Camunez F, Echenagusia A, Simo G, Turgano F, Vasquez J, Barreiro-Meiro I. Malignant colorectal obstruction treated by means of self-expanding metallic stents: effectiveness before surgery and in palliation. Radiology 2000;216:492–7.
86. Corman ML. Carcinoma of the colon. In: Corman ML, editor. Colon and rectal surgery. Philadelphia: Lippincott- Raven 1998, p:625–732.
87. Vernava AM, Moore BA, Longo WE, Johnson FE. Lower gastrointestinal bleeding. Dis Colon Rectum 1997;40:846–58.
88. Parkes BM, Obeid FN, Sorensen VJ, Horst HM, Fath JJ. The management of massive lower gastrointestinal bleeding. Am Surg 1993;59:676–8.
89. Farner F, Lichliter W, Kuhn J, Fisher T. Total colectomy versus limited colonic resection for acute lower gastrointestinal bleeding. Am J Surg 1999;178:587–91.
